牛源肠道益生菌BN-10菌株发酵产抗菌蛋白条件优化
2013-02-20姜军坡范会兰王世英
■姜军坡 范会兰 王世英
(河北农业大学生命科学学院,河北保定 071001)
腹泻是犊牛的一种最常见的疾病,以黏膜发炎、糜烂、坏死和腹泻为特征,是小牛死亡的最常见病因[1-2]。研究表明,腹泻是肠道菌群失调的必然结果,腹泻时,直肠中的大肠杆菌数明显增加,腹泻康复时则相反[3]。肠道益生菌能帮助动物建立协调的胃肠道微生物区系,有效预防腹泻,同时还可促进动物的生长发育,提高饲料利用率[4]。芽孢杆菌是微生态益生菌制剂的一种常用菌种[5],由于芽孢杆菌型益生菌产品大多采用芽孢形式的菌体,对不良环境的抵抗力较强,能有效缓解益生菌在使用、生产、运输、保存过程中失效的问题,因而受到人们的日益关注。
在微生物培养基的优化过程中,利用统计软件进行试验设计和分析,可以简化试验步骤,避免主观臆断并提高准确性[6]。刘俏等[7]以青霉素发酵为例,采用MATLAB软件对其发酵过程进行优化,得到了青霉素发酵的最佳培养基配比,其优化过程极为简便。郑毅等[8]采用二水平Plackett-Burman设计和响应面分析法(Response surface methodology)快速优化产木聚糖酶的液体培养基组成,从众多因素中筛选出重要因子,准确指明最佳控制条件。
BN-10菌株是从健康牛的粪便中筛选出的一株对大肠杆菌有强烈抑制作用的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。前期研究发现,BN-10菌株发酵液去菌体后仍然可以抑制大肠杆菌,但是若再经121℃热处理,则会丧失其对大肠杆菌的抑制活性;同时还发现,发酵液去菌体后的硫酸铵沉淀物可以抑制大肠杆菌,但是发酵液去菌体后的氯仿提取物对大肠杆菌没有抑制活性;故初步判断BN-10菌株能够抑制大肠杆菌的胞外产物为蛋白质。因此,本文对BN-10菌株细胞外产蛋白条件进行了研究,采用SPSS 15.0软件进行分析,以获得产生较多胞外抑菌蛋白的条件,为进一步研究该菌株所产胞外抗菌蛋白的性质奠定基础,以便从分子水平研究该菌株的安全性问题。
1 材料和方法
1.1 试验材料
1.1.1 仪器
ZHWY-2112B型双层摇床(上海智诚分析仪器有限公司)、GL-20G-II型高速冷冻离心机(上海安亭实验仪器总厂)。
1.1.2 菌株
病原菌:大肠杆菌(Escherichia coli)一株,由河北大学赠送。
拮抗细菌:解淀粉芽孢杆菌BN-10菌株,由本实验室分离保存。
1.1.3 培养基
芽孢杆菌NA培养基组成参照《微生物学实验》[9]。NB培养基为NA的液体形式,即不向其中加琼脂。
大肠杆菌LB培养基组成参照《微生物学实验》[9]。
种子培养基:蛋白胨2%、蔗糖2%、NaH2PO4·2H2O 0.1%、Na2HPO4·2H2O 0.2%、MgSO4·7H2O 0.05%、CaCl20.02%,pH值7.0~7.2。
基础发酵培养基同种子培养基。
1.2 试验方法
1.2.1 BN-10菌株种子液培养
将斜面培养的BN-10菌株接种于装有种子培养基的三角瓶中。于200 r/min、37℃,摇床培养12 h后使用,摇瓶容量为250 ml,装瓶量为100 ml。
1.2.2 BN-10菌株产胞外抗菌蛋白活性的测定
将BN-10菌株转接NA斜面,活化12 h后,按6.0%的接种量接种于装瓶量为100 ml/250 ml发酵培养基中,200 r/min、37℃下培养48 h。发酵培养基根据试验需要配制。
将E.coli接种于NA斜面,37℃培养24 h,加入5 ml灭菌去离子水,轻轻刮下菌丝,充分振荡混匀,制成含大肠杆菌的悬浮液,然后将其加入100 ml融化冷却至50℃左右的NA培养基中,摇匀,倒入灭菌平皿中,制成含E.coli琼脂平板。待E.coli平板凝固后,选择合适的间距用打孔器在上面打孔,并向每个小孔内分别加入50 μl已离心除菌体的BN-10菌株发酵液,静置30 min后,于恒温箱中37℃培养24 h,测量所产生的抑菌圈面积。抑菌圈的面积可以表征发酵液中抗菌蛋白的产量。
1.2.3 培养基组成对BN-10菌株产抗菌蛋白影响的测定
1.2.3.1 无机盐种类对BN-10菌株产抗菌蛋白影响的测定
分 别 以 MnSO4、FeSO4、KCl、NaCl、MgSO4·7H2O、CaCl2、ZnSO4作为发酵液的不同无机盐,含量均为0.05%;添加NaH2PO4·2H2O 0.1%、Na2HPO4·2H2O 0.2%作为缓冲物质;氮源为蛋白胨,含量2%;碳源为蔗糖,含量2%。分别测量发酵产抗菌蛋白的抑菌圈面积。
1.2.3.2 氮源种类对BN-10菌株产抗菌蛋白影响的测定
分别以蛋白胨、大豆蛋白胨、胰蛋白胨、黄豆粕粉、牛肉膏、酪蛋白胨、尿素、硫酸铵作为发酵液的不同氮源,含量均为2%;碳源为蔗糖,含量2%;无机盐为2种,依据试验而确定,含量均为0.05%;添加NaH2PO4·2H2O 0.1%、Na2HPO4·2H2O 0.2%作为缓冲物质。分别测量发酵产抗菌蛋白的抑菌圈面积。
1.2.3.3 碳源种类对BN-10菌株产抗菌蛋白影响的测定
分别以玉米粉、葡萄糖、蔗糖、乳糖、可溶性淀粉、糊精、甘露醇、麦芽糖作为发酵液的不同碳源,含量均为2%;氮源依据试验而确定,含量2%;无机盐为2种,依据试验而确定,含量均为0.05%;添加NaH2PO4·2H2O 0.1%、Na2HPO4·2H2O 0.2%作为缓冲物质。分别测量发酵产抗菌蛋白的抑菌圈面积。
1.2.3.4 BN-10菌株发酵培养基组成的正交优化
按正交试验L16(45)设计5因素各4个水平试验,根据上述试验确定的最适碳源、氮源、无机盐配制不同组成的培养基。分别测量发酵产抗菌蛋白的抑菌圈面积。采用SPSS软件对正交试验结果进行极差(Range)分析和一般线性模型(General Linear Model,GLM)分析,以得出最佳培养基组成。若优化的最佳培养基组成未在正交表中出现,则平行测定最佳培养基和正交表中最佳组成对应的抑菌圈面积,重复6次,进行比较。
1.2.4 发酵条件对BN-10菌株产抗菌蛋白影响的测定
培养基组成优化完成后,根据所得结果配制培养基,按正交试验L16(45)设计5因素各4个水平试验。分别测量发酵产抗菌蛋白的抑菌圈面积。采用SPSS软件对发酵条件正交试验结果进行极差分析和一般线性模型分析,以确定最佳发酵条件。若优化的最佳发酵条件未在正交表中出现,则平行测定最佳发酵条件和正交表中最佳组成对应的抑菌圈面积,重复6次,进行比较。
2 结果与讨论
2.1 培养基组成对BN-10菌株产抗菌蛋白的影响
2.1.1 无机盐种类对BN-10菌株产抗菌蛋白的影响(见图1)
由图1可知,以ZnSO4和KCl作为培养基的无机盐时,产生的抑菌圈较大,相对应的抗菌蛋白产量较高。故选用ZnSO4(无机盐Ⅰ)和KCl(无机盐Ⅱ)作为BN-10菌株产抗菌蛋白培养基的无机盐。
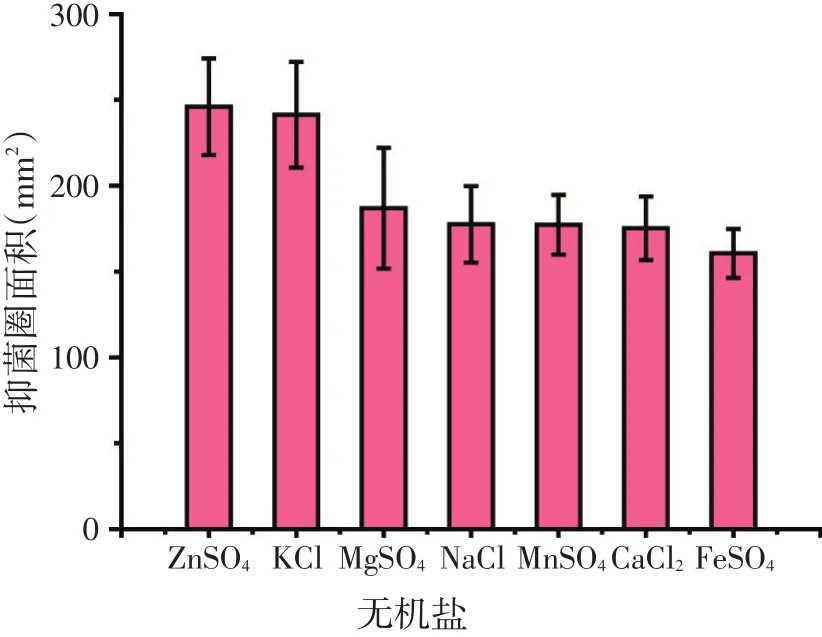
图1 无机盐对Bacillus amyloliquefaciens BN-10菌株产抗菌蛋白的影响
2.1.2 氮源种类对BN-10菌株产抗菌蛋白的影响(见图2)
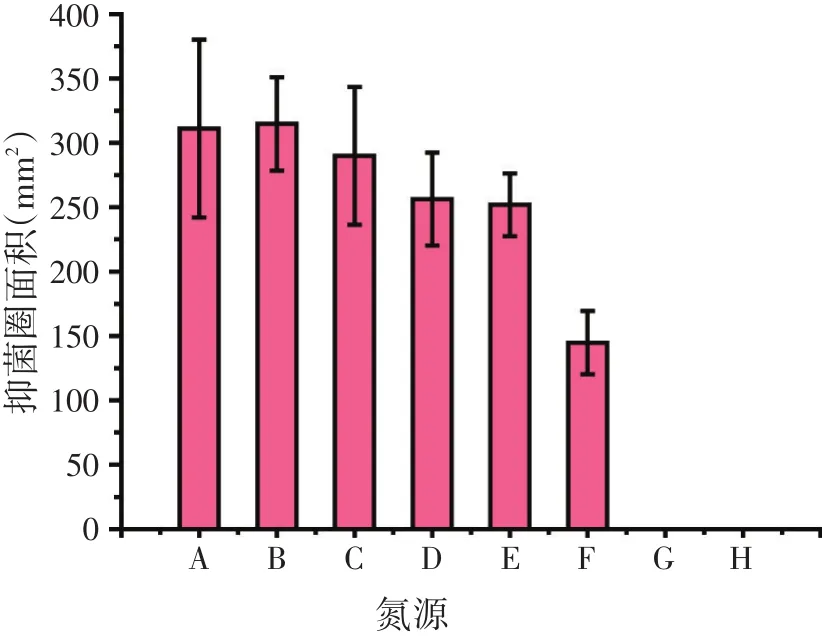
图2 氮源对Bacillus amyloliquefaciens BN-10菌株产抗菌蛋白的影响
采用8种不同的氮源对BN-10菌株发酵产抗菌蛋白量进行考察,结果表明,以尿素和硫酸铵为氮源时无抑菌圈,而在其余的6种氮源中,以酪蛋白胨、牛肉膏、大豆蛋白胨、黄豆粕粉为氮源时抑菌圈较大,相应的抗菌蛋白产量较高。考虑到黄豆粕粉和酪蛋白胨所对应的抑菌圈面积大小没有显著区别,但是黄豆粕粉价格低廉,可以降低生产成本,最终选用黄豆粕粉作为BN-10菌株发酵培养基的氮源。
2.1.3 碳源种类对BN-10菌株产抗菌蛋白的影响(见图3)
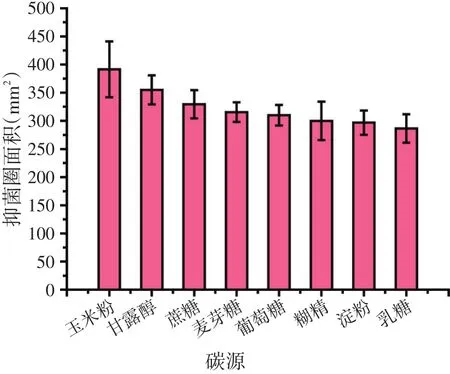
图3 碳源对Bacillus amyloliquefaciens BN-10菌株产抗菌蛋白的影响
由图3可知,产抗菌蛋白最多的3种碳源,从大到小依次为玉米粉、甘露醇和蔗糖,且由图3可知,这三者之间并没有显著差别。从原料价格因素出发,采用玉米粉最佳,但是以玉米粉作为碳源,还需考虑玉米粉的液化问题,这会导致发酵工艺复杂化,也间接导致成本的增加;而以蔗糖为碳源,其价格适中,发酵成本较低,故最终采用蔗糖作为BN-10菌株发酵产抗菌蛋白培养基的碳源。
2.1.4 培养基组成的优化
改变蔗糖、黄豆粕粉、ZnSO4和KCl的含量,进行正交试验,正交试验结果见表1。对正交试验结果进行极差分析和GLM分析,分别如表2和表3所示。由表2可知,各因素水平对结果影响的强弱顺序为 A2>A1>A4>A3、B4>B3>B2>B1、C1>C2>C3>C4、D2>D4>D3>D1,各因素的主次顺序为B>C>A>D,即黄豆粕粉>ZnSO4>蔗糖>KCl。由表3可知,因素B和C对试验结果影响显著(P<0.05),而因素A和D对试验结果影响不大,即ZnSO4和氮源的浓度变化对试验结果的影响较为显著。由极差分析可知,培养基正交试验优化出来的最佳配方为A2B4C1D2,但由于组成为A2B4C1D2的培养基未在正交试验中出现,故应与正交试验各个培养基中产抗菌蛋白量最高者进行比较,即与组成为A4B4C1D3的培养基进行比较(见表4)。同法操作下,组成为A2B4C1D2的培养基,其平均抑菌圈面积为3.347 cm2(n=6);组成为A4B4C1D3的培养基,其平均抑菌圈面积为3.017 cm2(n=6)。比较试验表明,正交试验优化出的培养基组成对应的抑菌圈面积最高,其对应的组成为蔗糖含量为2%、黄豆粕粉为5%、ZnSO4含量为0.01%、KCl含量为0.02%。
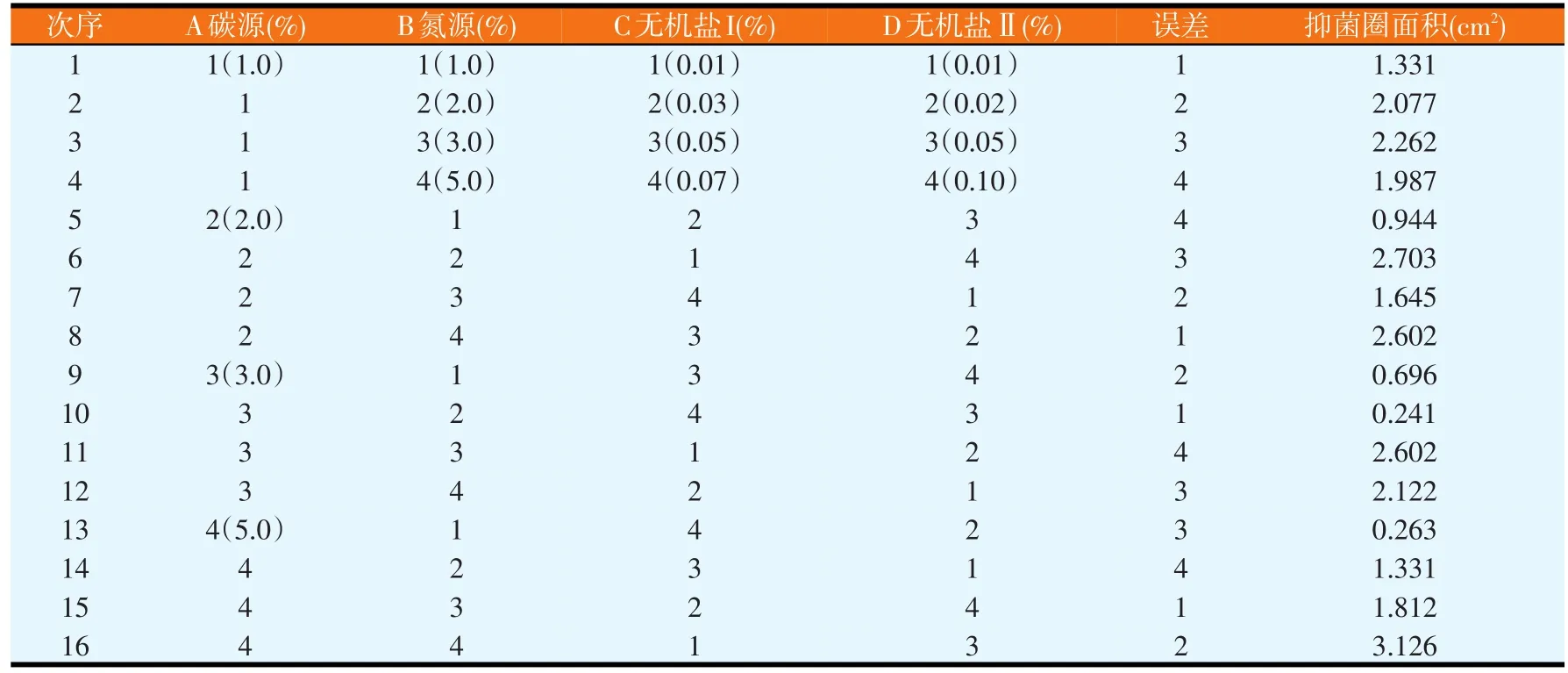
表1 培养基组成正交试验方案与结果
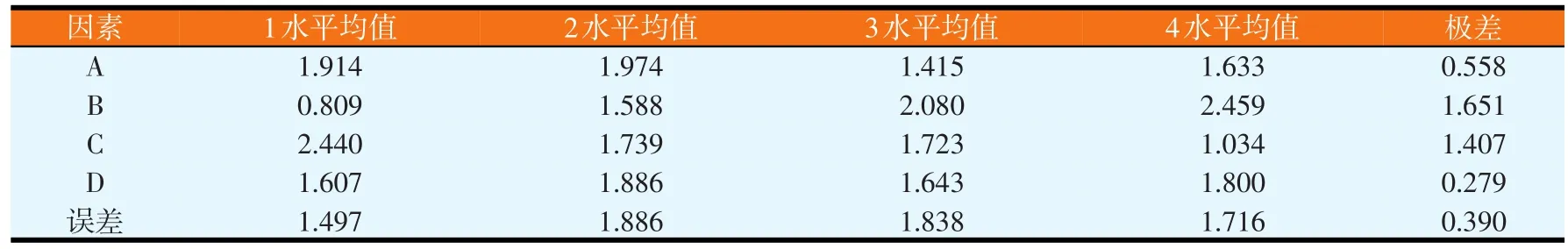
表2 培养基组成正交试验结果极差分析(cm2)
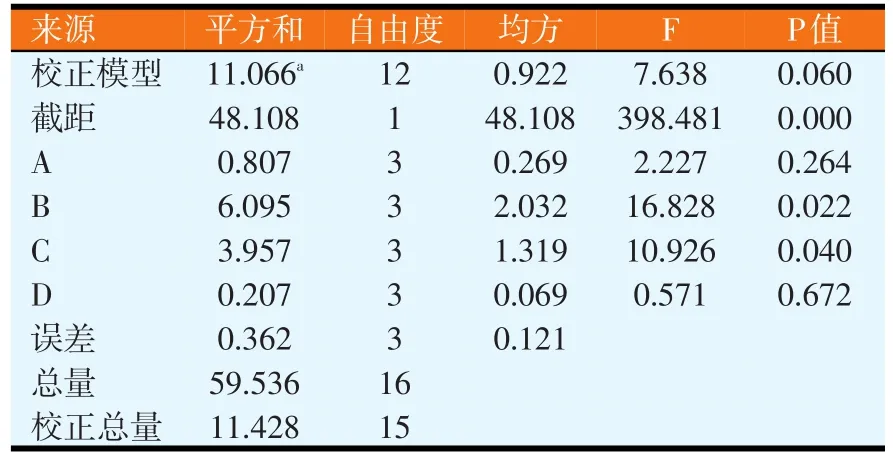
表3 培养基组成正交试验结果方差分析
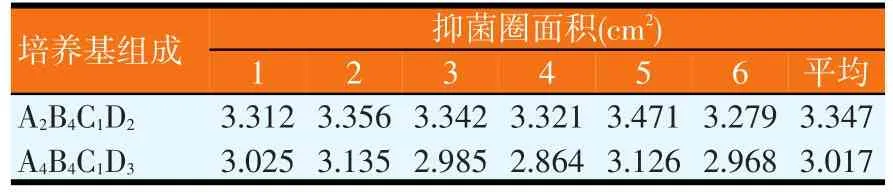
表4 培养基组成正交优化验证试验的结果
2.2 发酵条件对BN-10菌株产抗菌蛋白的影响
改变发酵时间、装瓶量、接种量、培养基初始pH值,进行正交试验,试验结果见表5。对结果进行极差分析和GLM分析,分别如表6和表7所示。由表6可知,各因素水平对结果影响的强弱顺序为A4>A2>A3>A1、B1>B2>B3>B4、C1>C2>C4>C3、D1>D4>D2>D3,各因素的主次顺序为装瓶量>接种量>培养基初始pH值>发酵时间。由表7可知,因素B对试验结果影响显著(P<0.05),而因素A、C和D均对试验结果影响不显著,即装瓶量的变化对试验结果的影响显著。由极差分析可知,最佳的发酵条件为A4B1C1D1,但由于发酵条件A4B1C1D1未在正交试验中出现,故应与正交试验各个发酵条件中产抗菌蛋白量最高者进行比较,即发酵条件A1B1C1D1进行比较(见表8)。同法操作下,发酵条件A4B1C1D1对应的平均抑菌圈面积为3.871cm2(n=6);发酵条件A1B1C1D1对应的平均抑菌圈面积为3.347cm2(n=6)。通过比较可知,BN-10菌株在发酵条件A4B1C1D1下比在发酵条件A1B1C1D1下产蛋白量大,但是两个发酵条件的差异仅在于发酵时间不同,兼顾效率,最终采用发酵条件A1B1C1D1作为最佳发酵条件,即发酵时间24 h、装瓶量30 ml/250 ml,接种量2%,培养基初始pH值为6.0。
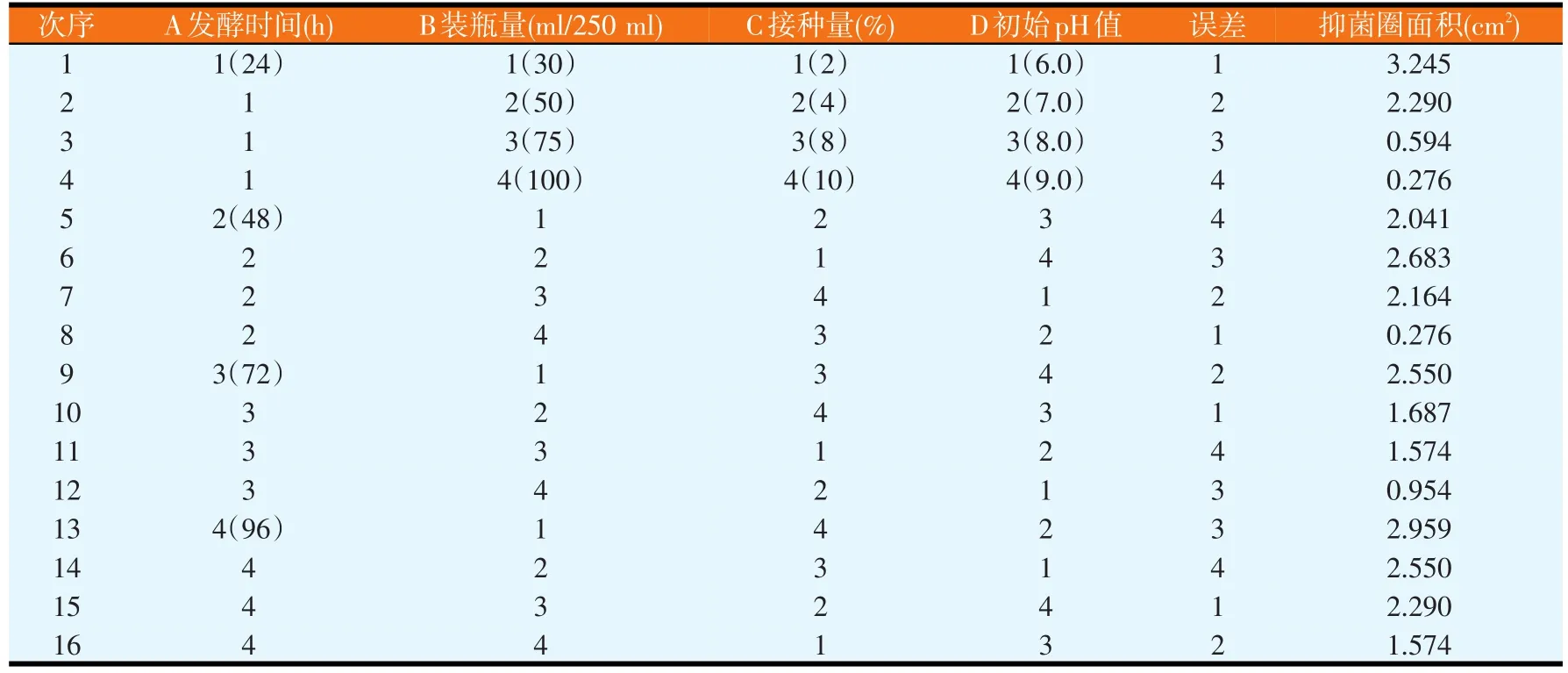
表5 发酵条件正交试验方案与结果
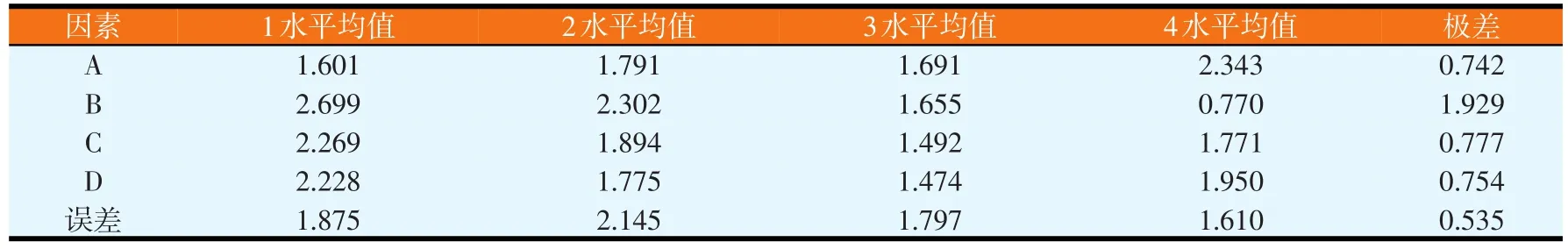
表6 发酵条件正交试验结果极差分析(cm2)
3 讨论与结论
BN-10菌株产生的胞外蛋白抑制大肠杆菌的活性和抑菌圈面积有一定相关性,因而可以借助抑菌圈的面积来评价胞外蛋白的活性。培养基组成是影响菌株发酵产胞外蛋白的主要因素,适宜的发酵条件也是一个至关重要的影响因素,通过优化菌株的培养基组成及发酵条件,可以充分发挥菌株的抑菌潜力[10]。通过培养基的组成和发酵条件优化,胞外蛋白对大肠杆菌的抑菌圈面积由2.3 cm2增大3.8 cm2,增幅达65.2%。由于抑菌圈面积和胞外蛋白的效价对数值成线性关系,这表明通过培养基组成和发酵条件的优化可以极大地提高胞外蛋白的产量。以提高胞外抑菌蛋白产量为前提,同时兼顾效率,当培养基组成为蔗糖2%、黄豆粕粉5%、ZnSO40.01%、KCl 0.02%,初始pH值6.0,种子液按2%接种量接种至装瓶量为30 ml/250 ml的三角瓶中,200 r/min、37℃培养24 h后,可获得较多的BN-10菌株的胞外蛋白。
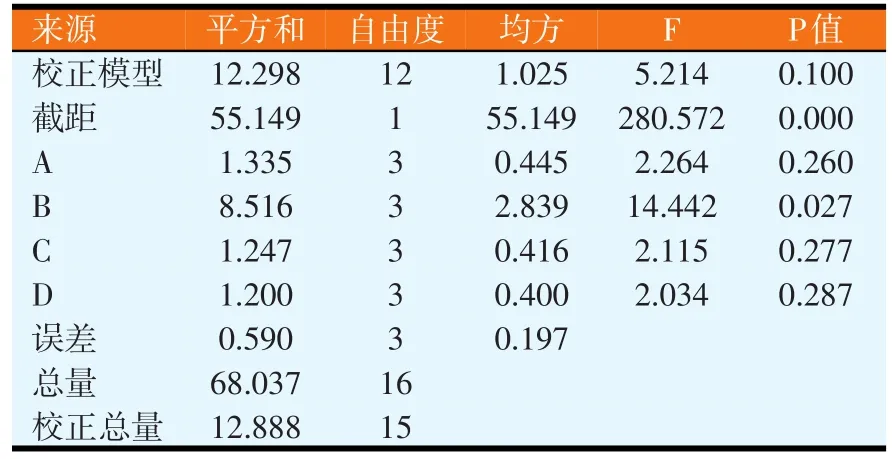
表7 发酵条件正交试验结果方差分析
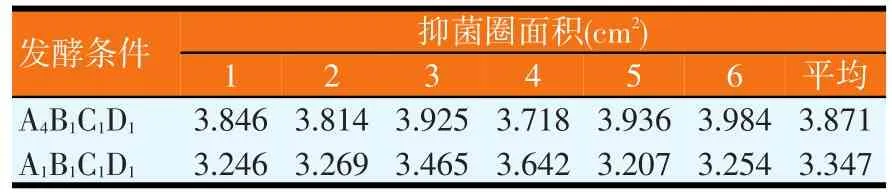
表8 发酵条件正交优化验证试验的结果
对于影响因素较多的试验而言,正交试验具有设计简便、节省试验单元、统计效率高等特点。借助SPSS软件的强大统计功能,既可以避免采用极差分析造成的对结果的错误臆断,又可以对正交试验的结果进行快速、直观、精确的分析,从而提高工作效率[11-12]。本文借助SPSS软件对培养基组成正交试验和发酵条件正交试验的结果进行统计分析,分析表明,显著影响BN-10菌株胞外蛋白产量的因素主要是氮源(黄豆粕粉)的浓度、无机盐(ZnSO4)浓度和装瓶量。
本文对BN-10菌株发酵产胞外抗菌蛋白的培养基组成和发酵条件进行了优化,优化后抗菌蛋白的产量大幅提高,达到了预期的目的,有利于抗菌蛋白的大量制备和分离纯化,为抗菌蛋白的性质研究奠定了基础。
