草鱼肌肉蛋白质在冷藏过程中的变化
2013-02-13刘永乐王发祥王满生李向红王建辉
李 强,刘永乐*,王发祥,王满生,俞 健,李向红,王建辉
(长沙理工大学食品与生物工程系,湖南 长沙 410014)
草鱼(Ctenopharyngodon idellus)又名鲩鱼,属鲤形目、鲤科、草鱼属,作为我国“四大家鱼”之首,不仅食用品质良好,而且鲜销价格适中,深受消费者欢迎[1]。草鱼肌肉水分含量高约80%、蛋白质含量约18%、脂肪含量约3%,是一种典型的高蛋白低脂肪食品,在贮藏、运输、加工处理及销售过程中极易发生腐败[2-4],提高其贮藏性和货架期一直是一个重要的课题。蛋白质是鱼类肌肉组织的主要组成成分之一,其降解、聚合和变性都会导致蛋白质功能的丧失,从而直接决定鱼类肌肉质量的好坏。因此,在草鱼肉的冷藏过程中,蛋白质的降解和生化变化往往是鱼肉鲜度下降、软化并最终发生腐败的重要原因之一。
目前,国内外对肌肉蛋白质研究较多的淡水鱼主要是鲈鱼和鲢鱼,且大都集中于蛋白质的提取工艺、冷冻变性等方面,对其在贮藏过程中的变化研究较少[5-8]。现阶段,研究者们多热衷于对草鱼保鲜技术方面的研究,往往忽视了有关草鱼贮藏过程中的一些深层次生理生化变化,特别是对其肌肉蛋白质在贮藏过程中的变化规律研究不多或了解甚少,因而尽管多种保鲜新技术[9-12]层出不穷,但仍无法有效阻止草鱼肉的鲜度下降和腐败。本实验以新鲜草鱼为原料,研究草鱼肌肉蛋白质在冷藏过程中的组成特性变化,从蛋白质变化角度阐述草鱼肉在贮藏过程中鲜度变化机理,旨在为针对性开展新鲜草鱼的保鲜及开发相应产品提供一定的理论依据。
1 材料与方法
1.1 材料、试剂与仪器
新鲜草鱼购自当地市场,每尾约1.5kg。
标准蛋白 加拿大Fermentas公司;牛血清蛋白上海泽龙生物工程有限公司;其他试剂均为分析纯。
UV-2100紫外分光光度计 上海舜宇恒平科学仪器有限公司;5430R高速冷冻离心机 德国Eppendorf公司;JYL-C012绞肉机 九阳股份有限公司;DYCZ-24DN电泳仪 北京六一仪器厂。
1.2 方法
1.2.1 鱼肉样品制备
鲜活草鱼于冰水中暂养1~2h,放血后去头、鳞和内脏,用预冷水清洗干净后剔除鱼骨,将背部肌肉分割成大小均匀的小块(约25g),置于4℃冰箱中,备用。分别取冷藏时间为0、2、4、6、8、10d的鱼块于绞肉机内绞碎,即为实验鱼肉样品。
1.2.2 不同溶解性蛋白质含量的测定
取一支50mL的离心管,精确称取约2g 样品(精确至0.01g),加入蒸馏水18mL,均质1min,25℃浸提1h,5000×g离心15min,将上清液转移至50mL容量瓶中,重复操作1次,合并上清液,并定容至50mL,所得样品即为水溶性蛋白溶液。如此将沉淀依次用盐(0.5mol/L NaCl溶液)、酸(pH 2.0盐酸溶液)、碱(pH12 NaOH溶液)浸提,所得上清液即分别为盐溶性蛋白、酸溶性蛋白、碱溶性蛋白。以微量凯氏定氮法测定其蛋白质含量。
1.2.3 不同结构蛋白质含量的测定
参考Hashimo等[13]的方法,并稍作修改。精确称取约2g样品(精确至0.01g)与20mL磷酸盐缓冲液A(含15.6 mmol/L Na2HPO4、3.5mmol/L NaH2PO4,pH7.5)混合,均质20s左右,浸提0.5h,5000×g离心15min,沉淀加入20mL磷酸缓冲液A(含0.5mol/L NaCl),重复上述操作,将2次离心后的上清液合并,加入三氯乙酸(TCA),使TCA的终浓度达50g/L后离心,所得沉淀即为肌浆蛋白样品。经缓冲液A提取2次后所得的沉淀中加入20mL磷酸盐缓冲液B,均质20s左右,浸提0.5h,5000×g离心15min,再在沉淀中加入20mL磷酸盐缓冲液B,重复上述操作,将2次离心后的上清液合并,即为肌原纤维蛋白样品。在沉淀中加入0.1mol/L NaOH溶液,均质,浸提2h,5000×g离心15min,所得沉淀即为肌基质蛋白样品。肌原纤维蛋白采用双缩脲法进行定量测定;肌浆蛋白和肌基质蛋白则采用微量凯氏定氮法测定。
1.2.4 肌肉中总蛋白质的SDS-PAGE分析
准确称取肌肉样品2g(精确至0.01g),加入20mL 20g/L SDS的溶液,均质,浸提0.5h,5000×g离心15min,收集上清液;准确吸取上清液200μL于1.5mL Eppendorf管中,加入等体积的上样缓冲液,于沸水中煮沸5min,然后10000×g离心5min,所得上清液即为待电泳样品。电泳用分离胶浓度为12%,采用恒流23mA进行电泳分离。用0.5g/L的考马斯亮蓝R250染色2~3h,然后脱色至背景透明,照相并分析电泳条带[14-17]。
2 结果与分析
2.1 草鱼肌肉冷藏过程中不同溶解性蛋白质含量的变化
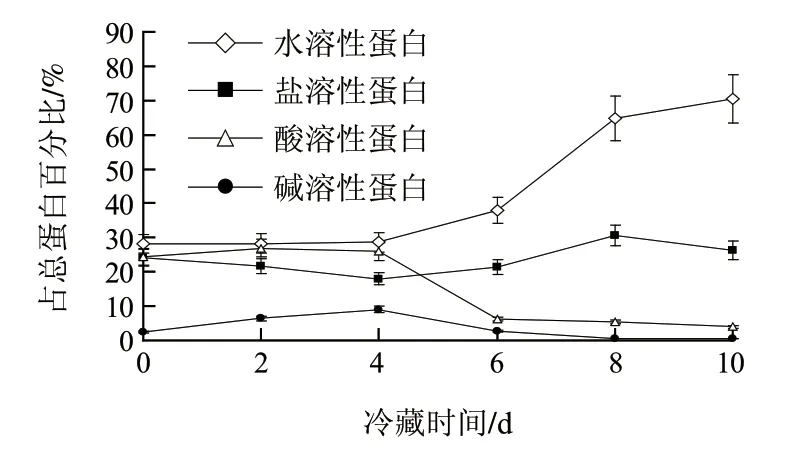
图1 草鱼肌肉冷藏过程中不同溶解性蛋白质含量的变化Fig.1 Change in contents of proteins with different solubility during chill storage of grass carp muscle
由图1可知,冷藏前4d,水溶性和酸溶性蛋白含量基本未变,盐溶性蛋白含量稍有减少,碱溶性蛋白含量略有增加,可能是因为冷藏前期微生物作用受到抑制,肌肉组织内源酶的作用对蛋白质的降解有限。随着冷藏时间的继续延长,水溶性蛋白含量显著增加,盐溶性蛋白含量也明显上升,但酸溶性和碱溶性蛋白含量在逐渐降低,这可能是因为冷藏4d后,一方面内源组织酶持续作用于肌肉蛋白质的效果得以积累,另一方面微生物繁殖和活动引入大量外源性蛋白酶,从而导致大分子蛋白质组分持续降解,从而改变了其溶解性。此外,冷藏第8天后,盐溶性蛋白含量明显减少,可能是因为此时酸、碱溶性蛋白组分已基本彻底降解,不再或很少转变为盐溶性部分,但盐溶性蛋白还在继续变化为水溶性蛋白。
2.2 草鱼肌肉冷藏过程中不同结构蛋白质的变化
鱼肌肉蛋白质可以分为肌原纤维蛋白(约占60%~75%)、肌浆蛋白(约占20%~35%)和肌基质蛋白(约占2%~5%)3类[18]。冷藏过程中草鱼肌肉中3类不同结构蛋白质的含量变化情况如图2所示。可见,冷藏前4d,3类蛋白质的含量变化较小;至第4天后,肌原纤维蛋白含量开始显著降低,但肌浆蛋白和肌基质蛋白仅稍有下降,说明冷藏过程中,发生降解的蛋白质组分主要是肌原纤维蛋白,如肌球蛋白等。实际上,肌原纤维蛋白的数量和完整性(分子大小分布)与鱼肉的质构、弹性、持水力及所有与其品质有关的特征直接相关,而冷藏过程中内、外源蛋白酶和许多代谢性蛋白质的作用加速了其降解,从而导致鱼肉软化和腐败[19]。
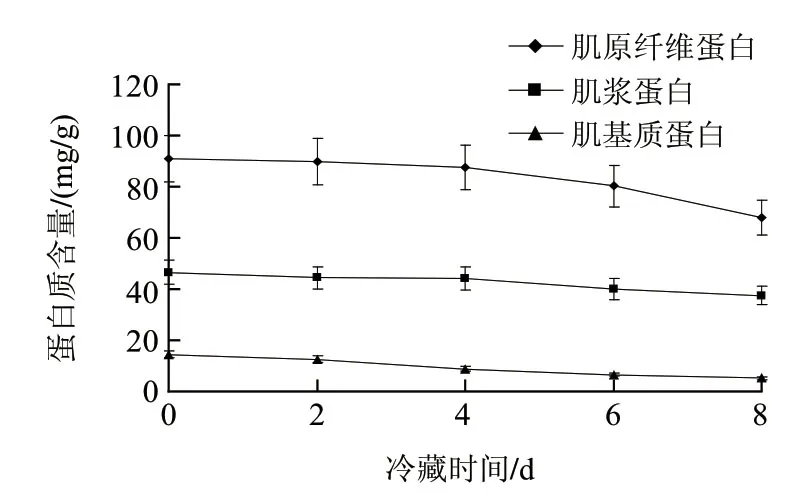
图2 草鱼肌肉冷藏过程中不同结构蛋白质含量变化Fig.2 Changes in contents of proteins with different structure during chill storage of grass carp muscle

图3 草鱼肌肉冷藏过程中各蛋白质含量变化幅度Fig.3 Reduction in contents of different molecular proteins during chill storage of grass carp muscle
由图3可知,草鱼肌肉冷藏过程中3类不同结构蛋白质在冷藏过程中一直在降解,但相对于肌浆蛋白和肌基质蛋白,肌原纤维蛋白随着冷藏时间的延长,其含量下降的程度越明显,这除了肌肉组织蛋白酶主要作用于肌原纤维蛋白外,也可能与其含量占整个肌肉蛋白质比例最大有关。同时也说明随着冷藏时间的延长,草鱼肌肉组织蛋白质降解程度增加,鱼肉鲜度下降或腐败现象越严重。
2.3 草鱼肌肉冷藏过程中肌肉总蛋白的SDS-PAGE分析
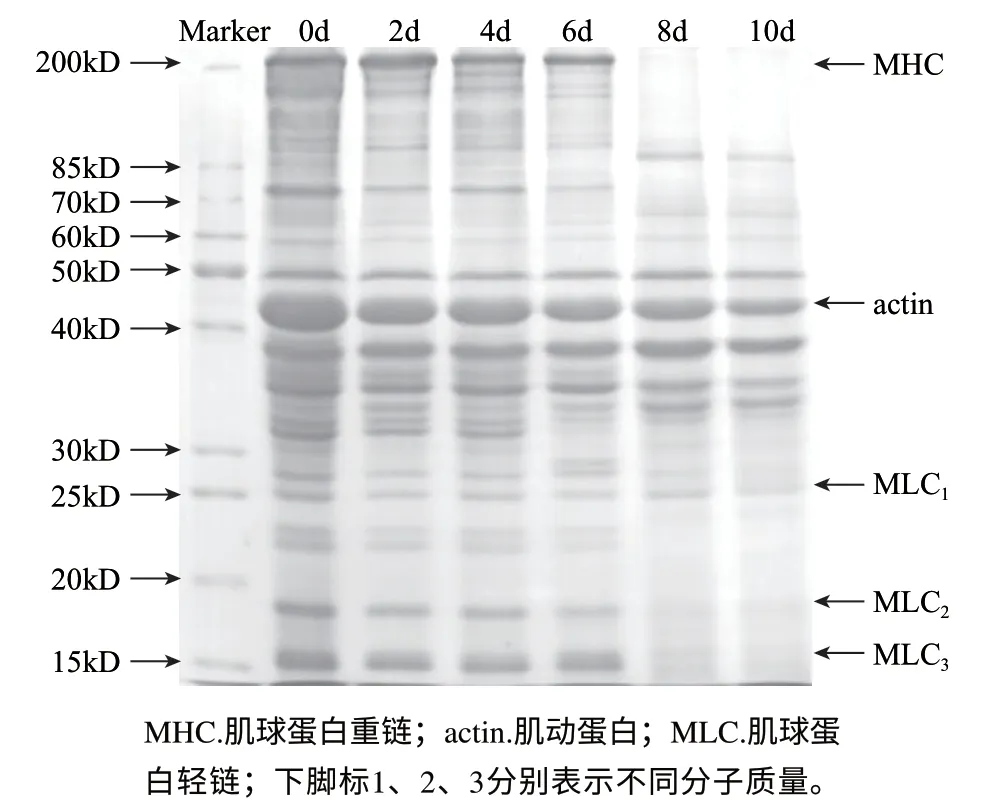
图4 草鱼肌肉冷藏过程中总蛋白SDS-PAGE图谱Fig.4 SDS-PAGE pattern of total muscular proteins in grass carp during chill storage of grass carp muscle
由图4可知,新鲜草鱼样品(0d)在SDS-PAGE图谱上可清晰分辨出20~30条蛋白带,其中主要条带为肌球蛋白重链(MHC,210kD)、肌动蛋白(actin,42kD)、原肌球蛋白(α-或β-tropomyosin,35kD)以及3种肌球蛋白轻链(MLC,15、17、24kD),另外还有一些分子质量20~40kD间的明显蛋白条带。冷藏 2d 后,所有蛋白条带的信号较 0d 的样品均有所下降,表明冷藏过程中各种蛋白质均会降解;冷藏第8天时,210kD的肌球蛋白重链等大分子蛋白条带几乎完全消失,分子质量为17、15kD的肌球蛋白轻链(MLC2和MLC3)及其他小分子蛋白条带也基本消失,表明这些蛋白在冷藏后期极易降解。有趣的是,冷藏第8天后的泳道新增了一条大于85kD的新蛋白条带,可能为大分子蛋白质降解后的中间体,也可能为某些小分子蛋白质的寡聚体。可见,42kD的肌动蛋白和24kD的肌球蛋白轻链(MLC1)相对比较稳定,10d时仍有明显的条带存在,但降解仍超过50%。此外,部分30~40kD的蛋白质如原肌球蛋白似乎比较稳定,冷藏10d其蛋白条带的信号变化不明显,这与张凌晶等[6]研究鲢鱼肌肉蛋白质的结果基本一致。
3 讨论与结论
淡水鱼在冷藏过程中鲜度下降、软化并最终发生腐败主要是因为酶催化导致的肌肉内部组分的生理生化变化,而蛋白质为肌肉组织的主要组成部分,其降解、聚合和变性都会导致蛋白质功能的丧失,从而直接决定鱼肌肉质量的好坏。本实验对冷藏过程中草鱼肌肉中总蛋白质、不同溶解性蛋白组分和不同结构蛋白组分的变化情况进行了分析,结果表明:冷藏过程中草鱼肌肉蛋白质在逐渐发生降解,至第6~8天后肌球蛋白重链等大分子质量蛋白质降解加速,几乎完全消失(图4)。冷藏过程中,肌原纤维蛋白在内源酶的作用下逐渐降解,第 4~6天开始含量显著降低(图2),导致鱼体组织软化,水溶性蛋白含量增加(图1),这又为微生物的生长提供了营养,从而不断增殖和活动并引入大量外源酶作用,造成其他蛋白质的进一步降解,最终导致鱼肉品质劣化和腐败。
蛋白质降解是鱼肉腐败的重要表现[20],分析淡水鱼肌肉蛋白质的变化是深入研究其腐败机理的重要手段,对针对性提出淡水鱼肉保鲜研究具有重要指导意义。目前,国内外对与腐败有关的具体蛋白质的降解细节和变化规律研究不多,了解甚少。本实验探讨了草鱼冷藏过程中肌肉蛋白质的组成特性变化,为研究淡水鱼低温贮藏过程中的肌肉蛋白质降解规律提供了部分生物学证据。然而,需要指出的是,本实验是以草鱼背部肌肉小块为研究对象,因此,其冷藏过程中蛋白质的降解情况可能与完整草鱼的降解情况存在差异;另外,不同鱼体或不同部位的个体差异在今后的研究中也值得考虑。
草鱼肌肉冷藏过程中不同溶解性蛋白质变化趋势有所不同,冷藏第4天为变化的重要时间点,水溶性蛋白含量开始显著增加,酸、碱溶性蛋白含量开始减少,盐溶性蛋白含量则先小幅增加至第8天开始下降;冷藏过程中3种不同结构蛋白质的含量也均有所下降,其中肌原纤维蛋白自第4天开始显著降低,而肌浆蛋白和肌基质蛋白则相对稳定,含量减低幅度较小。此外,冷藏过程中肌肉总蛋白质也在不断降解,至第6~8天降解加速,肌球蛋白重链等大分子质量蛋白质完全消失。
[1]王满生, 刘永乐, 王发祥, 等.响应曲面法优化草鱼肉冷杀菌工艺[J].食品科学, 2011, 32(20)∶ 48-51.
[2]李里特.食品原料学[M].北京∶ 中国农业出版社, 2001∶ 248-261.
[3]OKUMA H, WATANABE E.Flow system for fish freshness determination based on double multi-enzyme reactor electrodes[J].Biosensors & Bioelectronics, 2002, 17∶ 367-372.
[4]DALGAARD P.Modelling of microbial activity and prediction of shelf life for packed fresh fish[J].International Journal of Food Microbiology, 1995, 26∶ 305-317.
[5]黄海, 辛荣, 王秀敏, 等.鱼肉蛋白在低温贮藏时生化特性变化研究进展[J].食品研究与开发, 2009, 30(2)∶ 150-151.
[6]张凌晶, 杜雪莉, 梁银龙, 等.冷藏条件下鲢鱼肌肉蛋白的变化[J].福建农林大学学报∶ 自然科学版, 2006, 35(3)∶ 315.
[7]SAITO T, ISO N, MIZUNO H, et al.Effect of thermal on extraction of proteins from meats[J].Bull Japan Soc Scl Fish, 1983, 46(10)∶1569-1597.
[8]WASSON D H, BABBITT J K, FRENCH J S.Characterization of a heat stable protease from arrowtooth flounder, atheresthes stomias[J].Aquatic Food Product Technol, 1992, 4∶ 167-182.
[9]成媛媛, 刘永乐, 王建辉, 等.普鲁兰多糖在草鱼鱼肉保鲜中的应用[J].食品科学, 2012, 33(3)∶ 272-275.
[10]李云捷, 张迪.栅栏技术在半干鲢鱼片生产工艺中的应用[J].食品研究与开发, 2011, 32(9)∶ 201-204.
[11]PHILLIPS C A.Review∶ modified atmosphere packaging and its effects on the microbiological quality and safety of produce[J].Nternational Journal of Food Science & Technology, 1996, 31(6)∶463-479.
[12]龚婷.生鲜草鱼片冰温气调保鲜的研究[D].武汉∶ 华中农业大学,2008.
[13]HASHIMO K, WATABE S, KONO M, et al.Muscle protein composition of sardine and mackerel[J].Bulletin of the Japanese Society of Scientific Fisheries, 1979, 45(11)∶ 1435-1441.
[14]李荣华, 孙莉丽, 郭培国, 等.一种适用于教学的SDS-PAGE电泳实验指导[J].实验室研究与探索, 2009, 28(3)∶ 190-194.
[15]袁道强, 黄建华.生物化学实验和技术[M].北京∶ 中国轻工业出版社, 2006∶ 196-198.
[16]SATO R, SAWABE T, SAEKI H.Characterization of fish myofibrillar protein by conjugation with alginate oligosaccharide prepared using genetic recombinant alginatelyase[J].Journal of Food Science, 2005,70(1)∶ 58-60.
[17]高重天, 孙群.如何正确估计蛋白质SDS聚丙烯酰胺凝胶电泳的样品加样量[J].生物学通报, 2009, 44(3)∶ 54.
[18]熊善柏.水产品保鲜储运与检验[M].北京∶ 化学工业出版社, 2007∶12.
[19]JIA X, EKMAN M, GROVE H, et al.Proteome changes in bovine longissimus thoracis muscle during the early postmortem storage period[J].J Proteome Res, 2007, 6(7)∶ 2720-2731.
[20]LONE G, HANS H H.Microbiological spoilage of fish and fish products[J].Int J Food Microbio, 1996, 33(1)∶ 121-137.
