精白保胚米发芽过程中淀粉酶及相关营养成分的变化
2013-02-13李向红刘永乐王发祥王建辉
李向红,刘永乐*,俞 健,王发祥,王建辉
(长沙理工大学化学与生物工程学院,湖南 长沙 410004)
精白保胚米是保留了胚芽部分的精白米,胚芽富含多种营养元素。由于保留了胚芽,每100kg稻谷可以多出10kg左右的保胚米,节约了稻谷资源,增加了大米产量。生产保胚米时由于不需要耗能较大的碾米设备,使得能耗大为降低,节约了能源成本。糙米的营养成分虽然很充足,但由于外面包裹着一层坚硬的种皮,不但不美观,而且不易蒸煮,同时不易消化,而去除部分种皮的精白保胚米的食用品质就比糙米好得多[1]。干燥的精白保胚米处于休眠状态,此时精白保胚米各部分组织比较坚实紧密,细胞内呈干燥的凝胶状态。当精白保胚米与水分直接接触或在湿度较高的空气中,则很快吸水而膨胀,直到细胞内部的水分达到一定的饱和程度、细胞壁呈紧张状态、精白保胚米外部的保护组织趋向软化才逐渐停止,精白保胚米在吸收足够量的水分后能正常发芽[2]。
糙米发育过程中,所含的大量酶被激活和释放,并从结合态转化为游离态,包括淀粉酶、蛋白酶、脂肪酶等,其中最主要的是淀粉酶的作用。陈志刚[3]发现糙米在发芽前期和中期随着萌发时间的延长α-淀粉酶活力迅速升高,发芽后期酶活力下降。Ren Yanfang[4]等研究了3种纤维素酶(β-甘露聚糖酶、β-甘露糖苷酶、α-半乳糖苷酶)在糙米发芽过程中的关系,发现β-甘露糖苷酶和α-半乳糖苷酶存在于未萌发的种子中并在发芽过程中活力逐渐增加,而β-甘露聚糖酶只有在发芽的种子中存在。发芽过程中,糙米内部丰富的营养物质逐步地被分解和利用,一方面在呼吸过程中转化为能量,用于生长和合成,另一方面通过代谢转化成新细胞组成的成分。淀粉在淀粉酶的作用下逐渐被分解,其中α-淀粉酶是一种内切型淀粉酶,作用于淀粉时,随机地从淀粉内部切开α-1,4-糖苷键,使淀粉分子迅速降解为麦芽糖、葡萄糖及一系列α-极限糊精等小分子。β-淀粉酶是一种外切型淀粉酶,作用于淀粉时,从淀粉的非还原端依次切开α-1,4-糖苷键,生成麦芽糖。脱支酶能催化水解支链淀粉、糖原及相关的大分子化合物中的α-1,6-糖苷键,生成直链淀粉和糊精。淀粉在几种淀粉酶的协同作用下,分解为小分子的葡萄糖,为萌发提供能量。本实验研究精白保胚米发芽过程中各种淀粉酶活力的改变以及伴随的营养成分的变化,为精白保胚发芽米产品的开发以及综合利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
糙米和精白保胚米的原料均为东北粳稻(空育131),购自东北北大荒种业;其他所有化学试剂均为分析纯。
1.2 仪器与设备
精白保胚米制米机组 湖南省湘粮机械制造有限公司;MJ-Ⅱ霉菌培养箱 上海一恒科技有限公司;UV2600 紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;FW100型高速万能粉碎机 天津泰撕特仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;SK-1 型快速混匀器 金坛市医疗仪器厂。
1.3 方法
1.3.1 精白保胚米发芽工艺
粳稻砻谷除杂后即得糙米,经发芽后便为发芽糙米。精白保胚米发芽工艺流程如下:稻谷→砻谷→除杂→筛选→分级→优质精白保胚米→经0.5g/100mL的次氯酸钠溶液浸泡消毒5min→经0.02mg/mL的赤霉素溶液浸泡16h→25℃培养24h→45℃干燥8h→精白保胚发芽米。
1.3.2α-淀粉酶、β-淀粉酶活力测定方法
1.3.2.1 制备酶液
DNS试剂的配制方法为:称取3,5-二硝基水杨酸(10±0.1)g,置于约600mL水中,逐渐加入NaOH 10g,在50℃水浴中磁力搅拌溶解,再依次加入酒石酸甲钠200g、苯酚(重蒸)2g和无水亚硫酸钠5g,待全部溶解并澄清后,冷却至室温,用水定容至1000mL,过滤。贮存于棕色试剂瓶中,于暗处放置7d后使用。
1.3.2.2α-淀粉酶活力测定
测定方法参考文献[5]。取淀粉酶原液lmL,置于70℃水浴中15min,冷却后放入40℃水浴中10min,加入1%淀粉lmL,准确保温5min,加入DNS试剂2mL终止反应,再加入16mL蒸馏水摇匀,在540nm波长处比色。单位酶活力定义为1min能使淀粉碘液光密度下降10%为1个酶活力单位,按式(1)进行计算。

式中:OD1为参比光密度;OD2为样品光密度;C为水分含量/%;n为稀释倍数。
1.3.2.3β-淀粉酶活力的测定
取淀粉酶稀释液lmL,放入40℃水浴中预温10min,加入1%淀粉lmL,准确保温5min,加入DNS试剂2mL终止反应,再加入16mL蒸馏水摇匀,在540nm波长处比色。单位酶活力定义为1min能使淀粉碘液光密度下降10%为1个酶活力单位,按式(2)、(3)进行计算。

1.3.3 还原糖含量变化的测定
采用3,5-二硝基水杨酸(DNS)比色法测还原糖含量[7]。在540nm波长处比色,以麦芽糖标准质量浓度为横坐标,以其对应的光密度为纵坐标绘制标准曲线,得到线性方程为y= 0.1249x―0.0397(R2=0.9969)。
1.3.4 总糖含量变化的测定
采用硫酸-蒽酮法测定总糖含量[8-9]。在540nm波长处比色,以葡萄糖标准质量浓度为横坐标,以其对应的光密度为纵坐标绘制标准曲线,得到线性方程为y=0.0318x―0.0111(R2=0.9987)。
1.3.5 淀粉含量变化的测定
取2g已脱脂样品,用150mL 85%乙醇分数次洗涤去除可溶性糖,3000r/min离心10min,将沉淀转移至250mL锥形瓶中后加入20mL稀HCl,装入回流装置在沸水浴中回流2.5h,冷却后用20% NaOH溶液中和,过滤取上清液用硫酸-蒽酮法测定其总糖量,最后折算成淀粉含量。
1.3.6 热水溶性直链淀粉的含量变化的测定
测定方法参考GB/T 15683—2008《大米直链淀粉含量测定法》[10]。原料处理:准确称取0.1000g过100目筛的米粉于100mL烧杯中,加入50mL 30℃的蒸馏水,然后沸水浴5min再转入30℃水浴中保温30min过滤,取滤液3mL,再加入1mL碘溶液和1mL 15%的HCl溶液,定容至50mL,室温条件下放置30min后在620nm波长处比色,1mL碘溶液与1mL 15%的HCl溶液定容到50mL作为空白对照。以直链淀粉质量浓度为横坐标,以其对应的光密度为纵坐标绘制标准曲线,得到线性方程为y= 3.0143x+0.149(R2=0.9936)。
2 结果与分析
2.1 α-淀粉酶及β-淀粉酶活力变化

图1 α-淀粉酶活力随发芽时间变化的比较曲线Fig.1 Activities of α-amylase under different germination conditions
由图1可知,在精白保胚米和糙米发芽过程中α-淀粉酶的活力先由低变高,再由高变低,精白保胚米在发芽16h时α-淀粉酶活力最高,而糙米在发芽时α-淀粉酶活力达到最高点时间较长。因为α-淀粉酶是谷类种子发芽过程中形成的主要淀粉酶,在干稻谷种子中一般不含或含量甚微,发芽后由于赤霉素的诱导作用,在糊粉层内产生大量的α-淀粉酶,酶活力逐渐升高。
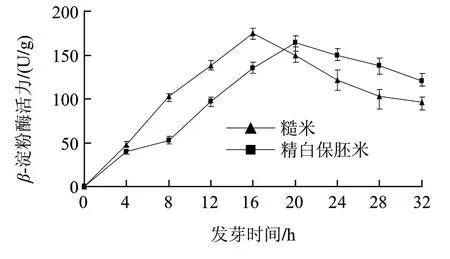
图2 β-淀粉酶活力随发芽时间变化的比较曲线Fig.2 Activities of β-amylase under different germination conditions
由图2可知,发芽开始时β-淀粉酶活力较低,这是糊粉层中少量已活化的β-淀粉酶在发挥作用。发芽过程中,位于糊粉层中的β-淀粉酶向胚乳分泌,位于胚乳中的未活化部分在蛋白酶的作用下双硫键被切断,β-淀粉酶得以活化从而使β-淀粉酶的活性先由低变高,再由高变低,到达最高点后受到底物质量浓度的影响而逐渐降低[11]。
2.2 还原糖、总糖及淀粉含量的变化
由图3、4可知,还原糖、总糖的含量随着时间的增加而升高,在24h后逐渐降低,精白保胚米在发芽过程中还原糖的含量高于糙米,这是因为在发芽过程中由于淀粉酶(α-淀粉酶和β-淀粉酶)被激活,在淀粉酶的作用下淀粉被酶解为还原糖和非还原性糖,总糖含量也随之增加,在24h后由于精白保胚米和糙米芽体的迅速生长,为了提供芽体生长所需的能量和基础原料,需要利用糖类从而使还原糖、总糖的含量稍有降低。还原糖含量的高低直接影响稻米食味的好坏[3],与发芽糙米比较,精白保胚发芽米蒸煮时易糊化,甜味稍强,食味品质稍高。

图3 还原糖含量随时间变化曲线Fig.3 Contents of reducing sugar under different germination conditions

图4 总糖含量随时间变化曲线Fig.4 Contents of total sugar under different germination conditions

图5 淀粉含量随时间变化曲线Fig.5 Contents of starch under different germination conditions
由图5可知,淀粉含量随发芽时间的延长而逐渐降低。精白保胚米和糙米在发芽的过程中淀粉在淀粉酶的作用下酶解为糖类及糊精,而糖类和糊精则为芽体的生长提供必须的营养物质,从而使淀粉的含量逐渐降低,前期由于精白保胚米的发芽能力高于糙米,所以精白保胚米在发芽过程中淀粉消耗的比糙米多,淀粉含量较糙米低,24h后由于糙米芽体迅速增长,使得淀粉含量迅速下降。
2.3 精白保胚米发芽过程中热水溶性直链淀粉含量的变化

图6 热水溶性直链淀粉的含量随时间的变化Fig.6 Hot-water solubility of amylose under different germination conditions
由图6可知,发芽时间对精白保胚米和糙米中热水溶性直链淀粉的含量影响较为明显。随着发芽时间的延长,热水溶性直链淀粉的含量不断增加,发芽24h后热水溶性直链淀粉的含量增加缓慢。这是因为直链淀粉具有热水溶性,在发芽过程中由于脱支酶被激活将分子质量较大的支链淀粉进行脱支,从支链淀粉上脱下来的分支成为直链淀粉,从而使热水溶性直链淀粉的含量增加。
3 结 论
精白保胚米和糙米发芽过程中α-淀粉酶、β-淀粉酶、总淀粉酶的活性先由低变高,再由高变低,精白保胚米在发芽16h时淀粉酶的活性最高,而糙米在发芽时淀粉酶活性达到最高点时间较长;葡聚糖内切酶活力随发芽时间的增加活性逐渐升高,糙米在发芽过程中葡聚糖内切酶活力高于精白保胚米。还原糖、总糖的含量随着时间的增加而升高,在20~24h后逐渐降低,精白保胚米在发芽过程中还原糖的含量高于糙米;淀粉含量随发芽时间的延长而逐渐降低,因为淀粉在淀粉酶的作用下酶解为糖类及糊精,从而使淀粉的含量逐渐降低,前期精白保胚米的发芽能力高于糙米,所以精白保胚米在发芽过程中淀粉消耗的比糙米多,淀粉含量较糙米低,24h后由于糙米芽体迅速增长,使得淀粉含量迅速下降。发芽时间对精白保胚米和糙米中热水溶性直链淀粉的含量影响较为明显,随着发芽时间的延长,热水溶性直链淀粉的含量也不断增加。本实验研究了精白保胚米发芽过程中各种淀粉酶活力的改变以及伴随的一些相关营养成分的变化,为精白保胚发芽米产品的开发以及综合利用提供了理论支持。
[1]刘永乐.稻米及其制品生产技术问答[M].北京∶ 科学普及出版社,2010∶ 78-80.
[2]毕辛华, 戴心维.种子学[M].北京∶ 中国农业出版社, 1993∶ 78-80.
[3]陈志刚, 顾振新.温度处理对发芽糙米中淀粉酶活力的影响[J].食品与发酵工业, 2003, 29(3)∶ 46-49.
[4]REN Yanfang, HE Junyu, WANG Xiaofeng.Changes in activities of three enzymes degrading galactomannan during and following rice seed germination[J].Rice Science, 2007, 14(4)∶ 295-301.
[5]常彦莉, 陈垣, 郭凤霞.甘肃贝母种子吸水及发芽特性研究[J].草业学报, 2010, 19(4)∶ 41-46.
[6]郑宝东.食品酶学[M].南京∶ 东南大学出版社, 2006∶ 220-223.
[7]王肇慈.粮油食品品质分析[M].北京∶ 中国轻工业出版社, 1994∶112-136.
[8]袁道强, 黄建华.生物化学实验和技术[M].北京∶ 中国轻工业出版社, 2006∶ 126-132.
[9]何照范, 张迪清.保健食品化学及其检测技术[M].北京∶ 中国轻工业出版社, 1998∶ 164-169.
[10]中华人民共和国卫生部.GB/T 15683—2008 大米直链淀粉含量测定法[S].2008.
[11]管敦仪.啤酒工业手册[M].北京∶ 中国轻工业出版社, 1984∶ 62-64.
