不同分子质量米糠多肽的抗氧化活性
2013-02-13张敏,周梅
张 敏,周 梅
(1.北京工商大学食品学院,北京 100037;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
自由基是单独存在的具有不成对价电子的分子、原子、离子和基团。自由基包括氧自由基和非氧自由基,氧自由基占95%,如超氧阴离子自由基()、羟自由基(·OH)、过氧羟基自由基(HOO·)以及来自于脂质过氧化物的有机自由基(R·)和有机过氧自由基(ROO·)[1]。根据现有的研究报道,许多疾病如动脉粥样硬化、中风、肝硬化、癌症以及关节炎、白内障、人体衰老等过程都与自由基的作用有关[2]。因此保持机体自由基的产生与消除的平衡,防止自由基对细胞和组织的损伤,是预防各种疾病的有效措施之一。抗氧化物质是防病治病的关键物质,但一些人工的合成抗氧化剂,如叔丁基羟基茴香醚(BHA)、2,6-二叔丁基-4-甲基苯酚(BHT)等,能够抑制人体的呼吸酶活性,使用过量甚至可致畸、致癌,有些国家已禁止使用[3],因此研究天然、低毒、高效抗氧化剂的工作一直是食品和生物领域的重要课题。
我国是稻米生产大国,但是米糠的利用率很低,米糠中含有20%左右的蛋白质,米糠蛋白质中必需氨基酸的含量和相互比值也符合人体的需要,尤其适合于生长速度快以及胃消化功能尚不完全的婴儿。且米糠蛋白质还具有低过敏性,可作为低敏性蛋白质原料用于婴幼儿食品中[4]。
基于米糠蛋白的这一系列优点,近些年来,对米糠多肽的活性研究也成为了热点。2007年,张强等[5]用胰蛋白酶制备的米糠抗氧化肽有很强的还原力,对·和·OH有很强的清除作用,且呈一定的量效关系。2008年,丁青芝等[6]用8种酶水解米糠蛋白制备降血压肽,最终获得ACE抑制率88.8%和水解度4.76%的降血压肽。2009年,国外学者Chanput 等[7]用胃蛋白酶水解米糠获得由6~30个氨基酸残基组成的分子质量在670~3611D的抗氧化活性蛋白肽,最高活性组分主要为Tyr-Leu-Ala-Gly-Met-Asn;米糠抗氧化肽不仅对自由基具有较强的清除作用,而且无任何毒副作用。2010年,林敏刚等[8]用木瓜蛋白酶制备的米糠生物活性肽对·OH具有良好的清除能力。2010年,樊金娟等[9]对米糠抗氧化肽体外抗氧化作用进行研究,结果显示,0.32mg/mL米糠抗氧化肽能够抑制血红蛋白氧化反应和红细胞溶血,抑制率为50%左右。
现在测定抗氧化能力的方法很多,但还没有一种方法可以完全地评价抗氧化物质的抗氧化能力,主要原因是由于生物体中有多个抗氧化系统,这些存在于体内的抗氧化系统的工作原理、相互之间的关系还没有搞清楚,所以很难对抗氧化物质进行综合评价;存在的多种自由基和抗氧化剂资源,它们各自都有不同的化学和物理特征。某一抗氧化剂可能在单一系统中同时有多重机制,或者在不同系统中表现出不同的机制。此外,对于不同的自由基,抗氧化剂的清除机制也不相同。现在采用的抗氧化评定方法大多为体外抗氧化测定,无法真实模拟生理环境,且各方法都仅测定了抗氧化能力中的某一方面,故无法模拟生理条件下的多条抗氧化途径;测定的样品大多为混合物质,其成分非常复杂,各抗氧化物质的抗氧化作用无法用单一的机制解释[10-11]。因此,目前测定抗氧化物质的抗氧化能力常选用不同类型的测定指标。根据抗氧化物质的作用机理可将这些指标分为4类:1)活性氧自由基清除能力,包括·OH和·;2)基于氢原子转移(HAT)的方法,包括氧自由基吸收能力(ORAC)、硫代巴比妥酸反应物法(TBARS)、硫酸氰铁法(FTC);3)基于电子转移(SET)的方法,包括DPPH自由基清除能力、ABTS+·清除能力、FRAP(Fe3+还原能力)、总酚估计法;4)金属离子螯合能力法。
本研究以米糠蛋白为原料,选用碱性蛋白酶酶解米糠蛋白制备米糠多肽,并对米糠多肽进行超滤,截留出分子质量大于10kD、3~10kD、小于3kD的米糠多肽产品,对其分别进行抗氧化活性的研究。在实验中,根据抗氧化物的抗氧化机理不同选择6种测定抗氧化能力的方法[12-13],在不同的机制上表征米糠多肽的抗氧化活性体系。
1 材料与方法
1.1 材料、试剂与仪器
米糠蛋白(蛋白含量71.51%、水分含量4.40%、灰分含量2.61%、碳水化合物15.64%、淀粉含量3.4%,脂肪含量<1%) 黑龙江省北大荒米业有限公司。
Alcalase蛋白酶(235000U/g) 丹麦诺维信公司;DA2012-C大孔吸附树脂 江苏苏青水处理工程集团有限公司;ABTS+·清除能力检测试剂盒 南京建成生物工程研究所。
722型可见分光光度计 上海菁华科技仪器有限公司;K5600超微量分光光度计 北京凯奥科技发展有限公司;AKTAexplorer层析仪 德国GE Healthcare公司;超滤离心管 美国Milipore公司。
1.2 方法
1.2.1 米糠多肽的制备
米糠蛋白→配制底物质量浓度为5g/100mL的原料液→50℃恒温水浴→酶解3h→灭酶(沸水浴5min)→12000r/min离心10min→取上清进行脱盐处理(粗提液)→超滤(截留分子质量>10kD、3~10kD、<3kD)→抗氧化活性分析测定
1.2.2 大孔树脂纯化米糠多肽
将一定量的树脂用无水乙醇浸泡24h,然后用无水乙醇洗至220nm无吸收峰时,再用去离子水洗净后备用。称取100g湿树脂于250mL锥形瓶中,加100mL米糠多肽,25℃恒温摇床150r/min,使其充分吸附后弃去未吸附的盐溶液,用75%乙醇依次洗脱,分别收集洗脱液并浓缩得到初步的纯化,脱除大部分盐和糖的米糠多肽产品。
将不同分子质量的米糠多肽配制成质量浓度为0.3、0.6、1.2、2.4、4.8、9.6mg/mL进行实验。
1.2.3 水解液中含氮量(以蛋白质含量计)
采用福林-酚法[14]测定多肽含量,以牛血清蛋白为标样,回归方程为:Y=904.93x+0.9162(R2=0.9991),式中,Y为蛋白质量浓度/(μg/mL);x为吸光度。
1.2.4 ·OH清除能力的测定[15]
利用Fenton反应产生的·OH与甲基紫作用前后测定244nm波长吸光度的变化来计算清除率。5mL甲基紫溶液吸光度为A;混合液吸光度为A0;样品反应后吸光度为AS。清除率按式(1)进行计算。
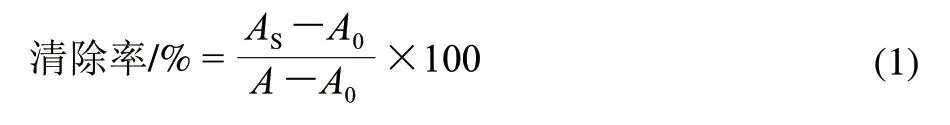
采用邻苯三酚自氧化法略有改动[13],加入各种试样,在420nm波长处测吸光度。清除率按式(2)进行计算。

式中:A空白为pH 8.2Tris-HCl 6mL+1mL 7mmol/L PR+8mol/L HCl两滴,用蒸馏水定容至10mL;A样品为pH8.2 Tris-HCl 6mL+2mL样品+1mL7mmol/L PR+8mol/L HCl两滴,用蒸馏水定容至10mL;A本底为pH8.2 Tris-HCl 6mL+2mL样品+8mol/L HCl两滴,用蒸馏水定容至10mL。
1.2.6 DPPH自由基清除能力的测定
按照参考文献[16],黑暗室温条件下放置30min后在517nm波长处测吸光度,清除率按式(3)计算。

式中:A0为1.5mL DPPH+1.5mL乙醇;A1为1.5mL DPPH+1.5mL样品水解液;A2为1.5mL乙醇+1.5mL样品水解液。
1.2.7 Fe3+还原能力的测定[17]
在试管中分别加入不同质量浓度样品、磷酸盐缓冲溶液和铁氰化钾,水浴后加入三氯乙酸、蒸馏水和三氯化铁溶液。样品在700nm波长处测定吸光度。反应物的吸光度增加表明还原力增强。
1.2.8 ABTS+·清除能力的测定
采用试剂盒在414nm波长处测定ABTS+·的吸光度即可计算出样品的总抗氧化能力。以Trolox为标样,标准曲线方程为:Y= 1.6166-1.6824x(R2=0.9974),式中,Y为标准品Trolox的浓度/(mmol/L);x为吸光度。
1.2.9 Fe3+螯合能力的测定
采用磺基水杨酸显色法[18]。螯合能力按式(4)计算。

式中:X为每克样品螯合Fe3+能力/(mg/g);V为样品消耗硫酸铁铵溶液的体积/mL;c为硫酸铁铵溶液的浓度/(mol/L);m为样品质量/g。
2 结果与分析
2.1 米糠蛋白和米糠多肽对·OH的清除作用
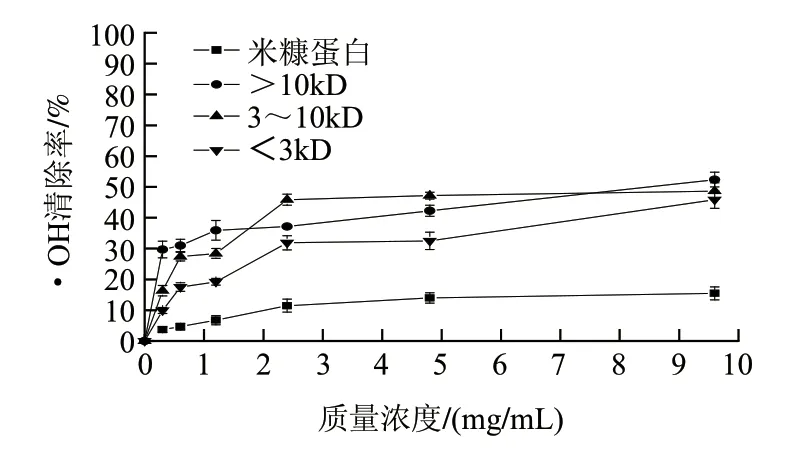
图1 米糠蛋白和米糠多肽对·OH清除能力Fig.1 Hydroxyl radical scavenging activity of rice bran protein and rice bran polypeptides
由图1可知,不同质量浓度不同分子质量的米糠多肽对Fenton试剂系产生的·OH均具有清除作用,随着质量浓度的提高不同分子质量的米糠多肽对·OH的清除率也随之提高;质量浓度在0.3~1.2mg/mL时Mw>10kD的米糠多肽的清除率最高为35.94%,质量浓度在2.4~4.8mg/mL时Mw为3~10kD的米糠多肽的清除率最高为47.18%,质量浓度在9.6mg/mL时Mw>10kD的米糠多肽的清除率最高为53.38%,Mw为3~10kD和Mw<3kD的米糠多肽的清除率也达到最高分别为48.67%和45.85%;米糠蛋白对·OH的最大清除率为15.47%,明显低于米糠多肽的·OH清除率;在不同分子质量的米糠多肽中,随着分子质量的增加,米糠多肽的清除率增加,只有在2.4~4.8mg/mL时Mw为3~10kD的米糠多肽表现出较强的清除率,质量浓度<2.4mg/mL以后此分子质量的的米糠多肽,清除率的增加不显著。由图1、2对比可知,质量浓度9.6mg/mL的Mw>10kD的米糠多肽相当于质量浓度0.06mg/mL的VC和BHT对·OH的清除能力。

图2 VC和BHT对·OH的清除能力Fig.2 Hydroxyl radical scavenging activity of vitamin C and BHT
由Fenton反应所生成的·OH能使氨基酸发生氧化修饰,即构成蛋白质的多肽和氨基酸能捕捉活性氧,随之发生自由基连锁反应的终止[19],这种性质意味着Mw>10kD的米糠多肽属于清除自由基捕捉型的氧化剂,在活性氧、自由基的防御系统中起到阻断连锁反应的作用,属于活性氧自由基清除能力的作用机制。
2.2 米糠蛋白和米糠多肽对·的清除作用
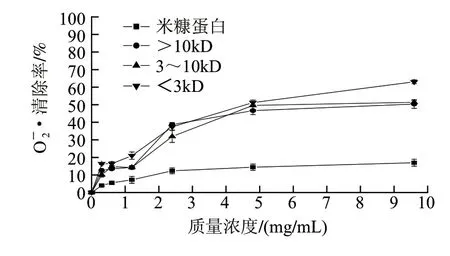
图3 米糠蛋白和米糠多肽对·的清除能力Fig.3 Superoxide anion radical scavenging activity of rice bran protein and rice bran polypeptides

图4 VC和BHT对·的清除能力Fig.4 Superoxide anion radical scavenging activity of vitamin C and BHT
2.3 米糠蛋白和米糠多肽对DPPH自由基的清除作用
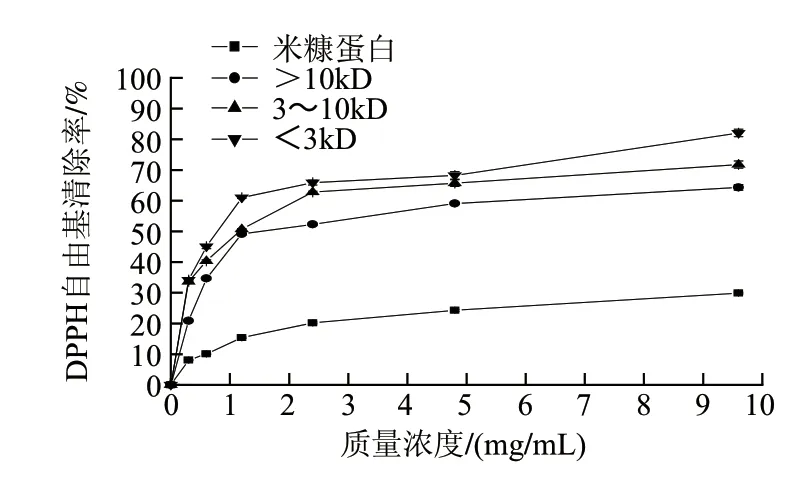
图5 米糠蛋白和米糠多肽对DPPH自由基的清除能力Fig.5 DPPH radical scavenging activity of rice bran protein and rice bran polypeptides
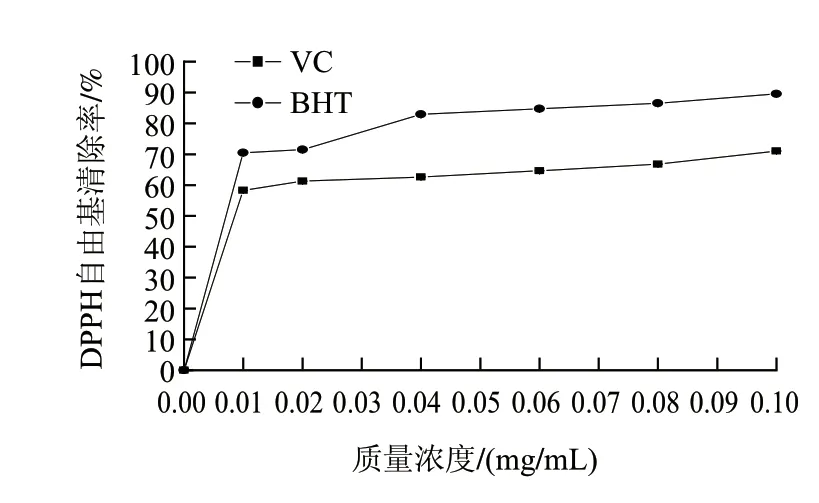
图6 VC和BHT对DPPH自由基的清除能力Fig.6 DPPH radical scavenging activity of vitamin C and BHT
由图5可知,米糠多肽较低质量浓度下就对DPPH自由基具有清除能力,质量浓度的增加对清除效果的变化不显著;随着不同分子质量的米糠多肽质量浓度的增加,清除率逐渐增高;随着分子质量的增加清除率呈下降的趋势,Mw<3kD的米糠多肽在高质量浓度下DPPH自由基清除率最大为82.07%。不同质量浓度不同分子质量的米糠多肽对DPPH自由基清除率影响很大,可能与特定时间水解产生的活性片段的多少、长度和序列等有关[20]。米糠蛋白的DPPH自由基清除率随质量浓度变化不大,最大值只有29.91%,进一步证实DPPH自由基清除率可能与特定时间水解产生的活性片段的多少、长度和序列等有关的这一说法。由图5、6对比可知,质量浓度9.6mg/mL的Mw<3kD的米糠多肽相当于质量浓度0.1mg/mL以上的VC和0.04mg/mL BHT对DPPH自由基的清除能力。
Mw<3kD的米糠多肽对DPPH自由基的清除能力最强,可能由于空间位阻决定反应的倾向,小分子化合物由于更易接近自由基而拥有相对较高的抗氧化能力[21]。
2.4 Fe3+还原能力

图7 VC对Fe3+还原能力Fig.7 Fe3+ reducing capacity of vitamin C

图8 米糠蛋白和米糠多肽对Fe3+还原能力Fig.8 Fe3+ reducing capacity of rice bran protein and rice bran polypeptides
图7 ~8给出了VC、米糠蛋白和不同分子质量的米糠多肽的Fe3+还原能力,由于BHT在Fe3+还原体系反应中会出现混浊,所以不做阳性对比。可以看出,随着反应质量浓度的增加,对Fe3+的还原能力也在增加,呈现一定的正相关关系。随着米糠多肽分子质量的增加,对Fe3+还原能力亦呈下降的趋势。在最高质量浓度条件下,Mw<3kD的米糠多肽对Fe3+还原能力最高(A700nm=0.544),其次是Mw为3~10kD的米糠多肽对Fe3+还原能力(A700nm=0.417),再次是Mw>10kD的米糠多肽对Fe3+还原能力(A700nm=0.365)。米糠蛋白在不同质量浓度下对Fe3+还原能力的影响变化不大,在9.6mg/mL质量浓度时具有最大还原力(A700nm=0.189)。图7和图8对比可知,质量浓度9.6mg/mL的Mw<3kD的米糠多肽相当于质量浓度0.1mg/mL以上的VC对Fe3+还原能力。
抗氧化剂的还原力与其抗氧化性之间存在联系。抗氧化剂是通过自身的还原作用给出电子而清除自由基的,还原力越强,抗氧化性越强[22]。Mw<3kD的米糠多肽具有较强的电子转移能力。
2.5 ABTS+·清除能力
ABTS+·是抗氧化评价实验常用自由基[23-24]。在研究抗氧化药剂作用时用以评估药剂捕捉自由基能力,而作为药剂抗氧化能力的评价基准。不同分子质量的米糠多肽对ABTS+·的清除率能力见图9。不同分子质量的米糠多肽质量浓度在0.3~0.6mg/mL时,对ABTS+·的清除能力较弱;随着不同分子质量的米糠多肽质量浓度增加,清除率上升幅度较大;当不同分子质量的米糠多肽质量浓度为9.6mg/mL时,对ABTS+·清除率达到最大;米糠多肽的分子质量越大,清除能力越弱。在最高质量浓度条件下,Mw<3kD的米糠多肽对ABTS+·清除率最大为0.838mmol/L Trolox。米糠蛋白对ABTS+·清除率最大只达到0.367mmol/L Trolox,经过碱性蛋白酶酶解米糠蛋白制备的米糠多肽对ABTS+·清除率有很大提高。

图9 米糠蛋白和米糠多肽对ABTS+·清除能力Fig.9 ABTS+· scavenging activity of rice bran protein and rice bran polypeptides
2.6 Fe3+螯合能力
过渡金属如铁、铜等可以诱导多不饱和脂肪酸发生脂质过氧化反应而损害生物膜,产生毒性过氧化产物。Fe3+螯合能力与抗氧化性能有着密切的关系。由图10可知,米糠蛋白和不同分子质量的米糠多肽对Fe3+具有明显的螯合能力;不同分子质量的米糠多肽质量浓度在0.3~4.8mg/mL时对Fe3+螯合能力变化并不明显,质量浓度在9.6mg/mL时对Fe3+螯合能力较强;米糠蛋白对Fe3+螯合能力同Mw<3kD的米糠多肽对Fe3+螯合能力相当,对Fe3+螯合能力最大的是Mw为3~10kD的米糠多肽。质量浓度9.6mg/mL时Mw为3~10kD的米糠多肽对Fe3+螯合能力最大达到0.878mg/g,相当于0.75mg/mL左右的VC和BHT对Fe3+螯合能力的量。
多羧基有机化合物具有较强金属螯合能力[23]。米糠多肽对Fe3+的螯合能力可能与其中含有多羟基酚酸类化合物有关。中等分子质量的米糠多肽主要产生多羟基酚酸类化合物以螯合金属离子,属于金属离子螯合能力的抗氧化机制。

图10 米糠蛋白和米糠多肽对Fe3+螯合能力Fig.10 Fe3+-chelating capacity of rice bran protein and rice bran polypeptides
3 结 论
本研究将米糠多肽超滤后分别获得Mw>10kD、Mw3~10kD、Mw<3kD不同分子质量的米糠多肽混合物组分,将它们与米糠蛋白、VC和BHT的抗氧化能力进行对比,研究结果说明,米糠多肽的抗氧化活性与蛋白分子质量大小、质量浓度等密切相关。
随着不同分子质量的米糠多肽的质量浓度增加,抗氧化活性都有相应程度的增加。高分子质量的米糠多肽(Mw>10kD)在高质量浓度(9.6mg/mL)的条件下对·OH的清除能力最强,属于具有活性氧自由基清除能力的抗氧化机制。Mw<3kD的米糠多肽在高质量浓度(9.6mg/mL)的条件下对·的清除能力、DPPH自由基的清除能力、ABTS+·清除率、Fe3+还原能力最大,属于电子转移(SET)的抗氧化机制。质量浓度在9.6mg/mL时Mw为3~10kD的米糠多肽对Fe3+螯合能力最强,属于金属离子螯合能力的抗氧化机制。
在米糠活性肽应用过程中,应根据实际情况,选择具有最佳效果的相应质量浓度及分子量肽段的米糠蛋白产品。
[1]MAYNE S T.Antioxidant nutrients and chronic disease∶ use of biomarkers of exposure and oxidative stress status in epidemiologic research[J].J Nutr, 2003, 133(3)∶ 933-940.
[2]郑荣梁, 黄中洋.自由基医学与农学基础[M].北京∶ 高等教育出版社;施普林格出版社, 2001.
[3]BRAN A L.Toxicology and biochemistry of BHA and BHT[J].JAOCS, 1975, 52(2)∶ 372-375.
[4]姚惠源, 周素梅, 王立, 等.米糠与米糠蛋白质的开发与利用[J].无锡轻工大学学报, 2005(3)∶ 312-317.
[5]张强, 周正义, 王松华.从米糠中制备抗氧化肽的研究[J].食品工业科技, 2007, 28(7)∶ 145-147.
[6]丁青芝, 骆琳, 张连波, 等.酶法制备米糠蛋白ACE活性肽[J].粮油加工, 2008(4)∶ 95-98.
[7]CHANPUT W, THEERAKULKAIT C, NAKAI S.Antioxidative properties of partially purified barley hordein, rice bran protein fractions and their hydrolysates[J].Journal of Cereal Science, 2009,49∶ 422-428.
[8]林敏刚, 潘丽, 谷克仁, 等.酶法制备米糠抗氧化生物活性肽的最佳条件的研究[J].粮油加工, 2010(6)∶ 48-52.
[9]樊金娟, 罗霞, 付岩松, 等.米糠抗氧化肽大鼠体外抗氧化作用研究[J].食品科学, 2010, 31(9)∶ 251-254.
[10]王会, 郭立, 谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业, 2006(3)∶ 92-98.
[11]王会, 郭立, 谢文磊.抗氧化剂抗氧化活性的测定方法(二)[J].食品与发酵工业, 2006(4)∶ 98-102.
[12]李华, 李佩洪, 王晓宇, 等.抗氧化检测方法的相关性研究[J].食品与生物技术学报, 2008, 27(4)∶ 6-11.
[13]XIE Zhengjun, HUANG Junrong, XU Xueming, et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry, 2008, 11(2)∶ 370-376.
[14]刘杨, 张占雄.多肽含量的测定方法的比较[J].内蒙古石油化工,2008(5)∶ 65.
[15]王天山, 刘冰晶, 陈光英, 等.海南血桐提取物抗氧化活性研究[J].食品科技, 2010, 35(12)∶ 212-215.
[16]李利华.马铃薯块茎提取物的抗氧化的研究[J].食品工业科技,2010(11)∶ 121-123.
[17]曹炜, 卢珂, 陈卫军, 等.不同种类蜂蜜抗氧化活性的研究[J].食品科学, 2005, 26(8)∶ 352-356.
[18]沈淑英, 魏艳, 赵敏, 等.螯合铁离子能力测定方法比较[J].印染助剂, 2009, 26(7)∶ 50-52.
[19]凌关庭.抗氧化食品与健康[M].北京∶ 化学工业出版社, 2004.
[20]郑喜群.玉米黄粉的酶解工艺与抗氧化活性肽的制备[D].北京∶ 中国农业大学, 2006.
[21]徐清萍, 钟桂芳, 芳孟君.抗氧化剂抗氧化方法研究进展[J].食品工程, 2007(6)∶ 23-25.
[22]YEN G C, DUH P D, TSAI C L.Relationship between antioxidant activity and maturity of peanut hulls[J].Agric Food Chem, 1993, 41∶67-70.
[23]MARIKEN J T J, DALLINGA J S, VOSSH P, et al.A critical appraisal of the use of the antioxidant capacity(TEAC) assay in defining optimal antioxidant structures[J].Food Chemistry, 2003, 80∶409-414.
[24]OLIVERIRA C M, FERREIRAA C S, PINHO P G, et al.New qualitative approach in the characterization of antioxidants in whit wines by antioxidant free radical scavenging and NMR technique[J].Agric Food Chem, 2008, 56∶ 10326-10331.
