量子点为载体转染survivinsiRNA至人舌鳞癌Tca8113细胞的研究
2013-02-06赵建江邱小玲
孙 晰 赵建江 邱小玲
南方医科大学附属口腔医院·广东省口腔医院外科,广东广州 510280
人类肿瘤的发生、 发展大多是由于基因的改变致细胞凋亡的异常引起的。 人体常见的口腔肿瘤细胞中,survivin 基因的水平一般都会升高,它会抑制细胞凋亡。 细胞凋亡与增殖一样,是一个高度可调节性的生物化学过程。 RNA 干扰 (RNA interference,RNAi)成为目前的热点研究之一,它是多种生物体内由双链RNA(double stranded RNA,dsRNA)分子介导的基因阻抑现象,通过导入外源或内源的dsRNA,细胞内加工后产生siRNA(小分子干扰RNA 片段)可以特异性阻滞基因的表达,使内源性mRNA 发生特异性降解,从而引起转录后基因沉默(post-transcriptional gene silencing,PTGS)。
量子点(quantum dot,QD)是一种直径在 1~100nm 的半导体纳米颗粒, 而粒径在2~10nm 的量子点可通过内吞作用进入细胞。 QD 具有特殊的光学特性, 单一种类的QD 能按照尺寸变化产生发光波长不同、颜色分明的荧光,并且这种荧光的强度和稳定性都大大优于有机荧光染料, 可以让研究人员更长时间地观察细胞或组织;此外,QD 具有良好的生物相容性,对细胞的毒性低。 2010 年1 月—2012 年9 月在该研究中,利用量子点作为非病毒的基因转染载体, 对口腔鳞癌Tca8113 细胞中高表达的凋亡抑制基因Survivin 的siRNA 进行修饰并转染至人舌鳞癌Tca8113 细胞中, 达到有效抑制survivin 基因的表达至肿瘤细胞凋亡的目的。 以期望对口腔鳞癌细胞中高表达的凋亡抑制基因Survivin 基因沉默提供理论和实践依据,探索出一种安全,低毒,高效并可进行动态观测的siRNA 转运载体。
1 材料
1.1 转染所需设备试剂
(1)人舌鳞癌 Tca8113 细胞
(3)量子点(QD605):表面带正电荷的水溶性量子点,4 mol/L
(4) LIPOFECTAMINE 2000 脂质体
(5) OPTI-MEM I 培养基
(6) 荧光显微镜:OLYMPUS,IX51
1.2 实时定量RT-PCR 所需主要试剂及设备
1.2.1 主要试剂 ①Trizol RNA 提取试剂;②氯仿;③异丙醇;④无水乙醇;⑤SYBR Green PCR Master Mix;⑥焦碳酸二乙酯(DEPC);⑦TBE 电泳缓冲液:Tris 碱 54 g,硼酸 27.5 g,0.5 mol/EDTA(PH:8.0)20 mL,加双蒸水600 mL,剧烈搅拌至溶解,加水至1000 mL定溶,即为5×TBE,用时加双蒸水稀释成0.5×TBE;⑧核酸染料。
1.2.2 主要设备 ①高速冷离心机:Heraeus,Megafuge 1.0 R;②定量 PCR 仪:ABI PRISM 7500*Sequence Detection System; ③电热恒温鼓风干燥箱:Heraeus,UT6; ④Eppendof 管、Tip 头等均用 0.1%的DEPC 水浸泡过夜,用无菌蒸馏水冲洗后,高压灭活DEPC 活性,37℃烤箱烘干备用;⑤电热恒温水浴锅:Grant,OLS200;⑥凝胶成像分析系统:Tanon1600;⑦电泳仪:Tanon,DYY-6X 型;⑧纯水制备系统:Millipore;⑨医用微波炉:Galanz。
电化学直接氧化法是通过反应过程中的污染物直接与电极电子传递,通过阳极的高电势进行氧化降解废水中的有机污染物和无机污染物。在氧化过程中,污染物不同导致被氧化的程度也不相同[19]。国外一些研究学者用电化学方法处理高盐废水,用石墨作为实验电极材料,研讨了电氧化方法的相关参数(盐浓度、电流密度、时间、pH等)对去除有机物的作用及影响等[20],把处理过后的废水应用于制革工艺,事实表明电化学氧化工艺可以用于处理高盐废水。
2 方法
2.1 Tca8113 细胞的培养
细胞传代培养到3~4 代时用于实验。
2.2 量子点介导survivin siRNA 转染Tca8113 细胞
(1)当内皮细胞贴壁,达到80%~90%融合后,于转染前1 d,以4×105细胞/孔接种于6 孔板,于含血清、不含抗生素的DMEM培养基中培养。转染时,细胞融合率达到60%~70%。 细胞随机分为三组:实验组(量子点组)、对照组(LIPOFECTAMINE 2000 脂质体),空白组(未转染组)。
(2)溶液 1 的配制:实验组:237.5 L OPTI-MEM I+12.5 L QD 每孔(总体积 250 L),室温孵育 5 min;对照组:245L OPTI-MEM I+5 L lipofectamine 2000 每孔(总体积 250 L),室温孵育 5 min;
(3)溶液 2 的配制:245 L OPTI-MEM I+5 L siRNA 每孔(总体积 250 L)。
(4)将溶液 1 轻轻地与溶液 2 混合,室温下孵育 20 min。 同时,将6 孔板的细胞用无血清且不含抗生素的培养基漂洗2 遍,加入 1.5 mL OPTI-MEM I。
(5)将溶液1 与溶液2 的混合液逐滴加入孔中,轻轻摇动培养板混匀。 置37℃,5% CO2培养箱中培养5~6 h 后更换含血清不含抗生素的生长培养基,置37℃,5% CO2养箱中继续培养。
(6) 转染24 h 后在荧光显微镜蓝光下观察各组细胞转染情况并拍照,同时计算转染率。 转染率=(每100 个细胞中表达荧光的细胞/100)×100%
2.3 定量 RT-PCR 检测转染后 48h 的 Tca8113 细胞中 survivin mRNA 表达
(1)细胞总 RNA 的提取
(2)去基因组
使用 RNase-free 的 DNase(Promega),按以下体系配置反应液,37 ℃消化 30 min,65 ℃灭活 10 min。
(3)总 RNA 纯度和完整性检测
①纯度检测:取 1 μL RNA 样品60 倍稀释,在BioPhotometer plus 艾本德核酸蛋白测定仪上测定OD 值,OD260/OD280 的比值>1.8,说明制备的RNA 较纯,无蛋白质污染。
②总 RNA 完整性检测: 取 RNA 样品 1 μL,1%琼脂糖凝胶电泳80V×20 min, 用凝胶成像系统观察总RNA 的5s rRNA,18 s rRNA 和28 s rRNA 条带,三条条带完整的话即可证明总RNA 抽提比较完整。
(4)逆转录
(5)定量 PCR
①检测序列片段大小;内参片段: 18SrRNA-112 bp,目的片段: survivin -180 bp (GeneID: 332)。
②设 计的引物 :qh- survivin-F1: 5’ AAATGACTTGGCTCGATGCT;qh- survivin-R1:5’ TCCATCATCTTACGCCAGACT。
③反应体系:

表1 反应体系
(4)反应条件: 95℃ 5min,
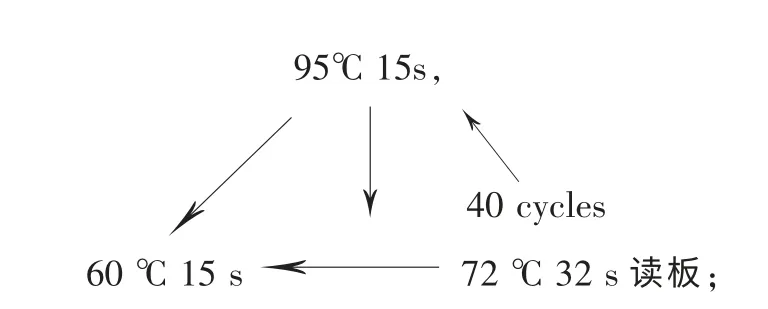
融解曲线分析:温度 60~95 ℃
每个样重复3 次。
3 结果
3.1 量子点组与 lipofectamine 组转染 survivin siRNA 至 Tca8113细胞的情况
荧光显微镜下观察到细胞内有绿色荧光表达, 说明标记有FAM 绿色荧光的siRNA 有效转染入Tca8113 细胞中, 组间转染率差异不明显(图1、2)。

图1 荧光显微镜下实验组细胞转染情况(×100)
3.2 实时定量 RT-PCR 检测转染后 Tca8113 细胞中 survivin mRNA 的表达情况
各组转染后48 h 实时定量RT-PCR 检测各组细胞survivin mRNA 的相对表达量。 表2 可见: 转染 48 h 后 Tca8113 细胞中实验组、对照组survivin mRNA 的相对表达量只有空白组的0.36 倍、0.1 倍,表达水平均有下降。 见图3。
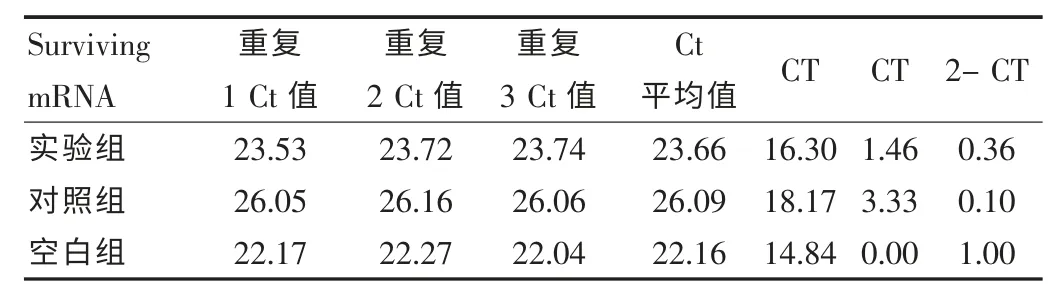
表2 实时定量RF-PCR 检测转染后Tca8113 细胞中survivin mRNA的表达情况
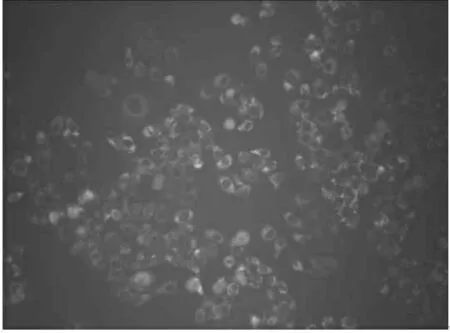
图2 荧光显微镜下实对照组细胞转染情况(×100)
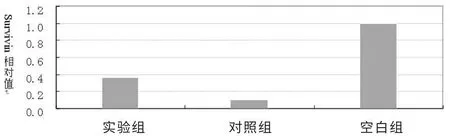
图3 转染48 h 后survivin 的相对表达量
4 讨论
激光共聚焦显微镜证实了量子点为载体可以成功转染survivin siRNA 至Tca8113 细胞(图2)以及量子点的使用范围在安全范围内, 接下来本实验通过实时定量RT-PCR 技术检测转染后Tca8113 细胞内survivin mRNA 表达量下降的百分比,本实验设立lipofectamine2000 脂质体这一经典转染载体作为对照组。实验组用 50 pmolQD 转染 100 pmol survivin siRNA 入 Tca8113 细胞48h 后,检测到survivin siRNA mRNA 表达量相对于空白组下降 64%,QD 与 siRNA 的使用比例为 1∶2(图1);对照组中用 100 pmol lipofectamine2000 脂质体转染 100 pmol survivin siRNA 入Tca8113 细胞 48h 后, 检测到 survivin siRNA mRNA 表达量相对于空白组下降 90%,QD 与 siRNA 的使用比例为1∶1(常规比例)。因此,本实验QD 的用量为经典转染载体lipofectamine2000 脂质体参考使用量的一半, 对靶细胞Survivin 基因的沉默率超过lipofectamine2000 脂质体的一半,这些结果表明,量子点在可观察性和沉默率方面都表现了良好的特性。
survivin 基因是凋亡抑制蛋白基因家族的一个新成员, 鉴于该蛋白在肿瘤细胞凋亡和增殖中的重要作用,自发现以来已经成为人类基因组中众多肿瘤特异基因的代表之一,其蛋白因其特殊生物学功能被认为是针对肿瘤治疗的一个强有力的靶分子。survivin 的主要生物学功能就是抗凋亡, 它是目前已知作用最强的凋亡抑制蛋白。
RNA 干扰(RNA interference,RNAi) ,如今已成为分子生物学领域最热门的研究课题之一。 RNA 干扰是指在生物体内,通过外源性或内源性双链RNA 引发的序列特异性基因沉默,在此过程中长双链RNA 被Dicer 识别加工后, 成为只具有21~25 nt长度的短双链RNA 即 SiRNA, SiRNA 是RNAi 过程中的效应分子,与某些核蛋白酶形成一个复合体(RISG),RISG 再通过SiRNA 的反义链识别具同源序列的 mRNA 并使其降解,从而导致特定基因基因沉默[1],由于RNAi 具有高度的序列专一性,可以特异地使特定基因沉默,获得功能丧失或降低突变,因此RNAi 可以作为一种强有力的研究工具, 用于功能基因组和基因治疗的研究。 2002 年 12 月 20 日, Si RNA & RNAi 被 Science 杂志评为年度十大科技成就之首,Nature 杂志亦将Si RNA 评为年度重大科技成果之一。
尽管RNAi 技术飞速发展,但在机制研究和应用方面还存在着许多问题。 在应用研究领域,最主要的问题还是转运系统的选择。目前转运SiRNA 至细胞内主要通过病毒或非病毒载体,对于病毒载体,如慢病毒,腺伴随病毒等,虽然高效,但是安全性和毒性限制了它的发展[2-3];对于非病毒载体,他们的低效率是限制他们使用的主要因素[4]。 有学者研究[5],有机荧光修饰 SiRNA 后转运,通过荧光显微镜进行动态观察,但是,5~10 s 荧光信号就丧失了一半多。最重要的是,长时间同时追踪和监测多种SiRNA 的转运,观察基因沉默是一件非常困难的事。 因此,发现一种安全,低毒,高效和自我追踪和监测多种SiRNA 的转运载体非常迫切。
近年来,随着纳米技术,生物技术与材料技术的飞速发展,量子点(QD)作为生物分子的荧光检测,特别是为多种分子同时实时动态检测提供了可能。 量子点表现出独特的光学特征,目前研究证实:量子点的发光特性具有以下特点[6-11]:①量子点的激发光波的范围宽且连续分布,而发射波长的范围窄且对称分布,斯托克斯(Stokes)位移大,不同量子点或同一材料不同粒径的量子点在同一光源下发射出不同的颜色的光,即发射光谱不出现交叠,或只有很少交叠, 这使得不同粒径量子点标记的各类分子容易区分,识别。 量子点的发光特征具有严格的量子点尺寸效应,通过改变量子点粒径大小(从1.8~7 nn)可获得从紫外到近红外范围或从蓝色到红色波长范围内任意点的光谱, 这些光学特征十分适合修饰多种SiRNA 后转运,同时观察基因沉默的情况。 ②量子点荧光产率高,发光强度强,光化学稳定性好,不易被光解或漂白,它的发光强度是目前用的有机荧光强20 倍,光化学稳定性则提高了100 倍以上。 这可对SiRNA 转运后基因沉默长时间观察。 综上所述,量子点因其特殊的光学特性不仅可对siRNA 转染过程进行实时动态观察, 并且能够有效的抑制Tca8113 细胞survivin mRNA 的表达,因此量子点有望作为RNA 干扰技术的新型载体。
[1]HunotS,FLavellRA.Apoptosis:Death of a nonopoly[J].Science,2001,292(5518): 865-866.
[2]Hannon GJ,Rossi JJ.Unlocking the potential of the human genome with RNA Interference[J].Nature,2004,43(7006):371-378.
[3]Clay M.The silent treatment[J].Nature,2004,431(7008):599.
[4]Thomas M,Lu JJ,Ge Q,Zhang CC,et al.Full deacylation of polyethylenimine dramatically boosts its gene delivery efficiency and specificity to mouse lung[J].Proc Nat Acad Sci USA,2005,102(16):5679-5684.
[5]Dahan M,Levi S,Luccardini C.et al.Diffusion dynamics of glycine receptors revealed by single quantum dot tracking [J].Science, 2003,302:442-445.
[6]Chan WCW,Maxwell DJ,Gao XH.et al.Luminescent quantum dots for multiplexed biological detection and imaging [J].Curr Opin Biotechnol,2002,13(1):40-46.
[7]Alivisatos P.The use of nanocrystals in biological detection [J].Nat Biotechnol, 2004,22(1):47-52.
[8]Tanke HJ,Dirks RW,Raap T.Fish and immumocytochemistry: Towards visualizing single target molecules in living cells [J].Curr Opin Biotechnol, 2005,16(1):49-54.
[9]Michalet X,Pinaud FF,Bentolila LA,et al.Quantum dots for live cells,in vivo imaging and diagnostics[J].Science, 2005,307(5709):538-544.
[10]Alam F,Yadav N.Potential applications of quantum dots in mapping sentinel lymph node and detection of micrometastases in breast carcinoma[J].J Breast Cancer,2013,16(1):1-11.
[11]Brakmane G,Madani SY,Seifalian A.Cancer Antibody Enhanced Real Time Imaging Cell Probes-A Novel Theranostic Tool using Polymer Linked Carbon Nanotubes and Quantum Dots [J].Anticancer Aqents Med Chem,2013, 2013 Mar 27.
