胃癌术后肠内高营养54例临床分析
2013-02-02陈振亮
陈振亮
胃癌术后肠内高营养54例临床分析
陈振亮①
目的:探讨胃癌术后肠内营养的临床特点及注意事项。方法:回顾性分析本院2010年1月-2012年1月胃癌术后肠内营养的患者(实验组)54例,对比同时期肠外营养途径患者(对照组)35例,观察两组患者在术后营养评估指标(血液总蛋白、白蛋白、前白蛋白、转铁蛋白)方面的差异,同时观察两组患者排气及相关肝脏功能情况。结果:两组患者均术后恢复良好,实验组与对照组在术后营养评估方面的变化比较差异具有统计学意义(P<0.05);在术后排气时间方面,实验组明显短于对照组(P<0.05),术后肝功能方面实验组与对照组比较差异无统计学意义(P>0.05)。结论:肠内营养可早期为机体提供术后恢复的营养物质,有利于胃癌患者术后的早期恢复,可作为胃癌患者术后的重要营养支持治疗途径。
胃癌术后; 肠内高营养; 临床分析
随着健康水平的提高,胃癌的早期发现和新辅助化疗的推广,提高了胃癌的手术实施率,也使得胃癌术后无病生存期和存活率得到了极大的提高。由于胃癌患者术前多数营养状况不良,术后创伤及胃肠道的重建,使得术后营养支持成为了术后恢复的关键。肠内营养(enteral nutrition,EN)的使用是临床营养支持的重要治疗手段之一,笔者回顾性分析本院胃癌术后的肠内营养病例54例,探讨了胃癌术后肠内营养的临床特点及注意事项,现报告如下。
1 资料与方法
1.1 一般资料 选择本院2010年1月-2012年1月胃癌术后实施肠内营养的患者54例,设为实验组。其中男33例,女21例,年龄45~74岁,平均(63.5±7.5)岁,年龄大于60岁者37例,小于60岁者17例。选择同期施行肠外营养途径的患者35例,设为对照组。两组患者在性别、年龄等一般资料方面比较差异无统计学意义(P<0.05),具有可比性。
1.2 治疗方法 实验组中远端胃癌根治术41例,近端胃癌根治术13例,术前留置胃管和空肠营养管,术中摆放空肠管远端至吻合口和屈氏韧带下15 cm以外。术后按照热卡30~35 ka1/ kg在术后第2~3天开始给予短肽类肠内营养制剂,鼻饲泵速控制在20~30 ml/h,每天肠内营养提供的热量换算成容量后给予机体总体需要量的1/3~1/2[1]。在术后第5天后给予高蛋白肠内营养混悬液。根据患者耐受情况适当逐步增加剂量及速度。在术后第5天逐步减少液体输入量,逐步结合经口饮食,在术后第7~10天停止静脉液体输注。对照组采用肠外营养途径。
1.3 观察指标 观察两组患者在术后营养评估指标方面的差异,指标包括血液总蛋白、白蛋白、前白蛋白、转铁蛋白,同时观察两组患者排气及相关肝脏功能情况[2]。
1.4 统计学处理 使用SPSS 13.0统计软件进行分析处理,计量资料以(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
两组患者均术后恢复良好,实验组与对照组在术后白蛋白、前白蛋白、转铁蛋白的差异具有统计学意义(P<0.05),见表1。在术后排气时间方面,实验组明显短于对照组(P<0.05),术后肝功能方面实验组与对照组比较差异无统计学意义(P>0.05),见表2。
表1 两组术后营养评估指标比较(±s)
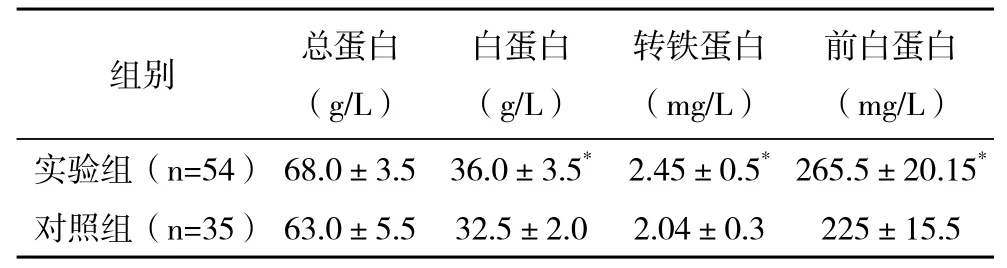
表1 两组术后营养评估指标比较(±s)
*与对照组比较,P<0.05
组别 总蛋白(g/L)白蛋白(g/L)转铁蛋白(mg/L)前白蛋白(mg/L)实验组(n=54) 68.0±3.5 36.0±3.5* 2.45±0.5*265.5±20.15*对照组(n=35) 63.0±5.5 32.5±2.0 2.04±0.3 225±15.5
表2 两组相关排气时间及肝脏功能的比较(±s)
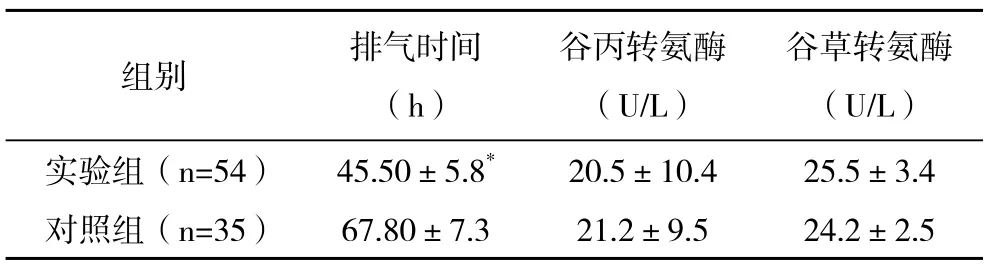
表2 两组相关排气时间及肝脏功能的比较(±s)
*与对照组比较,P<0.05
组别 排气时间(h)谷丙转氨酶(U/L)谷草转氨酶(U/L)实验组(n=54) 45.50±5.8* 20.5±10.4 25.5±3.4对照组(n=35) 67.80±7.3 21.2±9.5 24.2±2.5
3 讨论
胃癌患者由于既往胃肠道系统疾病和肿瘤的局部及全身影响,术前多数存在不同程度的营养不良。由于手术切除范围广,术后恢复时间长,术后营养状况的改善成为了手术成功与否的的重要决定因素[3]。随着胃肠动力学研究的深入,术后胃肠动力功能恢复是以胃肠移行性复合运动波(migrating myoelectric complex,MMC)的出现为标准[7]。相关实验证实,术后肠道麻痹仅限于胃和结肠,腹部手术后0.5~4 h即可测得MMC的出现[8]。在胃癌术后,随着胃肠道功能的恢复,在无术后禁忌的情况下尽早使用肠内营养可更好的提供机体营养,可更好的促进肠道功能的早期恢复[9]。随着人们对肠道功能的认识和肠道功能及毒素移位,肠粘膜萎缩等方面的重新理解,肠内营养在胃肠术后也得到了极大的重视。肠内营养的实施,可为肠道提供能量,保护肠道吸收功能;降低术后肠道菌群移位,降低并控制感染[4]。肠道黏膜细胞的主要能量来源不是来自于肠系膜动脉,其70%的能量来自肠腔内供能[5]。长时间的肠外营养应用,不仅可引发胆汁淤积,肠道菌群移位,还可引起肠道粘膜坏死,肠源性败血症的发生[6]。
然而肠内营养(EN)的过程中患者可出现腹痛、腹泻、腹胀、反流、恶心、呕吐等胃肠道不良症状。在使用过程中要注意营养液的种类,输注浓度、速度、温度、营养液污染及营养管位置等因素。在实际的使用中,要根据患者不同术式及情况,个体情况,采取由少到多,由慢到快,循序渐进的原则[10]。尤其是针对长期禁食水的患者,早期缓慢,低浓度更能增加肠道耐受,减少腹痛腹泻的发生。早期肠内营养可通过观察胃管抽吸胃液的颜色,判定滴注速度是否过快,若出现胃管内抽吸出肠内营养液,则说明肠道反流存在,应降低肠内营养速度的同时,抬高滴注时上身高度,防止反流持续存在引起患者不适。肠内营养管放置距离屈氏韧带20 cm以外可以减少肠内营养治疗中的恶心、呕吐和误吸的发生率。早期的腹胀,腹泻多数由于发生在肠内营养的早期,具体原因可能与肠道黏膜的损伤修复、早期缺血后耐受情况较差有关,可选用短胎营养制剂并适当降低营养液的浓度[11]。本组病例中,肠内营养在术后早期的营养恢复方面较普通肠外营养患者具有明显优势(P<0.05)。并且在术后排气方面明显早于常规肠外营养组(P<0.05)。同时在肝脏功能损伤方面无明显差异(P>0.05)。
总之,肠内营养不仅可早期为机体提供术后恢复的营养物质,还能够提供肠道生长所需的能量,减少术后肠道粘膜的损伤,有利于胃癌患者术后的早期恢复,可作为胃癌患者术后的重要营养支持治疗途径。
[1] 宋延强,吕文平,庞新建.老年胃癌患者术后早期肠内营养与肠外营养疗效的比较[J].中华普通外科学杂志,2004,19(2):98-99.
[2] 丁盛,蒋利,张渝华,等.肠内营养混悬液在食管癌术后早期肠内营养中的应用[J].中华胃肠外科杂志,2012,15(5):520-521.
[3] 徐红,庄文,周勇.消化道肿瘤病人术后应用肠内营养的临床研究[J].华西医学,2004,19(1):60-61.
[4] 丁盛,蒋利,张渝华,等.肠内营养混悬液在食管癌术后早期肠内营养中的应用[J].中华胃肠外科杂志,2012,15(5):520-522.
[5] 李明章,王继军,邬海峰,等.早期肠内营养在上消化道手术后病人的疗效观察[J].肠外与肠内营养,2012,19(1):54-55.
[6] 吴肇汉.外科患者的营养代谢[M].北京:人民卫生出版社,2008:1140-1141.
[7] 王琦三,王海江.早期肠内营养对胃癌患者术后免疫功能的影响[J].新疆医科大学学报,2007:30(6):612-613.
[8] Lewis S J,Egger M,Sylvester P A,et al.Early enteral feeding versus“nilby mouth”after gastrointestinal surgery: systematic review and meta-analysis ofcontrolled trials[J].BMJ,2001,323(7316):773.
[9] 纪勇,陈静瑜,郑明峰,等.食管癌病人术后早期肠内营养的临床应用[J].肠外与肠内营养,2012,19(1):21-22.
[10] 李江,刘斌,侯宇,等.腹部外科术后早期肠内营养的临床研究与应用[J].中国普外基础与临床杂志,2006,13(3):355-356.
[11] 郑晓君.老年胃癌患者手术后早期肠内营养对预后的影响研究[J].中国医药科学,2011,1(6):74,78.
Haifeng Pengpai Memorial Hospital,Haifeng 516400,China
Analysis of 54 Case with Gastric Enteral Nutrition
CHEN Zhen-liang.
Objective:To investigate the clinical features of gastric enteral nutrition and precautions.Method:Selected author’s hospital in January 2010-2012 January 54 cases of patients with gastric enteral nutrition (experimental group), compared to the same period 35 cases of parenteral nutrition the ways patients (control group) were observedin the postoperative nutritional assessment indicators: total blood protein, albumin, prealbumin,transferrin difference, and at the same time were observed exhaust and related liver function.Result:The patients were postoperative recovery was good, the experimental and control groups in postoperative nutritional assessment, albumin, prealbumin, transferrin change was a significant difference(P<0.05); postoperative exhaust timeaspects of the experimental group was significantly shorter than the control group (P<0.05), postoperative liver function, the experimental group and the control group, no significant difference (P>0.05).Conclusion:Early postoperative enteral nutrition can recovery nutrients the body, and is conducive to the early recovery of gastric cancer patients, gastric cancer patients as an important nutritional support therapeutic approach.
Gastric cancer after; Enteral nutrition; Clinical analysis
Medical Innovation of China,2013,10(7):133-134
①广东省海丰县彭湃纪念医院 广东 海丰 516400
陈振亮
10.3969/j.issn.1674-4985.2013.07.078
2013-01-08)(本文编辑:连胜利)
