两种酶法制备麦麸低聚木糖的比较
2013-01-29李敏康宋宏新
张 帆, 李敏康, 宋宏新
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
低聚木糖(Xylooligosaccharides,简称XOs)是一类功能性低聚糖,是木聚糖的降解产物,由2~7个木糖以β-1,4-糖苷键连接而成的聚合性糖,此外还含有阿拉伯糖醛酸、葡萄糖醛酸侧链[1].低聚木糖主要以木二糖和木三糖为有效成分[2].因其具有调节肠道功能,促进双歧杆菌增殖、低热量、防龋齿、促进钙的吸收、无毒安全性、抗炎、抗疲劳、降血压、血糖、血脂和胆固醇等生理功能,近年来已成为国内外研究热点.
在固态发酵中,底物(基质)是不溶于水的聚合物,不仅可以提供微生物生长所需的碳源、氮源、无机盐、水分以及其他营养物,更是微生物生长的载体[3].小麦麸皮除蛋白质、纤维素、矿物质含量较高外,含有大量碳水化合物[4].它既是碳源,又是氮源,还含有某些对微生物生长和产酶能起促进作用的因子[5],故可作为固态发酵的基质来培养微生物.小麦麸皮中的碳水化合物多为细胞壁多糖,主要由阿拉伯木糖、纤维素、葡聚糖等组成,其中阿拉伯木聚糖为主要成分[6,7],约为小麦麸皮非淀粉多糖的70%[8],可由酶法降解为低聚木糖.
本文对比了微生物以麦麸为发酵基质通过固态发酵制备低聚木糖与商品酶制剂制备低聚木糖等两种制备方法的差异,探讨了微生物固态发酵麦麸制备低聚木糖的可行性,为小麦麸皮的综合利用以及低聚木糖的制备提供了新途径.
1 材料与方法
1.1 材料
1.1.1 原料及菌种
麦麸,市售;木霉(Trichodermasp.),陕西科技大学微生物实验室保藏菌种.
1.1.2 主要试剂与仪器
主要试剂:3,5-二硝基水杨酸、薄层层析硅胶GF254、吐温-20为化学纯;木聚糖酶、95%低聚木糖、D-木糖为生化试剂;苯胺、二苯胺、正丁醇、吡啶等试剂均为国产分析纯.
主要仪器:MJ-250B型霉菌培养箱,上海佳胜实验设备有限公司;722E型可见分光光度计,上海光谱仪器有限公司;HC-3018R型高速冷冻离心机,科大创新股份有限公司中佳分公司;SYQ.DSX-280型手提式压力灭菌锅,上海申安医疗器械厂.
1.2 实验方法
1.2.1 微生物固态发酵麦麸制备低聚木糖
以木霉为实验菌种,麦麸为唯一发酵基质进行固态发酵,在木霉生长期诱导产生木聚糖酶降解麦麸以制备低聚木糖,其工艺流程如图1所示.
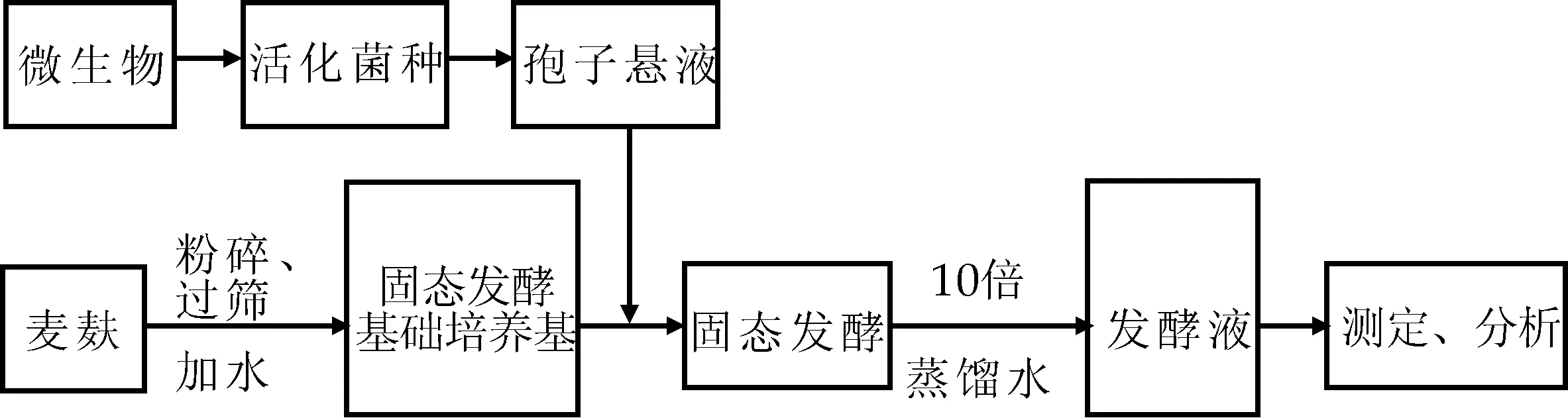
图1 微生物固态发酵麦麸制备低聚木糖工艺流程
固态发酵液的制备:称取10 g麦麸于250 mL三角瓶后,依次加入10 mL磷酸氢二钠-柠檬酸缓冲溶液,以1%接种量接入浓度为107个·mL-1的孢子悬液,搅拌后于28 ℃恒温培养84 h.固态发酵完成后,向三角瓶中加入10倍蒸馏水,于37 ℃恒温水浴摇床以135 r·min-1振荡浸提1 h,5 000 r·min-1、4 ℃离心20 min,去除孢子和固形物,经无菌滤纸过滤,所得发酵液备用.
测定固态发酵液的可溶性总糖含量、还原糖含量,计算低聚木糖平均聚合度及低聚木糖的含量,并对固态发酵液薄层层析分析其组成成分.
以木霉为实验菌种,麦麸为唯一发酵基质进行固态发酵试验,考察了起始pH、起始含水量、接种量、吐温-20添加量、发酵温度、发酵时间、低聚木糖添加量等几个单因素对固态发酵的影响[9],并在单因素结果基础上选定培养温度为28 ℃培养60 h后转入37 ℃培养24 h,发酵总时间84 h,低聚木糖的添加量为0.25%,设计起始pH、起始含水量、接种量、吐温-20添加量四因素三水平的正交试验,因素水平表如表1所示.

表1 因素水平表
1.2.2 商品木聚糖酶酶解麦麸木聚糖制备低聚木糖
以碱法粗提木聚糖[10]为底物,通过商品木聚糖酶对其降解制备低聚木糖,其工艺流程如图2所示.
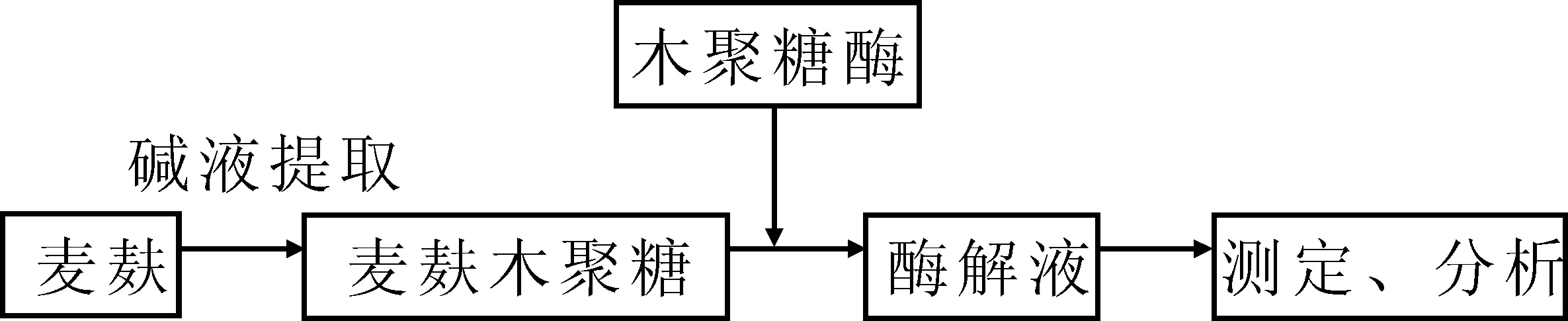
图2 商品酶酶解麦麸木聚糖制备低聚木糖工艺流程
酶解液的制备:称取2 g粗提木聚糖、0.428 0 g木聚糖酶于100 mL三角瓶中,加入pH6.0的磷酸氢二钠-柠檬酸缓冲溶液40 mL,将三角瓶于36 ℃水浴摇床,以135 r·min-1振荡反应4 h,反应结束后立即于沸水浴中灭酶,于4 ℃下5 000 r·min-1离心20 min,去除固形物,上清液经滤纸过滤备用.
测定酶解液中的可溶性总糖浓度、还原糖浓度,计算低聚木糖平均聚合度和酶解液中的低聚木糖含量,对酶解液薄层层析分析其组成成分.
1.2.3 分析方法
(1)还原糖(按木糖计)的测定:
采用3,5-二硝基水杨酸(DNS)法测定,绘制木糖标准曲线[9],540 nm下吸光度值(Y)与木糖含量(X)的回归方程为:Y=0.822 7X+0.015 5,R2=0.996 8.
(2)可溶性总糖的测定:
取1 mL发酵液或酶解液,加入3 mL浓度为6 mol·L-1的盐酸,沸水浴处理2 h,冷却后以6 mol·L-1氢氧化钠中和至中性,定容至10 mL,稀释适当倍数按DNS法测定.
(3)低聚木糖含量的计算:
低聚木糖含量=可溶性总糖含量-还原糖含量.
(4)低聚木糖平均聚合度[11]的计算:
平均聚合度=可溶性总糖浓度/还原糖浓度.
低聚木糖平均聚合度表示由木糖为基本单元聚合而成的低聚木糖所含木糖数目的平均值,可以用于衡量低聚木糖的主要组成成分种类.
(5)硅胶薄层层析:
展开剂:V(正丁醇)∶V(吡啶)∶V(蒸馏水)=6∶4∶3;显色剂:苯胺-二苯胺试剂.
(6)麦麸木聚糖降解率:
木聚糖在木聚糖酶的作用下降解成低聚木糖,低聚木糖的生成量与麦麸木聚糖含量的比值为麦麸木聚糖降解率,可衡量木聚糖酶对木聚糖的降解程度.
2 结果与讨论
2.1 木霉固态发酵麦麸的最佳工艺确定
正交试验结果如表2所示.
由表2得出各因素的主次顺序为B>D>A>C,制备低聚木糖的最佳条件组合为B2D2A3C3,即起始含水量10 mL、吐温-20添加量0.05%、起始pH5.0、木霉接种量1.5%.
在正交试验确定的最优条件下,固态发酵液中可溶性总糖含量为198.62 mg·g-1,还原糖含量为49.32 mg·g-1,低聚木糖含量为149.3 mg·g-1,平均聚合度为4.027,麦麸木聚糖降解率为66.21%.

表2 正交试验结果
2.2 两种生物酶法的比较
2.2.1 工艺比较
两种方法(见图1和图2)均是利用酶法催化降解麦麸木聚糖来制备低聚木糖,前者以培养产酶微生物为出发点,麦麸既作为微生物培养的基料、在微生物生长期诱导其产木聚糖酶,同时又作为微生物所产木聚糖酶的酶解底物;而后者直接以商品酶制剂参与酶解过程制备低聚木糖.
传统酶法工艺中一般分为木聚糖酶的产生、提取精制和酶解木聚糖三个过程,而微生物固态发酵麦麸的方法省略了木聚糖酶的提取精制过程,使微生物产木聚糖酶和酶解麦麸木聚糖两个过程在同一体系中进行,只需在麦麸上接种产木聚糖酶微生物,通过调控固态发酵条件培养84 h,便可制得低聚木糖,节省了提取精制木聚糖酶的时间和费用,简化了低聚木糖的制备工艺.
传统酶法酶解温度一般恒定,而固态发酵前期温度以保证微生物生长产酶,发酵后期温度由28 ℃升高至37 ℃,既考虑了微生物的生长需要,又兼顾木聚糖酶酶解要求,从而有效地保证两个过程在同一体系中进行.
麦麸中除含有大量非淀粉多糖外,还含有淀粉、蛋白质等,这些物质的存在会影响木聚糖酶的作用效果,同时增加了后续低聚木糖分离纯化的难度.传统酶法一般先要利用淀粉酶和蛋白酶将其去除再酶解,而固态发酵过程中无需去除淀粉及蛋白质而可被微生物生长利用,简化麦麸预处理工艺.
综上,两种方法的优缺点比较,如表3所示.

表3 两种酶法优缺点比较
2.2.2 结果比较
以固态发酵液及酶解液中的还原糖浓度、可溶性总糖浓度、低聚木糖的平均聚合度、低聚木糖含量、麦麸木聚糖降解率为指标,结合薄层层析对两种生物酶法制备低聚木糖的效果加以比较.成分分析比较如表4所示.薄层层析结果如图3所示.
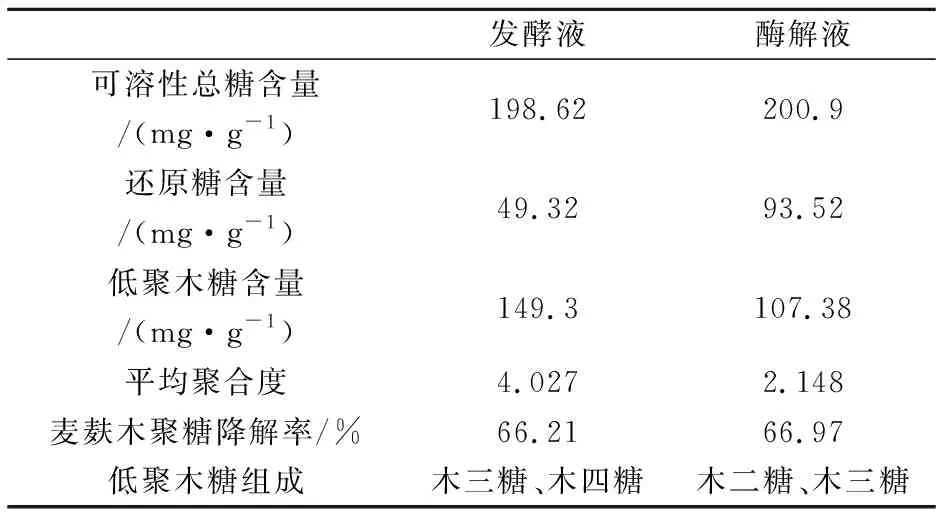
表4 固态发酵液及酶解液的分析比较
由表3可知,微生物固态发酵麦麸所得低聚木糖的含量为149.3 mg·g-1,平均聚合度偏高为4.027,麦麸木聚糖降解率可达66.21%.薄层层析结果显示,固态发酵液中低聚木糖的主要成分为木三糖,而几乎不含木糖和木二糖.说明在固态发酵体系中产生的木糖和木二糖可被微生物利用,进而继续参与发酵过程,从而未能有效积累.
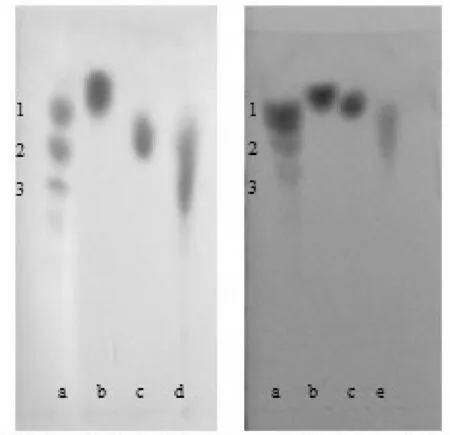
a:1%低聚木糖(1.木二糖 2.木三糖 3.木四糖); b:1%D-木糖; c:1%葡萄糖; d:固态发酵液; e:酶解液图3 固态发酵液及酶解液薄层层析
而商品木聚糖酶酶解粗提木聚糖所得酶解液中,低聚木糖的含量为107.38 mg·g-1,低聚木糖平均聚合度为2.148,酶解液中低聚木糖的主要成分为木二糖、木三糖,几乎不含木糖.说明商品木聚糖酶具有较好的作用效果,充分体现了其内切特性,通过酶解工艺的优化,能够较好地控制酶解进程,麦麸木聚糖降解率为66.97%.
固态发酵液与酶解液中的可溶性总糖含量相当,说明微生物固态发酵麦麸与商品酶制剂的酶解效果相当,微生物所产木聚糖酶适合于酶解麦麸,但还原糖含量却明显低于酶解液中还原糖含量,可能是由于发酵产生的还原糖供微生物生长利用所致.前者平均聚合度偏高,其低聚木糖的组成成分主要为木三糖、木四糖;而后者所得低聚木糖的主要成分为木二糖、木三糖,有效成分较多,制得低聚木糖的质量更高.说明固态发酵过程对于木二糖含量的积累有一定影响,但其制备低聚木糖中含有木三糖、木四糖,证明了该法的可行性.
3 结论
以微生物固态发酵麦麸制备低聚木糖的有效成分主要为木三糖、木四糖,虽然没有商品木聚糖酶所制备低聚木糖有效成分种类多,但由微生物经诱导产生的木聚糖酶对木聚糖具有一定酶解效果,麦麸木聚糖降解率可达66.21%,能够实现微生物以麦麸为固态发酵基质生长,并在生长期诱导所产木聚糖酶降解麦麸同步进行,简化了低聚木糖制备工艺,方法具有可行性,同时麦麸既作为微生物生长的基料又作为木聚糖酶的作用底物,使麦麸得以充分利用,增加了麦麸的附加值,为麦麸的综合利用及低聚木糖的制备探索出了一条新途径.
但其在发酵过程中,木二糖可被微生物再次利用而未能得以积累导致有效成分偏低,同时由于体系复杂,在后续分离纯化过程中也增加了分离低聚木糖的难度.在不同发酵阶段,还应考虑微生物生长、产酶、酶解条件的区分与协调,从而达到提高终产物低聚木糖产量的目的.因此,应该对固态发酵过程中如何提高低聚木糖有效成分,以及降低低聚木糖分离纯化难度方面展开进一步研究.
[1] Kyoji Y,Naoki H,Kunimasa K,et al.Inhibitory effects of acidic xylooligosaccharide on stree-induced gastric inflammation in mice[J].Food Hyg Soc Japan,2006,47(6):284-287.
[2] Carole A,Stephane P,Valerie L P,et al.Wheat bran tissue fractionation using biochemical markers[J].Journal of Cereal Science,2004,39(3):387-393.
[3] 徐福建,陈洪章,李佐虎.固态发酵工程研究进展[J].生物工程进展,2002,22(1):44-47.
[4] Pandey A,Benjamin A,Soccol C R,et al.The realm of microbial lipases in biotechnology[J].Appl Biochem Biotechnol,1999,29(2):119-131.
[5] 林 琳.小麦麸皮的营养成分及其开发利用[J].农业科技与装备,2010,(3):41-42.
[6] Maes C,Delcour A.Structural characterization of water-extractable and water-unextractable arabinoylans in wheat bran[J].Cereal Sci,2002,35(3):315-326.
[7] Beldmna G,Osuga D,Whitaker J R.Some characteristics ofβ-D-xylopyrano-sidases,α-L-arabinofuranosidases and an arabinoxylanα-L-arabinofuranohydrolase from wheat bran and germinated wheat[J].Journal of Cereal Science,1996,23(2):169-180.
[8] Plessi M,Bertelli D,Monzani A,et al.Dietary fiber and some elements in nuts and wheat brans[J].Journal of Food Composition and Analysis,1999,12(2):91-96.
[9] 李敏康,张 帆,宋宏新.木霉固态发酵麦麸制备低聚木糖的初步研究[J].中国酿造,2012,31(12):60-63.
[10] 韩玉洁,徐 冬,徐 忠,等.小麦麸皮中低聚木糖底物—半纤维素提取条件的研究[J].食品研究与开发,2006,27(1):44-47.
[11] 杨书艳,徐春梅,邬敏辰.用玉米芯酸酶法制备低聚木糖的研究[J].安徽农业科学,2007,35(12):3 651-3 653.
