大孔吸附树脂纯化芡实叶中黄酮类物质
2013-01-28张然徐燕杰王晶王立梅
张然,徐燕杰,王晶,王立梅,*
(1.常熟理工学院生物与食品工程学院,江苏常熟215500;2.苏州市食品生物技术重点实验室,江苏常熟215500)
芡实为睡莲科植物芡的干燥成熟种仁。芡实不仅具有食用价值,而且药用范围广泛,属药食两用食品,近年来对芡实进行的大量研究发现芡实含有大量对人体极为有益的成分,如:多糖、维生素、黄酮类化合物、糖苷、生育酚等。芡实叶为芡实加工的副产品,其黄酮类化合物含量较芡实果皮、芡实茎更高[1],很多研究表明[2-4]黄酮类化合物具有抗炎、镇痛、抗病毒、舒张冠状血管等药理作用。本文利用大孔树脂分离纯化芡实叶黄酮类物质,对充分利用芡实产业副产品、促进芡实产业发展有实际意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
芡实叶:购自苏州创德兴芡实有限公司;芦丁标准品:北京世纪奥科生物技术有限公司;大孔吸附树脂(AB-8,D101,HPD100,HZ801):上海蓝季科技发展有限公司;其它试剂均为分析纯。
1.1.2 实验仪器
玻璃层析柱(Ф2×40cm 径高比1 ∶20);TDLSO2B台式高速离心机:上海利鑫坚离心机有限公司;UV 紫外分光光度计:上海菁华科技仪器有限公司;DBS-160F 自动部分收集器:上海精科实业有限公司;恒流泵:上海沪西分析仪器厂有限公司;循环水式多用真空泵(SHB-ⅢA);恒温振荡培养箱:太仓市华美生化仪器厂。
1.2 方法
1.2.1 芡实叶原料预处理
将新鲜芡实叶用0.1%的氯化钠磷酸水溶液浸泡3 min,放入水中冲淋20 min~30 min,取出切小片阴干后烘干至恒重,研磨粉碎,过60 目筛备用。
1.2.2 大孔吸附树脂预处理
称取0.5 BV(bed volume)的大孔吸附树脂,用1 BV乙醇浸泡树脂24 h,湿法装柱,然后用2 BV 的乙醇以2 BV/h 流速通过树脂柱,浸泡4 h~5 h,再用蒸馏水洗至无白色浑浊现象。用2 BV 的5%HCL 溶液以4 BV/h~6 BV/h 的流速通过树脂层,并浸泡树脂2 h~4 h;而后用蒸馏水洗至流出液中性。用2 BV 的2%NaOH 溶液以4 BV/h~6 BV/h 流速通过树脂层,并浸泡2 h~4 h 而后用蒸馏水洗至流出液中性。
1.2.3 上样液制备
定量称取芡实叶粉末干品,按料液比1 ∶25 加入体积分数85%的乙醇,在175 W 的超声波功率下空化40 min,离心,收集上清液,上样前用蒸馏水将上清液定容成所需浓度即为上样液[1]。
1.2.4 标准曲线绘制
精密称取经105 ℃干燥到恒重的芦丁标准样品10.00 mg,用95 % 乙醇溶液定容至100 mL 即得0.10 mg/mL 芦丁标准溶液。精密吸取芦丁标准液0.0、0.5、1.0、2.0、3.0、4.0、4.5 mL,分别用30%乙醇溶液补充至5mL 再分别加入5%NaNO2溶液0.3 mL,然后分别加入0.3 mL 10%Al(NO3)3溶液,再分别加入4%NaOH 溶液2 mL,最后分别用30%乙醇溶液稀释至10.0 mL,放置15 min~20 min 后在该物质的最大吸收峰λ=510 nm 处测吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得吸光度(A)与芦丁质量浓度(C)之间的回归方程为:A =10.139C-0.006 4;R2=0.999 6。
用标准曲线法在相同条件下测定各样品吸光度,同标准曲线方程计算样品中黄酮类物质含量。
1.2.5 大孔吸附树脂静态吸附率测定
准确称取经处理的4 种不同型号(AB-8,D101,HPD100,HZ801)大孔吸附树脂(用滤纸吸干)5 g,置于三角瓶中,加入浓度1.0 mg/mL 芡实叶黄酮类物质提取液100 mL,置于摇床中(25 ℃,150 r/min)静态吸附24 h,过滤;按照1.2.4 方法测滤液的吸光度,计算出C1值。按下式计算各树脂室温下的静态吸附量(mg/g):

式中:Q 为静态吸附量,(mg/g);C0为初始浓度,(mg/mL);C1为剩余浓度,(mg/mL);V 为溶液体积,mL;W 为树脂质量,g。
假设吸附前后溶液体积不变,按下式计算吸附率:
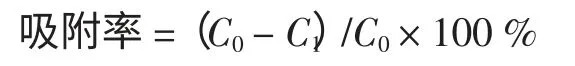
1.2.6 大孔吸附树脂解吸率测定
取上述吸附饱和的大孔吸附树脂用蒸馏水洗至洗脱液无色,滤纸吸干树脂表面残留的溶液,置于250 mL 三角瓶中,加入50 mL 90%乙醇溶液置于摇床中(25 ℃,150 r/min)进行静态解吸24 h,将树脂滤出,测定滤液中黄酮类物质的浓度,并按下式计算解吸率:

式中:C2为解吸液浓度,(mg/mL);C0为初始浓度,(mg/mL);C1为剩余浓度,(mg/mL)。
1.2.7 芡实叶黄酮类物质纯度测定方法
芡实叶黄酮类物质提取液中黄酮类物质浓度乘以提取液体积得芡实叶中黄酮类物质的质量A,然后将该提取液利用电热恒温干燥箱干燥,测得产品干燥后的质量B,按下式求出产品中黄酮类物质的纯度:
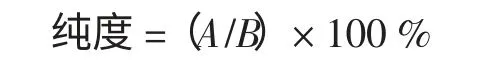
式中:A 为芡实叶中黄酮类物质的质量,g;B 为提取液干燥后的质量,g。
2 结果与讨论
2.1 大孔吸附树脂静态吸附与解吸试验
2.1.1 不同大孔吸附树脂的筛选
不同大孔吸附树脂的筛选结果见表1。

表1 不同大孔吸附树脂对芡实叶黄酮类物质的吸附率及解吸率Table 1 The adsorption and desorption rate of diffrent resins to flavonoids from euryale ferox leaves
由表1 可看出,HPD100 和AB-8 大孔吸附树脂的吸附率和解吸率均较高。影响树脂吸附性能的因素很多,其吸附性能的优劣由其化学和物理结构所决定,树脂的极性和空间结构(孔径、比表面积)是影响吸附性能的重要因素。
2.1.2 AB-8 大孔吸附树脂的静态吸附动力学研究
取HPD100 和AB-8 大孔吸附树脂各5 g,分别加入50 mL 芡实叶黄酮类物质提取溶液,每隔1 小时取1 mL 样液进行测定,直至达到平衡为止,得到树脂的吸附动力学曲线,见图1。

图1 大孔吸附树脂静态吸附动力学曲线Fig.1 Kinetics curve of static adsorption of macroporous resin
由图1 可以看出,HPD100 大孔吸附树脂在起始阶段吸附量小,达到吸附平衡时间需6 h,饱和吸附量大;AB-8 大孔吸附树脂在0 h~3 h 内对芡实叶黄酮类物质的吸附量随时间的增加而迅速增大,在3 h~5 h内,吸附量的增加不明显,在5 h 以后,大孔吸附树脂对芡实叶黄酮类物质的吸附量几乎无变化,饱和吸附量略低于HPD100。由于AB-8 大孔吸附树脂是一种球状、弱极性吸附剂,属于弱酸性、弱极性型吸附树脂[5],在其结构中仅有非离子化功能基,并附加亲水基团以及独特的加工方法,AB-8 大孔吸附树脂具有相当大的比表面积和适宜的孔径,较适于芡实叶黄酮类化合物的纯化。且AB-8 大孔吸附树脂属于快速吸附树脂,可以节省时间,缩短生产周期。综上考虑,选择AB-8大孔吸附树脂作进一步试验。
2.2 大孔吸附树脂吸附芡实叶黄酮的工艺参数考察
2.2.1 不同上样流速对AB-8 大孔吸附树脂吸附效果的影响
取3 BV 芡实叶黄酮类物质提取液(黄酮类物质浓度为3.6 mg/mL),调节pH5,分别以1、2、3 BV/h 的上样流速进行比较实验,见图2。
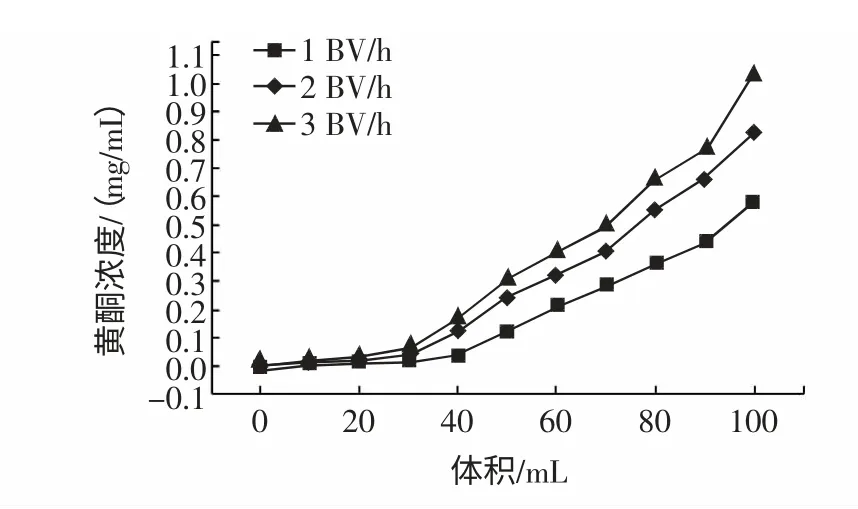
图2 不同上样流速对AB-8 大孔吸附树脂吸附效果的影响Fig.2 The effect of different adsorption velocity on the adsorption impact of AB-8 resin
由图2 可以看出,吸附流速为1 BV/h 和2 BV/h时,泄漏点(泄漏点是指该处漏出液黄酮类物质的浓度为上柱前样液黄酮类物质浓度的1/10,本实验泄漏点在Y 轴上对应0.36 mg/mL)出现较晚;流速为3 BV/h时泄漏点出现最早。流速1、2、3 BV/h 的泄漏点分别出现在82、65、58 mL 附近。上样液通过树脂柱的速度越慢,黄酮类物质越易与大孔吸附树脂充分接触,从而提高吸附效果,但随着吸附流速的加大,泄漏点出现提早,吸附效率随之降低,这是因为流速过快时,大孔吸附树脂还未来得及吸附黄酮类物质,黄酮类物质已随吸附液流出。但是过慢的流速也会降低吸附效率,因为大孔吸附树脂是一种表面吸附剂,其吸附力与树脂的比表面积、表面电性、能否与被吸附物形成氢键等有关[5],如果流速过慢则被吸附物质与树脂之间的作用力会发生变化,影响吸附效果。本实验综合考虑工业化生产成本等因素建议上样流速选用2 BV/h。
2.2.2 不同上样液pH 对AB-8 大孔吸附树脂吸附效果的影响
取3 BV 芡实叶黄酮类物质提取液,以2 BV/h 的吸附流速上样,选择pH 为4、5、6、7 进行比较实验,见图3。

图3 上样液pH 值对AB-8 大孔吸附树脂吸附效果的影响Fig.3 The effect of different initial solution ph value on the adsorption impact of AB-8 resin
由图3 可以看出,pH 分别为4、5、6、7 的上样液经过树脂柱,泄漏点分别在75、83、80、63 mL 附近(泄漏点在Y 轴上对应0.36 mg/mL)。因为芡实叶黄酮类物质有多酚结构,具有较多的羟基,呈弱酸性,故在酸性或弱酸性条件下易被吸附,但酸性较强时黄酮分子易形成“佯盐”,偏碱性时黄酮分子羟基H+离去,黄酮类物质形成离子结构,且有沉淀物生成,故而都不易被吸附[6],本实验结果发现pH 值为5.0 时吸附效果较佳。
2.3 AB-8 大孔吸附树脂对芡实叶黄酮的动态解吸实验
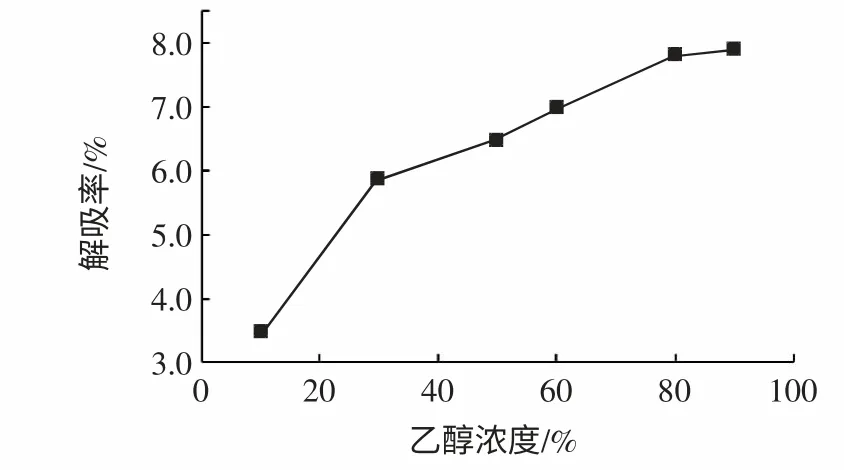
图4 乙醇浓度对AB-8 大孔吸附树脂解吸效果的影响Fig.4 The effect of different alcohol concentration on the desorption of resin
2.3.1 不同浓度乙醇对芡实叶黄酮的洗脱效果的影响
选择3 BV 乙醇溶液对吸附过芡实叶黄酮的树脂柱进行解吸处理,解吸流速为1BV/h,比较乙醇浓度为10%、30%、50%、60%、80%、90%时的解吸效果,解吸率如图4 所示:随着乙醇浓度的增高,芡实叶黄酮类物质的解吸率不断上升,这一规律与李凤林利用AB-8 大孔吸附树脂纯化甘薯叶黄酮实验结果一致[7],乙醇浓度达到80 %后解吸效果上升不明显,AB-8 大孔吸附树脂为弱极性的树脂,其吸附的黄酮类物质极性较小,故乙醇浓度越高即极性越小则洗脱效果越明显[8]。考虑到乙醇浓度增大到一定程度后,解吸率提高不明显,而大量杂质也会随之洗脱下来,这将使芡实叶黄酮纯度下降;综合考虑,解吸液乙醇体积分数选择80%。
2.3.2 不同洗脱体积对芡实叶黄酮的洗脱效果的影响
选择80%的乙醇溶液做为洗脱剂对吸附过芡实叶黄酮的树脂柱进行解吸处理,解吸流速为1 BV/h,比较洗脱体积为2、3、4、5 BV 时的解吸率,见图5。

图5 乙醇洗脱体积对AB-8 大孔吸附树脂解吸率的影响Fig.5 The effect of different alcohol elution volume on the desorption of resin
由图5 可知:在起始阶段,随着洗脱体积的增大,黄酮类物质的解吸率增加很快,当洗脱体积达3 BV后,解吸率随洗脱体积的增加无明显变化,说明已基本达到解吸平衡。洗脱剂最佳用量的确定,原则是在充分解吸所吸附的物质的前提下,尽量节省解吸剂的用量,因此选定3 BV 作为洗脱体积。
2.3.3 不同解吸流速对芡实叶黄酮的洗脱效果的影响
采用3 BV 的80%乙醇溶液对吸附过芡实叶黄酮的树脂柱进行解吸,比较解吸流速为0.5、1、1.5 BV/h时的解吸率,间隔10 mL 收集漏出液测定黄酮类物质浓度,结果如图6 所示。

图6 不同解吸流速对AB-8 大孔吸附树脂解吸效果的影响Fig.6 The effect of different desorption velocity on desorption performance
解吸流速为0.5 BV/h 时,峰形宽,峰值低,且拖尾现象很严重;解吸流速为1 BV/h 时,解吸较快而且峰值最高,其从峰形、峰值及拖尾现象来看,都与解吸流速为1.5 BV/h 相差不大。解吸流速过快时,解吸性能差,解吸带宽,且拖尾严重,解吸不完全,流速过慢,会延长生产周期。本实验显示解吸流速为1 BV/h 效果最佳。
2.4 芡实叶黄酮类物质纯度测定结果
按纯度测定方法,经计算在芡实叶黄酮提取液中,黄酮纯度为18%;通过AB-8 大孔吸附树脂最佳纯化工艺(上样流速2 BV/h,上样pH=5.0,以80 %浓度乙醇作为洗脱剂,洗脱体积3 BV,解吸流速1 BV/h)精制后黄酮纯度提高到76.5%,是原来的4.25 倍。
3 结论
通过比较AB-8、D101、HPD100、HZ801 4 种大孔吸附树脂的静态吸附性能发现AB-8 大孔吸附树脂对芡实叶黄酮具有良好的吸附性能,用以纯化芡实叶黄酮是可行的。
AB-8 大孔吸附树脂纯化芡实叶黄酮的最佳工艺条件为:上样流速2 BV/h,上样液pH5.0,以体积分数为80%乙醇进行解吸,洗脱体积3 BV,解吸流速1 BV/h时,纯度测定结果表明,经AB-8 树脂纯化后芡实叶黄酮纯度为76.5%。
本方法简单易行,成本低廉,安全可靠,提取的黄酮可作为药用或开发保健食品;利用大孔树脂具有稳定性高,吸附容量大,选择性好,吸附速度快,再生处理方便,使用周期长等优点,有利于工业化生产。
[1] 张然,贺芳,崔竹梅,等.芡实叶黄酮超声提取工艺优化[J].食品科学,2011,32(22):42-45
[2] S Martens,A Mithöfer A.Flavones and flavone synthases[J].Phytochemistry,2005,66:2399-2407
[3] CookN C,Samman S.Flavonoids-chemistry,metabolism,cardioprotective effects,and dietary sources[J].NutrBiochem,1996,7:66
[4] B Halliwell,JMC Gutteridge.Free Radicals in Biology and Medicine[M].New York:Oxford University Press Inc,1999:225-227
[5] 周桃英,罗登宏,李国庆, 等.AB-8 大孔树脂纯化荷叶总黄酮的工艺研究[J].中国食品添加剂,2009(5):113-119
[6] 杨培民,代龙,魏永利.大孔吸附树脂分离纯化白花蛇舌草总黄酮的研究[J].北京中医药大学学报,2010,33(6):417-424
[7] 李凤林,李青旺.大孔树脂纯化甘薯叶黄酮的工艺研究[J].中国食品添加剂,2009(4):103-108
[8] 黄月纯,黄樱华,刘翠玲,等.大孔吸附树脂纯化侧柏叶总黄酮的工艺研究[J].中药新药与临床药理,2010,21(1):75-80
