二茂铁催化光助非均相类Fenton氧化法处理含罗丹明B废水
2013-01-18田森林
存 洁,田森林,王 倩,曾 俊
(昆明理工大学环境科学与工程学院,云南 昆明 650500)
近年来,光助Fenton(Fe2+/UV/H2O2)氧化法已成为高级氧化(AOPs)中的研究重点,在处理高色度、难降解、具有生物毒性的染料废水方面得到广泛的研究[1-3].为了克服均相Fenton体系在处理实际废水时适用pH值范围狭窄,Fe2+流失造成二次污染等缺陷,许多学者用活性炭、沸石、膨润土等材料[4]或者铈、氧化铝[5]多种物质同时作为活性物质的载体合成非均相催化剂,但是负载量低,催化能力较差,且随着反应的进行,活性物质易溶解到溶液中.
二茂铁是一种具有芳香性夹心结构的新型金属π键型有机配合物[6],对紫外光有强烈的吸收作用[7],易氧化形成蓝色顺磁性二茂铁鎓离子(Fc+)[(η5-C5H5)2FeⅢ]+,Fc=Fc++e为可逆反应,标准电极约为0.628V[8].因其具有疏水性、稳定性、低毒性、生物活性等特性而被广泛应用[9].有学者将二茂铁嫁接到硅胶上,作为类Fenton反应的催化剂,在UVA的照射下降解酸性红B,并取得了良好的效果[10],但繁杂的固载程序会无形地增加废水处理的成本.二茂铁价廉易得,不溶于水,直接将颗粒二茂铁作为类Fenton试剂的催化剂还未见报道.为了考察其可行性,本研究用H2O2/Fc体系在UV的照射下对罗丹明B进行脱色处理,探索了该催化剂的催化性能和稳定性,以期开拓一条处理染料废水的新途径.
1 材料与方法
1.1 仪器和试剂
UV灯管(波长为254nm,6W);UV-2450型紫外可见分光光度计(日本岛津);AL204型电子天平(梅特勒-托利多仪器有限公司);501A型超级恒温器(上海实验仪器厂有限公司);78-1型磁力加热搅拌器(常州澳华仪器有限公司).
罗丹明B(AR,成都市科龙化工试剂厂);二茂铁(AR,上海晶纯试剂有限公司);H2O2(30%,云南杨林工业开发区汕滇药业有限公司);H2SO4(AR,重庆川东化工有限公司);NaOH(AR,天津市盛奥化学试剂有限公司).
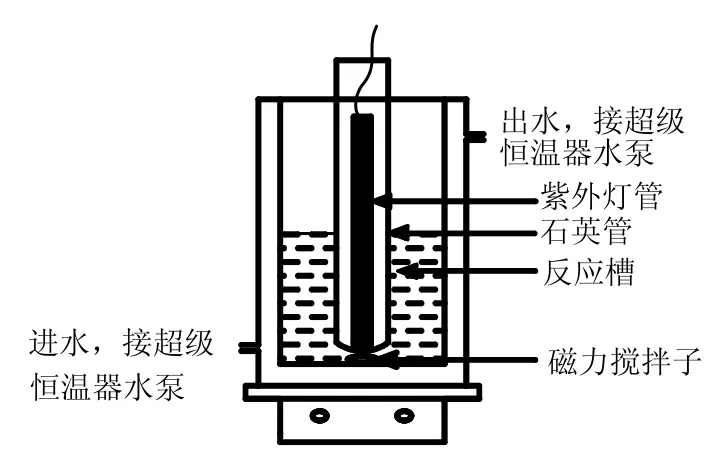
图1 光催化实验装置示意Fig.1 Scheme of photocatalytic reaction experimental apparatus
1.2 实验方法
非均相UV/H2O2/Fc体系的反应装置如图1所示.反应体系温度用超级恒温槽控制在(30±1)℃,配制500mL 7.2mg/L的罗丹明B作为模拟废水加入反应槽中,用H2SO4和NaOH调到所需pH值,加入一定量的二茂铁,开启磁力搅拌器,使其充分均匀混合,随后开启紫外灯,并迅速加入一定量的H2O2,以此作为反应的起始时间,间隔一定的时间用移液管移取反应液3mL,在罗丹明B的最大吸收波长554nm处测其吸光度(经实验证明,加入Fc对罗丹明B在554nm处的吸光度没有影响),并根据工作曲线换算成浓度,按式(1)计算其脱色率.
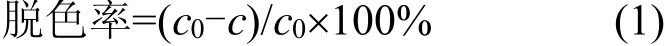
式中:c0为初始浓度,mg/L;c为剩余浓度,mg/L.
此外,COD值用重铬酸钾滴定法测定,用反应试剂与邻二氮菲反应后用光度法测定溶液中溶出的Fe2+.
2 结果与讨论
2.1 非均相UV/H2O2/Fc体系对罗丹明B的脱色性能
为考察非均相UV/H2O2/Fc体系对罗丹明B的脱色性能,比较了Fc、UV、UV/Fc、H2O2/Fc和UV/H2O2/Fc5种体系对模拟罗丹明B废水的脱色效果,实验条件为:H2O2浓度 3×10-2mol/L,Fc投加量0.27g/L,初始pH值为3,温度(30±1)℃,紫外光波长254nm,结果如图2所示.由图2可见,UV光照很难使罗丹明B褪色,说明单独的UV光照对罗丹明B的光解性能低;Fc处理罗丹明B时其脱色率也很低,说明单独的Fc对罗丹明B氧化性能和吸附量很少,几乎可以忽略;与TiO2光催化不同,UV/Fc体系对罗丹明B的脱色率在反应70min时只达到6%,说明Fc的光敏特性很小;而H2O2/Fc体系对罗丹明B的脱色率明显增加,在70min时罗丹明B的脱色率达到88.8%,证明Fc可作为光Fenton试剂的非均相催化剂降解水中罗丹明B;当增加了254nm的紫外光照时,与H2O2/Fc体系相比,对罗丹明B的脱色速率大大增加,且在70min时的脱色效率达到了97.55%,说明Fc作为光Fenton试剂的非均相催化剂是可行的.此外,UV/H2O2/Fc体系对COD的去除率在80min时达86%以上,比脱色速率慢,说明该体系降解罗丹明B时会产生难生物降解的中间产物.
实验条件为:H2O2浓度 3×10-2mol/L,初始 pH值为3,温度(30±1)℃,紫外光波长254nm,cFc=cFe2+=0.00145mol/L.从图3中可看出,传统的光Fenton体系在反应10min之内对罗丹明B的脱色率达97%以上,而UV/H2O2/Fc体系在50min左右也能对罗丹明B完全脱色,且能避免均相Fenton试剂Fe2+流失的弊端.
2.2 UV/H2O2/Fc非均相Fenton体系降解罗丹明B过程中的氧化作用机制

图2 不同氧化体系对罗丹明B脱色的比较及UV/H2O2/Fc体系对罗丹明COD的去除情况Fig.2 Comparisonofdecolorizationratesofvariousoxidation systems to rhodamine B(including removal COD rate of UV/H2O2/Fc system)


图3 UV/H2O2/Fc和UV/H2O2/Fe2+体系对罗丹明B脱色率的对比Fig.3 Comparison of rhodamine B decolorization rate of UV/H2O2/Fc and UV/H2O2/Fe2+systems
AOPs反应产物中包括各种自由基,为了研究UV/H2O2/Fc体系处理罗丹明B时起氧化作用的活性物质,选择在反应体系中分别加入不同的自由基清除剂,考察其对罗丹明B的脱色率的影响.异丙醇含α-氢,极易与·OH 反应,但是几乎不和·O2-反应[11],所以异丙醇可作为·OH的清除剂,叔丁醇可以作为各种中间活性物质包括·OH的清除剂[12].实验条件为:H2O2浓度3×10-2mol/L,Fc投加量0.27g/L,初始pH值为3,温度(30±1)℃,紫外光波长254nm,分别加入0.06mol/L(为H2O2浓度的2倍,确保捕捉大部分的活性物质)的异丙醇和叔丁醇,结果如图4所示.结果表明,在70min时,罗丹明B的脱色率分别达到59.38%和12.92%.由此说明在分解罗丹明B的过程中·OH的贡献率占了一半左右,而其他活性物质的贡献率也近一半,所以UV/H2O2/Fc体系处理罗丹明B时起作用的活性物质主要是·OH和其他活性物质.
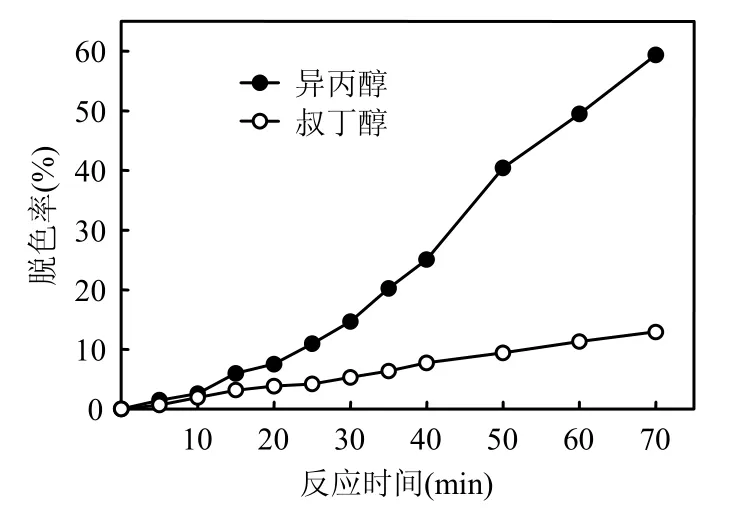
图4 不同的清除剂对罗丹明B脱色的影响Fig.4 Effect of type of scavengers on decolorization of rhodamine B
通常,罗丹明B降解途径为2个过程:N-位脱乙基作用和共轭氧杂蒽环结构的分解[13].图5显示了罗丹明B每隔5min的吸收光谱变化,反应条件为:H2O2的浓度为3×10-2mol/L,Fc的投加量是0.27g/L,初始pH值为3,温度为(30±1)℃,紫外光波长254nm.由图5可知,30min时罗丹明B在554nm处的吸收峰基本消失,随着反应的进行,其颜色由粉红逐渐褪去,对应着罗丹明B的共轭氧杂蒽环分解,吸收峰没有出现明显的蓝移,说明没有出现N-位脱乙基作用.证明UV/H2O2/Fc体系对罗丹明B的降解主要是通过共轭氧杂蒽结构的破坏而引起的.
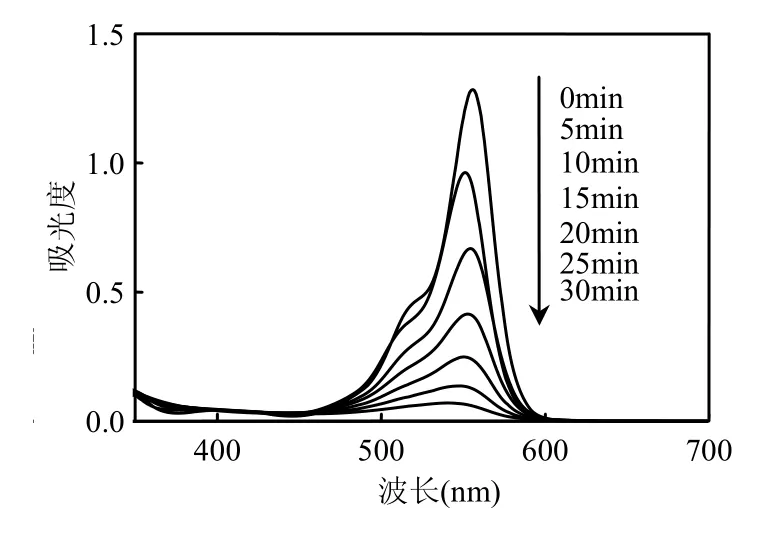
图5 罗丹明B紫外-可见吸收光谱随时间的变化Fig.5 Variation UV-Vis absorbance spectrums of rhodamine B with different reaction time
综上所述,UV/H2O2/Fc体系降解罗丹明B的机理如式(2)所示.

2.3 催化剂稳定性
在 H2O2浓度3×10-2mol/L,Fc的投加量0.27g/L,初始pH值为3,温度(30±1)℃,紫外光波长254nm条件下,研究了重复回收催化剂对罗丹明B脱色的影响,结果如图6所示.在每次循环之前将上一循环的Fc用去离子水冲洗,并置于烘箱70℃烘干.按照前面的步骤,加入等量的Fc、H2O2和回收的Fc进行下一个循环反应.经过循环使用3次Fc,模拟废水的脱色率都能达到99%以上,这说明Fc的催化活性稳定,能够避免传统的均相光助Fenton体系中Fe2+对水体造成二次污染.
在第1次反应过程中测定Fe2+溶出的浓度,实验证明在反应的前30min内没有Fe2+溶出,70min后只有9.31×10-5mg/L的Fe2+溶出.结果表明,UV/H2O2/Fc非均相体系处理罗丹明B过程中Fc性质稳定,在该反应过程中主要以整体的Fc形式参与反应.

图6 循环使用Fc对罗丹明B脱色的影响Fig.6 Effect of reuse of ferrocene on decolourization of rhodamine B
2.4 UV/Fc/H2O2非均相类Fenton反应体系中罗丹明B脱色的主要影响因素
2.4.1 催化剂颗粒大小的影响 图7对比了Fc颗粒大小对脱色率的影响,反应条件为:H2O2的浓度为3×10-2mol/L,Fc的投加量是0.27g/L,初始pH值为3,温度为(30±1)℃,紫外光波长254nm.结果表明,粉末状的Fc脱色速率比颗粒状的稍快,因为粉末状的Fc表面积比较大,可以更充分的与溶液接触反应.但是考虑到回收的催化剂的难易程度,建议使用颗粒状的Fc.

图7 二茂铁颗粒大小对脱色率的影响Fig.7 Effect of Fc particle size on decolourization of rhodamine B
2.4.2 H2O2浓度的影响 H2O2浓度对罗丹明B模拟废水脱色效果的影响如图8所示.实验条件为:Fc的投加量是0.27g/L,初始pH值为3,温度为(30±1)℃,紫外光波长254nm.结果表明,H2O2浓度从3.5×10-3mol/L升至3×10-2mol/L时,废水的脱色速率随着浓度的增加而增高,而投加浓度从1.5×10-2mol/L增加到3×10-2mol/L时,速率几乎不变,这是因为H2O2的浓度小于1.5×10-2mol/L时,随着 H2O2的增加,产生的·OH 增多,H2O2得到有效利用;当大于1.5×10-2mol/L时,H2O2会消耗一部分·OH[14]:
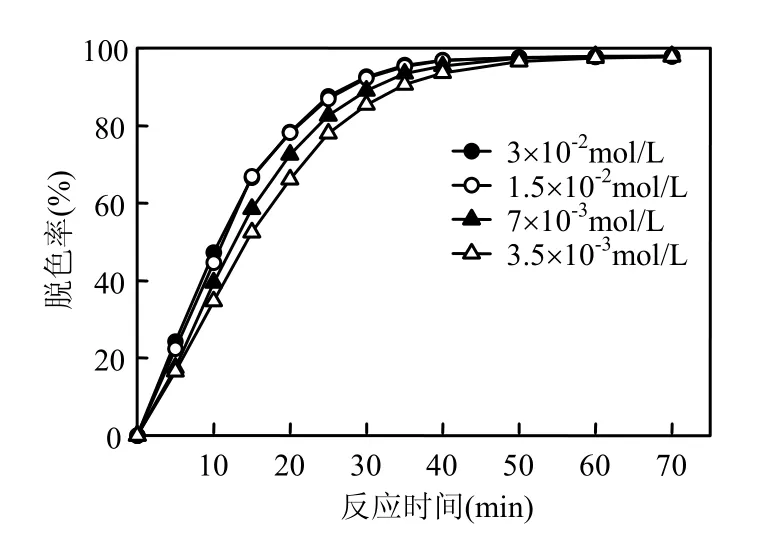
图8 H2O2浓度对罗丹明B脱色的影响Fig.8 Effect of H2O2concentration on decolourization of rhodamine B
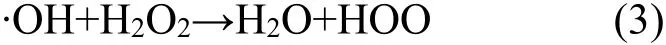
该过程使H2O2的利用率下降.所以H2O2的最佳浓度为1.5×10-2mol/L.
2.4.3 催化剂投加量的影响 Fc的投加量对罗丹明B脱色效果的影响如图10所示,实验条件为:H2O2的浓度为1.5×10-2mol/L,初始pH值为3,温度为(30±1)℃,波长为254nm,投加不同量的Fc.当Fc的投加量从到0.04~0.27g/L变化时,罗丹明B的脱色速率逐渐加快.但从0.13g/L到0.27g/L之间脱色速率几乎没有变化,这是因为催化剂过多而缺乏H2O2引起的.所以Fc的最佳投加量为0.13g/L.

图9 Fc投加量对罗丹明B脱色的影响Fig.9 Effect of Fc dosage on decolourization of rhodamine B
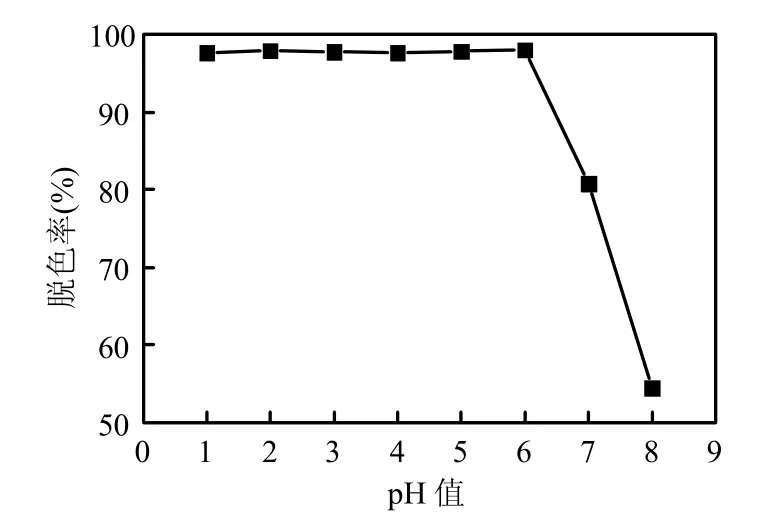
图10 初始pH值对罗丹明B脱色的影响Fig.10 Effect of initial pH on decolourization of Rhodamine B
2.4.4 初始pH值的影响 反应条件为:H2O2的浓度为1.5×10-2mol/L,Fc的投加量是0.13g/L,温度为(30±1)℃,波长为254nm的紫外灯照射.反应70min后不同初始pH值对罗丹明B脱色的影响如图10所示.在酸性条件下,模拟废水的脱色速率没有明显的区别,反应70min后脱色率都在97.65%以上,可能是因为Fc在酸性的条件下容易失去电子[15],加快了H2O2的分解.而当溶液的pH值在7和8时,去除效率有了明显的下降,在70min时脱色率分别达到了80.75%和54.41%,但此后该条件下仍保持一定的脱色速率,说明只要有足够的时间,就能达到理想的效果,克服了传统光助Fenton反应适用pH值范围窄的缺陷.
3 结论
3.1 反应70min后,Fc、UV、UV/Fc、H2O2/Fc、UV/H2O2/Fc体系对罗丹明B的脱色率分别为3.22%,5.428%,6.039%,88.827%,99.737%,非均相UV/H2O2/Fc的脱色效果明显优于其他体系,说明Fc作为光Fenton试剂的催化剂是可行的.
3.2 UV/H2O2/Fc体系在处理罗丹明B时起主要氧化作用的物质是·OH和某些其他的活性物质,且Fc经过3次回收利用后模拟废水的脱色率都能达到99%以上,证明Fc具有良好的稳定性.
3.3 UV/H2O2/Fc体系对罗丹明B的脱色效果受到各因素的影响,其中,H2O2的最佳浓度为1.5×10-2mol/L,Fc的最佳投加量为0.13g/L,效果最好的初始pH值为2~6之间.
[1]He F,Lei LC.Degradation kinetics and mechanisms of phenolin photo-Fenton process[J].JournalofZhejiang university-ScienceA,2004,5(2):198-205.
[2] 张 欣,吴昌永,石忠涛,等.CLT酸生产废水的Fenton氧化预处理试验研究 [J].中国环境科学,2012,32(4):630-634.
[3] 冯 勇,吴德礼,马鲁铭.黄铁矿催化类Fenton反应处理阳离子红X-GRL废水 [J].中国环境科学,2012,32(6):1011-1017.
[4]Soon AN,Hameed B H.Heterogeneous treatment of synthetic dyes in aqueous media using Fenton and photo-assisted Fenton process[J].Desalination,2011,269(1-3):1-16.
[5] 张亚平,韦朝海,吴超飞,等.光Fenton反应的Ce-Fe/Al2O3催化剂制备及性能表征 [J].中国环境科学,2006,26(3):320-323.
[6]Kealy T J,Panson P L.A new type of organo-iron compound[J].Nature,1951,168:1039.
[7]Wang T,Chen J W,Li Z Q,et al.Several ferrocenium salts as ef fi cient photoinitiators and thermal initiators for cationic epoxy polymerization [J].JournalofPhotochemistry and PhotobiologyA:Chemistry,2007,187(2/3):389-394.
[8]BaHerjee S M,Marzouk M I,Aazab M E,et al.The electrochemistry of some ferrocene derivatives:redox potential and substituent effects[J].Applied oranometallic Chemistry,2003,17(5):291-297.
[9]洪碧琼,陈 城.二茂铁衍生物的研究进展及其应用 [J].化学工程与装备,2007,(6):23-27.
[10]Nie Y L,Hu C,Qu J H,et al.Efficient photodegradation of Acid Red B by immobilized ferrocene in the presence of UVA and H2O2[J]. Journal of Hazardous Materials,2007,154(1-3):146-152.
[11]Hwang S,Huling S G,KO S.Fenton-like degradation of MTBE:Effects of iron counter anion and radical scavengers[J].Chemosphere,2010,78(5):563-568.
[12]Monteagudo J M,Duran A,San Martin I,et al.Roles of different active mineralization of phenolic UV-A/C photo-Fenton process [J].Applied Catalysis B:Environmental, 2011,106(1/2):242-249.
[13]Ai Z H,Lu L R,Li J P,et al.Fe@Fe2O3core-shell nanowire as iron reagent.1.Efficient degradation of rhodamine B by anovelsono-Fenton process[J].JournalofPhysical Chemistry C,2007,111(11):4087-4093.
[14]Xia M,Long M C,Yang Y D,et al.A highly active bimetallic oxides catalyst supported on Al-containing MCM-41 for Fenton oxidation of phenol solution[J].Applied catalysis B:Environmental 2011,110:118-125.
[15]Wilkinson G,Rosenblum M,Whiting M C,et al.The StructureofIron Bis-cyclopentadienyl[J].Journalofthe American Chemical Society,1955,(77):3009.
