SMAP-29抗菌肽的原核表达、纯化及活性检测
2013-01-16郑秋实段晨曦陶凤云
郑秋实 段晨曦 陶凤云
(北京联合大学生物化学工程学院,北京 100023)
由于耐药菌感染问题日益严重,开发新型抗菌药物迫在眉睫。抗菌肽SMAP-29是来源于绵羊骨髓的含29 个氨基酸残基的Cathelicidin 类抗菌肽[1],具有高效、广谱的抗细菌[2-5]、抗真菌活性[6],尤其对于一些耐药菌具有很强的杀灭活性[7],是一种较具开发应用潜力的抗感染肽。
直接从绵羊骨髓组织中提取并纯化天然抗菌肽产量有限,而化学合成抗菌肽成本高,因此通过基因工程表达重组抗菌肽成为主要的手段。Morassuttia等[8]以内含子介导的方式在大肠杆菌中融合表达了SMAP-29,结果显示重组肽较化学合成分子的抗菌活性弱。任耀军等[9]采用毕赤酵母偏好密码子,设计合成了SMAP-29基因序列,构建了真核表达载体,诱导表达后在酵母裂解液中检测到抗菌肽表达。肇晓光等[10]利用pTYB11表达载体,在大肠杆菌BL21(DE3)中表达了融合蛋白,几丁质亲和层析后获得可溶性SMAP-29衍生物。但是由于抗菌肽分子小、易被蛋白酶降解、表达产物对宿主有害,从而影响了基因的高水平表达。如何高效低成本地利用基因工程技术制备抗菌肽,成为其进一步开发和临床应用急需解决的问题。
pET表达系统表达效率高,应用广泛,目前尚无利用该系统表达SMAP-29的详细研究报道,本研究以pET-28a(+)质粒为基础,在大肠杆菌BL21(DE3)中以融合蛋白形式表达重组抗菌肽SMAP-29,旨在获得具有天然末端的有生物活性的重组抗菌肽,为其开发应用奠定物质基础。
1 材料与方法
1.1 材料
表达载体pET-28a(+)、大肠杆菌DH5α、BL21(DE3)、药敏测试大肠杆菌、金黄色葡萄球菌和白色念珠菌均由北京联合大学生物化学工程学院生物工程实验室保藏;PfuDNA 聚合酶、DNA 片段纯化试剂盒均购自北京赛百盛基因技术有限公司;T4 DNA 连接酶、限制性内切酶等购自宝生物工程(大连)有限公司;质粒提取试剂盒、琼脂糖胶回收试剂盒、异丙基硫代-β-D-半乳糖苷(IPTG)购自天根生化科技(北京)有限公司;LB 培养基购自美国BD公司;Ni-NTA Agarose购自Qiagen公司;重组肠激酶购自Novagen公司。
1.2 方法
1.2.1 基因优化与合成 为获得具有天然氨基端的抗菌肽,对N端添加了肠激酶切割位点(DDDK)的SMAP29的氨基酸序列肠激酶可在此识别序列K的羧基端裂解蛋白,用于完全去除SMAP-29天然氨基端之前的额外序列。反推其DNA序列,并根据大肠杆菌偏好的密码子进行基因序列优化,由生工生物工程(上海)有限公司人工合成基因序列并克隆在pUC57质粒的EcoR I和Hind III位点之间,命名为pUC57-smap29。
1.2.2 构建重组表达载体 以pUC57-smap29为模板,设计正向引物5'-CCCGAATTCGATGACGATGACAAACGC-3',反向引物5'-GGGCAAGCTTGTCATTAACCGGCAATACG-3',下划线依次为EcoR I和Hind III限制性内切酶位点,引物由北京赛百盛基因技术有限公司合成。利用PfuDNA聚合酶高保真扩增smap-29基因片段,PCR反应条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 50 s,共30个循环;72℃ 7 min,于4℃保存备用。获得的PCR产物回收后,将目标基因片段和表达载体pET-28a(+)同时分别用EcoR I和Hind III双酶切,胶回收目标基因片段和载体线性片段,将二者按摩尔比(5∶1)用T4 DNA连接酶16℃连接过夜,连接产物转化E. coliDH5α感受态细胞,挑取阳性菌落,筛选重组质粒pET28a-smap29,送北京三博远志生物技术有限责任公司测序。
1.2.3 表达与纯化重组蛋白 将测序正确的重组质粒 pET28a-smap29转化大肠杆菌BL21(DE3),挑取单菌落于含有卡那霉素(终浓度50 μg/mL)的LB培养基中,37℃、200 r/min摇床培养至对数生长期时(OD600=0.6),加入0.4 mmol/L IPTG诱导表达6 h。通过15% SDS-PAGE分析蛋白的表达情况。
对于成功表达出重组蛋白的BL21(DE3)按1%比例接种后扩大培养,IPTG诱导重组蛋白表达,4℃离心收集细胞并洗涤后,冰浴超声裂解细胞,高速离心后分别取上清和沉淀进行SDS-PAGE,检测重组蛋白表达形式。收集包涵体并用1% Triton X-100洗涤后,用8 mol/L尿素溶解,离心收集上清液,透析过夜后,进行Ni-NTA亲和层析,用60 mmol/L咪唑充分洗去杂蛋白后,用300 mmol/L咪唑洗脱目标融合蛋白。将融合蛋白透析后调整浓度至约100 μg/mL蛋白浓度,利用肠激酶37℃水浴12 h切除担体序列,将酶切产物上样进行Ni-NTA亲和层析,担体序列吸附到层析介质上,而目标肽不被吸附。收集穿柱液,用RP-HPLC进一步纯化制备目标肽。肽浓度和纯度经Tricine-SDS-PAGE 电泳进行分析。
1.2.4 重组肽的抗菌活性检测 将测试菌平板划线活化后,接种单菌落于LB液体培养基中,37℃摇床培养过夜;次日按照10%比例接种于新鲜的液体培养基中,37℃摇床培养至对数生长中期。离心收集测试菌,用pH7.4 的10 mmol/L PBS洗菌3次,稀释细菌至2×106CFU/mL,分别吸取每株细菌培养物10 μL至无菌EP 管中,将重组肽梯度稀释后,各取250 μL分别加入对应的已加入250 μL PBS无菌EP管中,再从各自管中取出250 μL加入到对应的已加入菌的EP管中,每组重复3个管。37℃条件下振荡培育8 h,将各管样品分别作不同倍数的稀释,每个稀释度分别取100 μL滴种在3个营养琼脂平板上,37℃温箱培育18 h,观察并记录每个营养琼脂平板上的菌落数量,取相同稀释度的3个营养琼脂平板菌落的平均值作为该稀释度样品的菌落数量。计算抗菌肽浓度与细菌存活率关系的曲线。细菌的存活率(%)=存活细菌数/阴性对照细菌数×100%。
2 结果
2.1 SMAP-29抗菌肽的序列分析
SMAP-29的氨基酸序列为:RGLRRLGRKIAHGVKKYGPTVLRIIRIAG,是由29个氨基酸组成的碱性α-螺旋抗菌肽(抗菌肽数据库http://aps.unmc.edu/登记号:AP00155),疏水残基占37%。ProtParam 软件的分析结果表明,其分子量为 3 256.0,理论pI值为12.31,含9个正电荷氨基酸(Lys+Arg),不含负电荷氨基酸,总平均亲水值(GRAVY)为-0.210,脂肪系数为121.03,不稳定系数为26.41,属于稳定型肽,其空间结构如图1所示。

图1 SMAP-29结构图
2.2 构建重组表达载体
选择pET-28a(+)和大肠杆菌BL21(DE3)系统融合表达重组蛋白,基因表达策略如图2所示。
以重组克隆载体pUC57-smap29为模板,PCR扩增出两端分别带有EcoR I和Hind III限制酶识别位点的目标基因片段(图3),大小约为120 bp,与预期值相符,表明目标基因片段扩增成功。

图2 smap-29基因表达构建策略
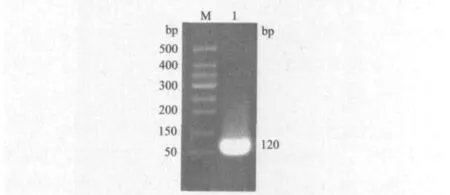
图3 smap-29基因的PCR扩增
对因片段smap29与pET-28a(+)连接,构成重组表达载体pET28a-smap29。重组质粒pET28asmap29经EcoR I和Hind III双酶切后产生两条带,图4中箭头所指处分别为酶切后的表达载体和目标基因片段。理论计算可知重组表达载体大小应为5 465 bp,双酶切大片段应为5 350 bp,目标基因片段应为115 bp,实际条带大小均与计算值相符,初步表明表达载体构建成功。进一步的DNA测序结果证明smap-29基因序列与设计序列一致,与pET-28a(+)表达载体连接后读码框正确。
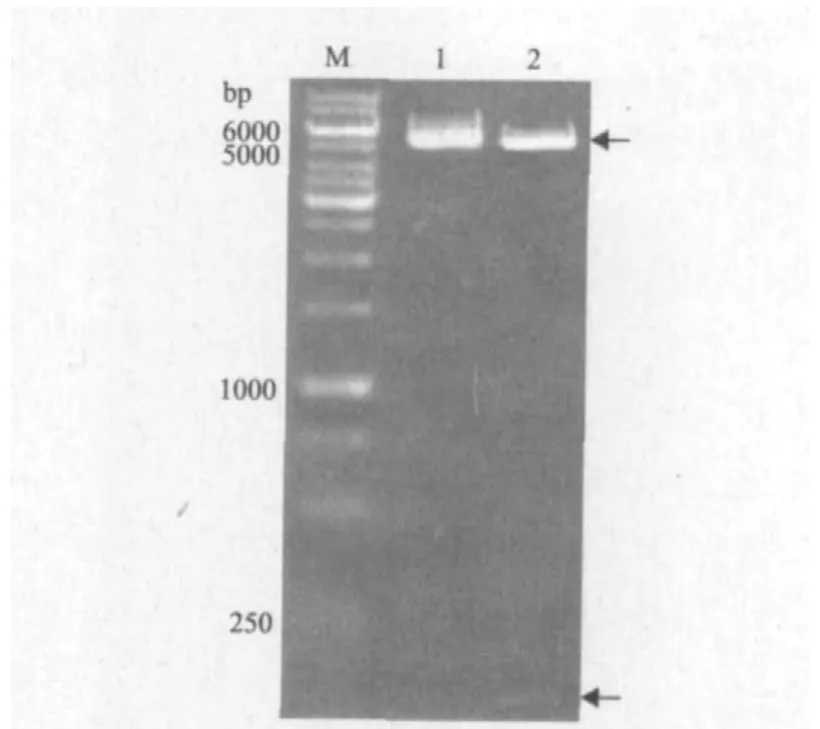
图4 重组表达质粒pET28a-smap29双酶切
2.3 融合蛋白的诱导表达
分别将pET28a-smap29和空白表达载体转化到大肠杆菌BL21(DE3)中,在含有50 μg/mL卡那霉素的LB培养基中37℃振荡培养到OD600=0.6,加入终浓度0.4 mmol/L的IPTG后降低培养温度至30℃诱导表达,分别取空载体和重组载体诱导6 h后的细胞,SDS-PAGE检测融合蛋白表达情况。如图5中箭头所指,诱导后的细胞总蛋白中新增一蛋白条带,其分子量低于8 kD,与预期融合蛋白的分子量相符,表明融合蛋白得到表达。
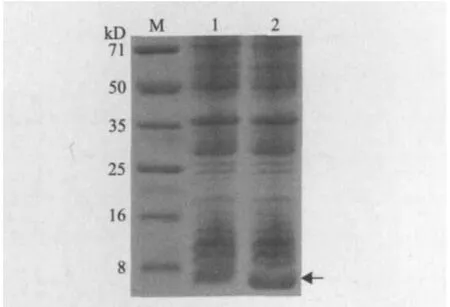
图5 SDS-PAGE 检测重组肽诱导表达
2.4 融合蛋白的纯化、肠激酶切割与纯化重组肽SMAP-29
按照2.3条件扩大培养含pET28a-smap29重组质粒的大肠杆菌BL21(DE3),诱导表达后,冰浴超声裂解细胞,高速离心后分别取上清和沉淀进行SDS-PAGE 检测,发现重组蛋白主要以包涵体形式存在于破碎沉淀中。提取的包涵体经过复性并透析后,进行Ni-NTA亲和层析,由于融合蛋白带有His-Tag标签,可吸附到层析介质上。经咪唑洗脱融合蛋白,结果(图6)显示,得到分子量约为8 kD的融合蛋白,经肠激酶裂解后,释放出分子量约4.4 kD和3 kD的两个肽段,与理论计算的担体蛋白和目标肽大小相符。在切除担体序列后,进一步进行RP-HPLC获得了SMAP-29重组肽。
2.5 SMAP-29重组肽抗菌性
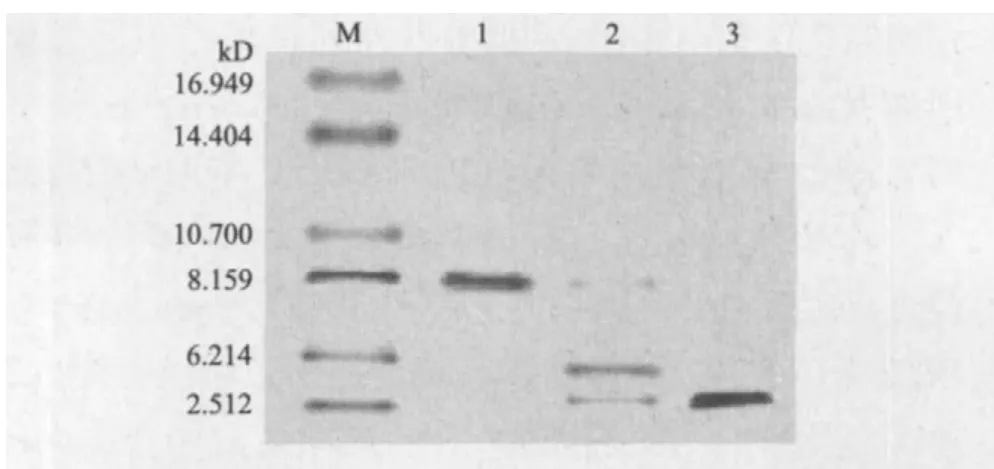
图6 Tricine-SDS-PAGE检测融合蛋白及其裂解产物
SMAP-29重组肽对测试菌均具有显著抗菌活性(图7),在肽浓度5 μmol/L时,3种菌的存活率均下降到50%以下。其中对大肠杆菌(E. coli)抑制作用最强,最小抑菌浓度MIC为10 μmol/L,对金黄色葡萄球菌(S. aureus)抑制作用其次,MIC为20 μmol/L,对白念珠菌(C. albicans)的MIC为40 μmol/L。
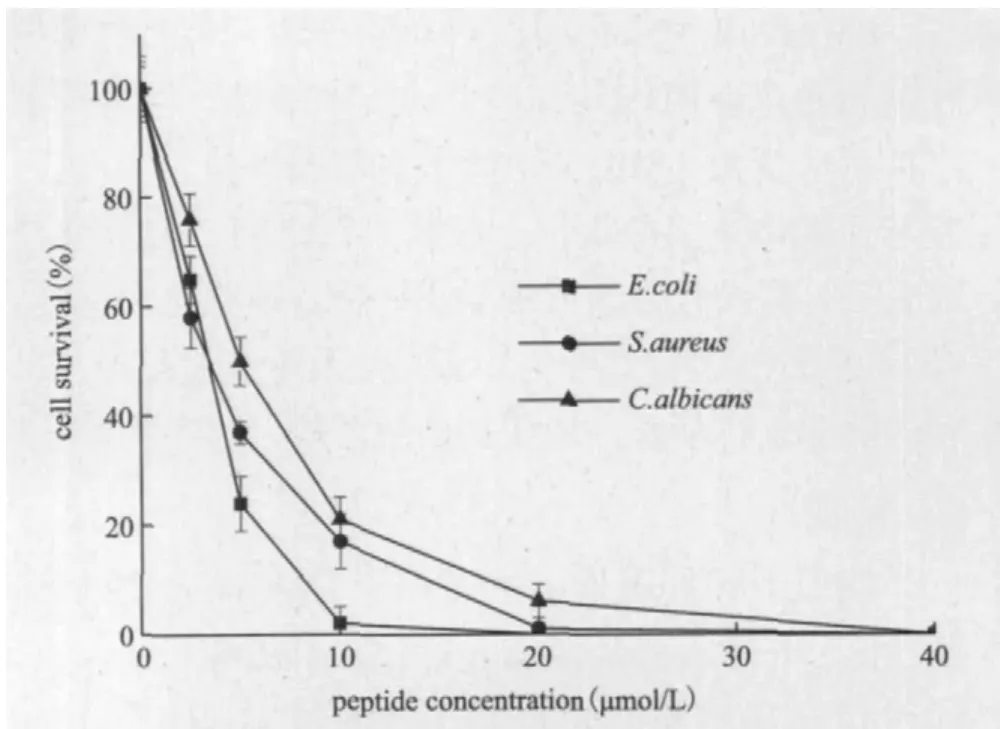
图7 重组SMAP-29在不同浓度下的抗菌性
3 讨论
SMAP-29具有广谱、高效的抗菌作用,是一种较具潜力的抗感染药物候选分子,今后有可能替代传统抗生素解决部分细菌耐药问题。目前关于SMAP-29抗菌功能及作用机制的研究大多采用合成肽[11,12],由于化学合成成本昂贵,不利于其进一步扩大应用,而对基因工程表达研究还很不充分,为此,我们对SMAP-29的基因工程表达制备进行了研究。
为了使外源基因能够在大肠杆菌中高效表达,避免由于表达序列中存在大肠杆菌稀有密码子而导致的翻译效率低下,根据大肠杆菌偏好的密码子对基因序列进行了优化。为了最终获得不带有载体序列残留的天然SMAP-29抗菌肽序列,我们在目标肽序列N端上游添加了肠激酶切割位点,在目标肽序列C端添加了连续两个终止密码子。选取pET-28a(+)作为表达载体,通过EcoR I和Hind III限制酶位点将目标肽序列连接到载体中,在Escherichia coliBL21(DE3)中以包涵体形式表达出重组融合蛋白,避免了对宿主菌的毒性。由于担体蛋白中含有His标签,将包涵体溶解后可以很方便地利用Ni-NTA亲和层析获得纯化的融合蛋白,经过肠激酶切割后释放出两端均无任何额外氨基酸引入的SMAP-29抗菌肽序列。许多基因工程制备的重组蛋白含有额外的氨基酸残留,有些情况下可能对于其功能影响不大,但是SMAP-29抗菌肽N端或C端额外氨基酸的引入,都会对其功能产生影响,因此本研究制备的SMAP-29重组抗菌肽为研究其功能提供了适宜的原材料。
SMAP-29重组抗菌肽对大肠杆菌、金黄色葡萄球菌和白念珠菌均具有显著的抗菌活性,但是其最小抑菌浓度值(MIC)均高于文献报道值[13]。这可能与文献中使用的化学合成肽C端进行了酰胺化修饰有关,酰胺化修饰可增加正电荷,增强杀菌活性。今后可通过在目标肽C-末端引入天冬酰胺,表达出相应的重组抗菌肽,增强其杀菌活性。
4 结论
按照大肠杆菌偏好的密码子合成smap-29抗菌肽基因,并在目的基因的N端添加肠激酶切割位点,同时在C端添加终止密码子,通过EcoR I和Hind III限制性内切酶位点将目的基因连接到pET-28a(+)表达载体中,在大肠杆菌BL21(DE3)中表达出带有6×His标签的融合蛋白,利用Ni-NTA亲和层析纯化融合蛋白后,经过肠激酶切割,获得具有抗菌活性的不带有额外氨基酸序列残留的天然SMAP-29抗菌肽序列。
[1] Mahoney MM, Lee AY, Brezinski-Caliguri DJ, et al. Molecular analysis of the sheep cathelin family reveals a novel antimicrobial peptide[J]. FEBS Lett, 1995, 377(3):519-522.
[2] Skerlavaj B, Benincasa M, Risso A, et al. SMAP-29:a potent antibacterial and antifungal peptide from sheep leukocytes [J].FEBS Lett, 1999, 463(1-2):58-62.
[3] Travis SM, Anderson NN, Forsyth WR, et al. Bactericidal activity of mammalian cathelicidin-derived peptides [J]. Infect Immun, 2000,68(5):2748-2755.
[4] Weistroffer PL, Joly S, et al. SMAP29 congeners demonstrate activity against oral bacteria and reduced toxicity against oral keratinocytes[J]. Oral Microbiol Immunol, 2008, 23(2):89-95.
[5] Arzese A, Skerlavaj B, Tomasinsig L, et al. Antimicrobial activity of SMAP-29 against theBacteroides fragilisgroup and clostridia [J].J Antimicrob Chemother, 2003, 52(3):375-381.
[6] Benincasa M, Scocchi M, Pacor S, et al. Fungicidal activity of five cathelicidin peptides against clinically isolated yeasts [J]. J Antimicrob Chemother, 2006, 58(5):950-959.
[7] Saiman L, Tabibi S, et al. Cathelicidin peptides inhibit multiply antibiotic-resistant pathogens from patients with cystic fibrosis [J].Antimicrob Agents Chemother, 2001, 45(10):2838-2844.
[8] Morassutti C, De Amicis F, Bandiera A, et al. Expression of SMAP-29 cathelicidin-like peptide in bacterial cells by intein-mediated system[J]. Protein Expr Purif, 2005, 39(2):160-168.
[9] 任耀军, 薄新文, 王新华.抗菌肽SMAP-29在毕赤酵母中的表达[J].石河子大学学报:自然科学版, 2008(6):695-699.
[10] 肇晓光, 马洪星, 张宇雯, 等.抗菌肽SMAP-29衍生物的原核表达及纯化[J].哈尔滨医科大学学报, 2008(6):563-567.
[11] Dawson RM, Liu CQ. Analogues of peptide SMAP-29 with comparable antimicrobial potency and reduced cytotoxicity [J].Int J Antimicrob Agents, 2011, 37(5):432-437.
[12] Neville F, Ivankin A, Konovalov O, et al. A comparative study on the interactions of SMAP-29 with lipid monolayers [J]. Biochim Biophys Acta, 2009, 1798(5):851-860.
[13] Shin SY, Park EJ, Yang ST, et al. Structure-activity analysis of SMAP-29, a sheep leukocytes-derived antimicrobial peptide [J].Biochem Biophys Res Commun, 2001, 285(4):1046-1051.
