马铃薯卷叶病毒P0蛋白抑制RNA沉默及其与AGO蛋白的相互作用
2013-01-16霍晓辉申永梅刘国富曹雪松
霍晓辉 申永梅 刘国富 曹雪松
(聊城大学 生命科学学院,聊城 252059)
RNA沉默是一种由同源序列引起的特异RNA降解过程。RNA干扰(RNA interference,RNAi)是近来发现的一种重要的基因沉默现象,通常由双链RNA介导。1990年Napoli首次提出植物中的RNA沉默也称为转录后基因沉默(post-transcriptional gene silencing,PTGS)[1]。高等植物对于病毒侵染有保护自身的防御机制,当病毒侵染植物时,由病毒RNA和mRNA介导的转基因会引起植物对病毒的抗性,称为病毒介导的基因沉默(virus induced gene silencing,VIGS)。它是转录后基因沉默(posttranscriptional gene silencing,PTGS)一种特殊形式。但是,为利于病毒侵染,植物病毒也同时编码一种蛋白用来对抗RNAi,这类蛋白可以用于抑制RNA沉默的各个步骤,称为 RNAi 抑制因子[2]。据报道已鉴定了50余种病毒编码的RSS,例如马铃薯Y病毒属(Potyvirus)中的蚜传辅助性蛋白酶(help component-proteinase,HC-Pro)[3],黄瓜花叶病毒(Cucumber mosaic virus,CMV)编码的2b,马铃薯X 病毒(Potato virus X,PXV)编码的p25、马铃薯卷叶病毒(Potato leafroll virus,PLRV)属编码的P0以及甘蔗黄叶病毒编码(Sugarcane yellow leaf virus,SCYLV)的 P0 等[4]。
基因沉默抑制因子干扰基因沉默的机制有多种形式:抑制siRNA的积累;抑制因子与siRNA的结合,使之不能与蛋白核酸复合体结合形成RISC(RNA诱导的沉默复合物);抑制双链RNA的形成;抑制因子与基因沉默核酸蛋白复合体相结合,阻止转录后基因沉默的发生。AGO蛋白是RNA沉默途径中一个关键蛋白,AGO蛋白可以与小RNA的引导链及其他蛋白质组装形成的RNA诱导的沉默复合体(RISC)。病毒编码的RSS与AGO相互作用的研究表明,AGO作为RNA沉默路径当中的关键蛋白可能会成为很多病毒RSS作用的靶位点,AGO蛋白正确组装成RISC需要多种dsRNA结合蛋白的协助,因此推测许多RSS利用其含有的“AGO 钩”(GW/WG重复,甚至只含有单个GW或WG)与AGO的竞争性结合来抑制RNA沉默。最新研究发现,抑制因子中含有的重复甘氨酸、色氨酸(GW/WG motif)是与AGO相互作用的关键氨基酸,基因序列中GW/WG重复二次至多次可以作为“AGO钩”(Ago hook)与AGO蛋白结合并在基因沉默中发挥作用[5,6]。例如芜箐邹缩病毒(TCV)外壳蛋白P38中的二个GW重复是与AGO相互作用的关键氨基酸,而且P38与AGO互作的同时会影响DCL的表达[7]。
马铃薯卷叶病毒属于黄症病毒科家族的马铃薯卷叶病毒属中的黄化病毒组(Luteovirus),1916年被发现,是发现最早的马铃薯病毒,由多种蚜虫以持久性方式传播,而不能由机械传播,PLRV的分布主要局限于在寄主植株韧皮部维管束内,主要侵染茄科(如马铃薯、番茄等)植物。据报道,在我国北方地区造成的马铃薯产量的损失约为30%-40%,严重时候可达到80%-90%。PLRV基因组结构为等轴对称,直径约24 nm。PLRV的RNA的碱基组成大体上为28%A、23%U、25%C与24%G。PLRV的基因组含有8个ORFs,其中有部分ORF重叠,在通过选择性的识别起始密码后再经过移码、通读终止密码子及利用亚基因组等各种策略分别翻译各 ORF[8](图 1)。P0是由 PLRV的 ORF1所编码,它是病毒侵染植株后引起病症的决定性因子,并且是一种RSS。

图1 马铃薯卷叶病毒基因组结构
目前已鉴定的马铃薯卷叶病毒属中的RSS只有马铃薯卷叶病毒(PLRV)、甜菜西方黄化病毒(BWYV)、南瓜蚜传黄化病毒(CABYV)和甜瓜蚜传黄化病毒(MABYV)编码的P0蛋白,但对其机制都还不清楚,而我们试图通过农杆菌瞬时表达渗透注射转GFP基因的16c烟草叶片研究PLRV-P0是否能抑制RNA沉默。通过序列分析发现P0基因序列中含有两个重复的WG基序,我们首先将P0基因序列中第87位和第140位的色氨酸(W)点突变为丙氨酸(A)(命名为P0WA),然后分别将P0和P0WA基因克隆到改造后的双分子荧光互补载体pCAMBIA1300-CE上, 将 PLRV-P0,PLRV-P0WA分别和AGO共同进行农杆菌渗透注射野生型(N.ben)烟草叶片,并在荧光显微镜下观察PLRV-P0和AGO及PLRV-P0WA和AGO共同注射后是否有绿色荧光的出现,从而确定PLRV-P0到底能否和AGO蛋白发生相互作用及其关键氨基酸。
1 材料与方法
1.1 材料
1.1.1 植物材料 本氏烟草(Nicotiana benthamiana)以及转GFP基因的(16c)烟草种子由David Baulcombe教授惠赠。
1.1.2 菌种、质粒 大肠杆菌DH5α,农杆菌GV3101,pWEIMING101载体均由本实验室保存,双分子荧光互补载体pCAMBIA1300-CE以及重组质粒 ASK-NE,ASK-CE,AGO-NE,pGR107P0WA均由本实验其他研究人员构建。
1.1.3 酶和试剂 限制性内切酶(XhoI,ClaI,SalI,KpnI)和T4 DNA连接酶购自Promega公司;TaqDNA聚合酶及其缓冲液,dNTP购自TakaRa公司;胶回收试剂盒,质粒快速提取试剂盒购自北京康润诚业生物科技有限公司;DNA分子量标准购自Fermentas公司,其他生化试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中报道的PLRV-P0的基因序列,设计合成含有相关酶切位点的上下游引物并由上海生工生物工程公司合成。
1.2.2 目的基因的PCR扩增
1.2.2.1 P0基因的PCR扩增 以pER8的cDNA为模 板,PLRV-P0 5':GTTAGTCGACATGATTGTATTGACCCAGTCTG(下划线为SalI酶切位点);PLRVP0 3':ACAGGGTACCTCATTCTTGTAATTCCTTTTGG(下划线为KpnI酶切位点),1300-CE-P0 5':GTTAATCGATATGATTGTATTGACCCAGTC( 下 划 线 为ClaI酶切位点);1300-CE-P0 3':CACACTCGAGTTCTTGTAATTCCTTTTGGA(下划线为XhoI酶切位点)为引物进行PCR扩增。PCR反应体系为:pER8的cDNA 模板 1 µL,10 × PCR Buffer 5 µL(含 Mg2+),2.5 mmol/L 的dNTP 4 µL,10 μmol/L上下游引物各1 µL,TaqDNA聚合酶 1 µL,Pfu 0.5 µL,加去离子水至总体积为50 µL。PCR反应程序:94℃预变性5 min;94℃变性 30 s,55℃退火 30 s,72℃延伸 45 s,共30个循环;72℃延伸5 min。然后用1%的琼脂糖凝胶电泳检测 PCR 扩增产物,胶回收试剂盒切胶回收PCR产物并琼脂糖凝胶电泳检测。
1.2.2.2 P0WA基因的PCR扩增 PLRV-P0的第87-140位氨基酸的原序列如下(方框内为两个WG基序 ):WGLLCGTHPAIQIVGLTIVIKLDDPTTAAAYRSELLRVSSSSYIQNAAGLSNGWG 。
以重组质粒pGR107P0WA为模板PCR扩增,将PLRV-P0的第87、140位的色氨酸(W)点突变丙氨酸(A),突变之后的序列如下(方框内为两个WG基 序 突 变 后 ):AGLLCGTHPAIQIVGLTIVIKLDDPTTAAAYRSELLRVSSSSYIQNAAGLSNGAG 。
以pGR107-P0WA质粒为模板,1300-CE-P0W-A 5':GTTAATCGATATGATTGTATTGACCCAGTC( 下划线为ClaI酶切位点);1300-CE-P0WA 3':CACACTCGAGTTCTTGTAATTCCTTTTGGA(下划线为XhoI酶切位点)为引物进行PCR扩增。PCR反应体系为:pGR107-P0WA质粒DNA模板1 µL,10×PCR Buffer 5 µL(含Mg2+),2.5 mmol/L的dNTP 4 µL,10 μmol/L上下游引物各 1 µL,TaqDNA聚合酶 1 µL,Pfu 0.5µL,加去离子水至总体积为50 µL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,共30个循环;72℃延伸5 min。然后用1%的琼脂糖凝胶电泳检测 PCR 扩增产物,胶回收试剂盒切胶回收PCR产物并用1%的琼脂糖凝胶电泳检测。
1.2.3 植物表达载体的构建 将纯化后的P0基因片段与质粒pWM101分别用限制性内切酶SalI和KpnI进行双酶切;然后用限制性内切酶ClaI和XhoI对P0,P0WA基因进行双酶切;最后用限制性内切酶ClaI,SalI对质粒载体pCAMBIA1300-CE进行酶切。酶切后产物用胶回收试剂盒进行回收,1%琼脂糖凝胶电泳检测回收产物,根据外源片段和载体DNA条带亮度以等摩尔比例用T4 DNA连接酶16℃过夜连接,连接产物转化大肠杆菌DH5α感受态细胞,涂布于含卡那霉素(Kan)的LB培养基平板上,37℃倒置培养12-16 h,挑取单菌落37℃恒温振荡培养12-16 h,以菌落为模板进行PCR扩增,根据菌落PCR结果对号提取重组质粒,然后进行质粒PCR和双酶切鉴定,取1 mL菌液送交测序公司进行测序,测序结果与所设计的目的基因序列进行比对。
1.2.4 农杆菌的转化 取5 µL重组质粒加入到100µL农杆菌GV3101感受态细胞中,用移液枪迅速吹打混匀后置于冰上3-5 min,然后把混合物贴着电击杯壁缓慢加入,预激(参数:电压2.2 kV,电容25µF,阻抗200 Ω)电激仪,再将电激杯至于电激仪中进行电激脉冲放电,电激结束后吸出电激混合液到微量离心管中,加入600 µL的LB液体培养基(含50 mg/L Kan,50 mg/L Rif,5 mg/L Tet),28℃条件下静置3 h,室温5 000 r/min离心5 min,取100 µL菌液涂布于LB固体培养基(含50 mg/L Kan,50 mg/L Rif,5 mg/L Tet)平板上,28℃倒置培养30-40 h,并对长出的菌落进行菌落PCR鉴定。
1.2.5 烟草的侵染 挑选5-6叶期的野生型烟草和转GFP基因的16c烟草幼苗用于农杆菌的侵染。从LB(含 50 mg/L Kan,50 mg/L Rif,5 mg/L Tet)固体培养基上挑取重组单菌落,接种到5 mL的LB(50 mg/L Kan,50 mg/L Rif,5 mg/L Tet)液体培养基中,28℃,180 r/min恒温振荡培养24-28 h。按1∶100的比例把菌液转接到20 mL的LB(50 mg/L Kan,50 mg/L Rif,5 mg/L Tet)液体培养基中,同时在培养基中加入终浓度为100 mmol/L的乙磺酸(MES)和终浓度为20 μmol/L的乙酰丁香酮(Acetosyringone,AS),于28℃,180 r/min振荡培养16-18 h,然后于4℃5 000 r/min离心5 min,弃上清,收集菌体。用农杆菌渗透缓冲液(含MES、AS、MgCl2,终浓度分别为100 mmol/L,20 μmol/L的和100 mmol/L)悬浮沉淀,稀释至OD600nm值为1.0,室温下静置悬浮3 h,用已消毒的一次性注射器将农杆菌渗透液注射到烟草叶片叶脉的两侧,注射完毕后,将烟草置于28℃恒温培养室中光照16 h,黑暗8 h培养。
1.2.6 烟草叶片的观察 将烟草叶片放于暗室中用紫外灯照射观察基因沉默现象并用相机拍照记录。选取渗透注射过的烟草叶片,用剪刀沿叶脉剪下叶片。制作玻片标本:用洁净的纱布把载玻片、盖玻片擦拭干净;在载玻片的中央滴一滴清水;用镊子夹取叶片浸入玻片中央的水滴中;展平叶片;用镊子夹取盖玻片,使它的一边先接触载玻片上的水滴,然后轻轻盖在叶片上。奥林巴斯BX51荧光显微镜观察烟草叶片并拍照记录。
2 结果
2.1 目的基因的PCR扩增
以pER8的cDNA为模板,PCR扩增PLRV-P0目的基因;以重组质粒pGR107P0WA为模板,PCR扩增PLRV-P0WA目的基因,1%琼脂糖凝胶电泳结果(图2)显示,成功扩增出约为700 bp的片段,与预期结果大小一致。
2.2 植物表达载体的构建

图2 P0(P0WA)基因的PCR扩增
将质粒载体pWEIMING101(SalI,KpnI),pCAMBIA 1300-CE(ClaI,SalI)和目的基因片段P0(SalI,KpnI;ClaI,XhoI),P0WA(ClaI,XhoI)进行双酶切,然后用T4 DNA连接酶将载体和目的基因片段连接,转化大肠杆菌DH5α得到重组质粒。经菌落PCR扩增检测呈阳性的克隆分别提取质粒进行了质粒PCR,并对重组质粒pWEIMING101-P0(SalI,KpnI),pCAMBIA1300-CE-P0(P0WA)(ClaI,Sa lI)进行双酶切鉴定,1%琼脂糖凝胶电泳检测图谱中呈现700 bp的目的基因条带,与预期结果一致(图3,图4),测序结果表明插入片段长度为700 bp,与载体的连接方向正确,植物表达载体符合要求(图5,图 6)。
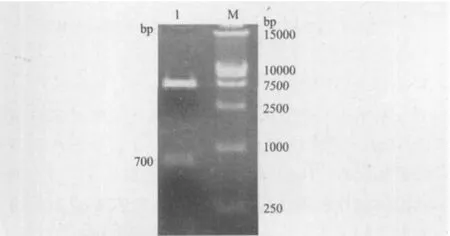
图3 重组质粒pWEIMING101-P0双酶切鉴定

图4 重组质粒pCAMBIA1300-CE-P0(P0WA)双酶切鉴定

图5 pWEIMING101-P0植物表达载体的构建
2.3 PLRV-P0抑制RNA基因沉默
将重组质粒pWEIMING101-P0电击转化农杆菌GV3101,同时与GFP等体积混合共同渗透注射转GFP基因的(16c)烟草叶片。单独渗透注射含GFP基因的农杆菌菌液作为阴性对照,等体积混合渗透注射含GFP和T2b基因的农杆菌菌液作为阳性对照,暗室中紫外灯下观察发现在渗透注射后的第6天等体积混合GFP和PLRV-P0的农杆菌菌液共同注射的烟草叶片中有很强的绿色荧光出现,而单独渗透注射GFP的叶片中则没有绿色荧光的出现(图7)。研究表明PLRV-P0确实能抑制GFP mRNA引起的基因沉默。
为了保证试验的可靠性,每个试验组合渗透注射50片烟草叶片,并重复至少3次,共150片叶片,第6天在紫外灯下观察并进行数据统计分析,如表1。经分析表明PLRV-P0能抑制GFP mRNA引起的基因沉默。
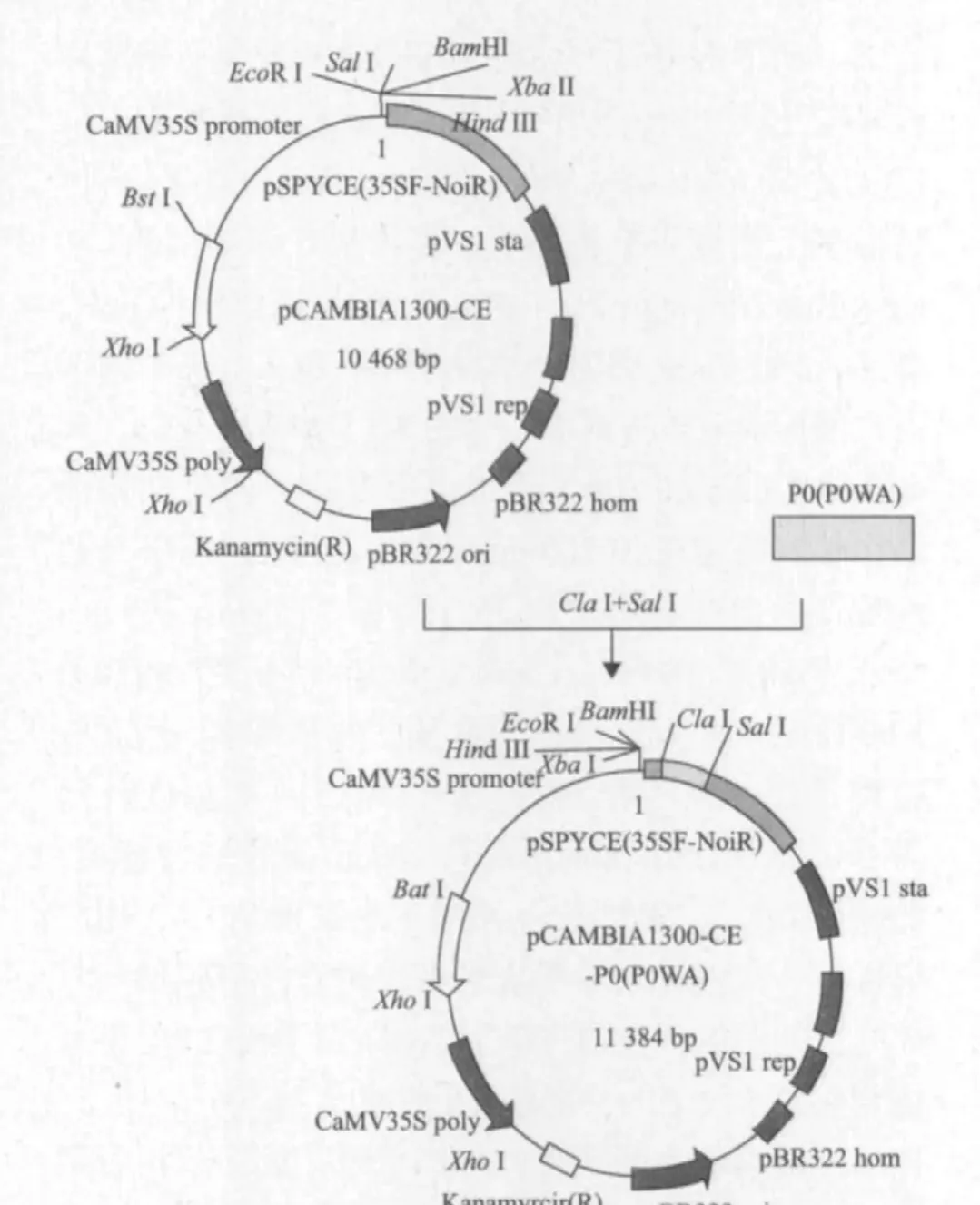
图6 pCAMBIA1300-CE-P0(P0WA)植物表达载体的构建

图7 PLRV-P0抑制RNA基因沉默的鉴定
2.4 PLRV-P0和AGO相互作用荧光观察
利用农杆菌渗透注射技术把制备好的渗透注射液 分 别 以 ASK-NE+ASK-CE,P0-CE+AGO-NE,P0WACE+AGO-NE,P0-NE+AGO-CE,1300-CE+AGO-NE,1300-CE+1300-NE渗透注射液组合注射本氏(Nicoti-ana benthamiana)烟草叶片。注射完毕以后,将烟草置于28℃的培养室中进行培养。逐日获取注射叶片在奥林巴斯BX51荧光显微镜下观察。前期试验过程中发现ASK-NE+ASK-CE渗透注射烟草的第2、3天能够发出很强的荧光,因此这里用它作为阳性对照,为了排除了YFP的N末端和C末端单独作用,设置了1300-CE+1300-NE为阴性对照。在渗透注射后的第24、36、48、60、72及96 h分别取材进行荧光显微镜观察,通过观察发现,在36 h时开始出现荧光,在48 h已经有大量荧光的表达,60 h仍然有荧光存在,但明显不如48 h时亮,72 h时只有少量荧光表达(图8)。每组试验渗透注射10片叶片,重复至少3次,数据统计结果如表2所示,统计结果表明P0能够与AGO1发生相互作用,产生荧光。在第48 h时对所观察到的荧光用奥林巴斯BX51系统照相,ASK-NE+ASK-CE有大量的绿色荧光,说明试验基本操作正确;P0-CE+AGO-NE有绿色荧光的出现,说明P0能够和AGO蛋白发生相互作用;P0-CE+1300-NE、1300-CE+AGO-NE、1300-CE+1300-NE均没有绿色荧光的出现,分别排除了P0和NE,AGO和CE,CE和NE相互作用的可能性。这些结果表明,PLRV-P0确实能够和AGO蛋白发生相互作用。

表1 PLRV-P0抑制RNA沉默数据统计

图8 PLRV-P0和AGO相互作用的荧光观察
3 讨论
目前已鉴定的马铃薯卷叶病毒属中的RSS只有马铃薯卷叶病毒,甜菜西方黄化病毒,南瓜蚜传黄化病毒和甜瓜蚜传黄化病毒(MABYV)编码的P0蛋白,但对其机制都还不清楚,而我们通过研究验证了PLRV-P0确实能抑制RNA沉默。这对PLRVP0的抑制机制的研究有着重要的意义。
新近研究发现,一些抑制因子中含有的重复甘氨酸、色氨酸(GW/WG motif)是与AGO相互作用的关键氨基酸,序列中GW/WG重复二次至多次可以作为“AGO钩”(Ago hook)与AGO蛋白结合并在基因沉默中发挥作用,这类抑制因子广泛存在于酵母、植物和动物的细胞中[6]。例如,新近的研究发现芜箐邹缩病毒(TCV)外壳蛋白P38中的二个GW重复是与AGO相互作用的关键氨基酸,P38与AGO的相互作用同时影响DCL的表达[7]。我们通过序列分析首先发现,P0基因序列中含有两个重复的WG基序,而WG基序可以作为AGO钩和AGO蛋白结合,所以P0可能是通过与AGO结合抑制RNA沉默,荧光互作试验结果证明,P0蛋白确实能够和AGO蛋白发生相互作用,PLRV-P0的两个重复的WG基序是其与AGO蛋白发生相互作用的关键氨基酸。

表2 渗透注射的烟草叶片出现荧光的时间
已有研究报道,有些病毒可以通过与AGO蛋白结合,并进一步作用于其下游的F-box泛素降解途径,从而抑制RNA沉默。在PLRV-P0的研究中,我们已经证明了P0确实能和AGO蛋白结合,但究竟其是不是通过进一步作用于F-box泛素降解途径还有待于进一步验证。另外,我们试图通过Pull down和Western blot分子验证,证明PLRV-P0确实和AGO蛋白相互作用,并通过其结合抑制RNA沉默。但是,PLRV-P0蛋白和AGO相互作用观察过程中,荧光显微镜下观察到的荧光很少,提取的总蛋白中互作的蛋白也很少,因此Pull down 和Western blot检测过程中还没有得到预期结果,可能正是因为PLRV-P0和AGO结合后,作用于F-box泛素降解途径引起了AGO的降解,所以才导致这种情况的出现。
4 结论
马铃薯卷叶病毒运动蛋白的P0蛋白是一个RNA沉默抑制因子,它可以抑制由GFP的mRNA引起的基因沉默;P0蛋白抑制GFP mRNA基因沉默的机制是通过与AGO蛋白的相互作用,其关键氨基酸是P0蛋白的WG基序。
[1] Napoli C, Lemieux C, Jorgensen R. Introduction of a chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans[J]. Plant Cell, 1990, 2:279-289.
[2] Voinnet O, Pinto VM, Baulcombe DC. Suppression of gene silencing[J]. Proc Natl Acad Sci USA, 1999, 96:14147-14152.
[3] Pruss G, Ge X, Shi XM, et al. Plant viral synergism:the potyviral genome encodes a broad-range pathogenicity enhancer that transactivates replication of heterologous viruses[J].Plant Cell, 1997, 9:859 -868.
[4] Mangwende T, Mirkow E, Albert HH. The P0 protein of sugarcane yellow leaf virus is a suppressor of posttranscriptional gene silencing[C]//Plant & Animal Genomes 13th Conference, San Diego:Town& Country Convention Center CA, 2005, 1:15-19.
[5] Tomari Y, Matranga C, Haley B, et al. A protein sensor for siRNA asymmetry[J].Science, 2004, 306:1377-1380.
[6] Karlowski WM, Zielezinski A, Carrere J. Genome-wide computational identification of WG/GW Argonaute-binding proteins inArabidopsis[J].Nucleic Acids Research, 2010, 38(13):4231-4245.
[7] Han YH, Xiang HY, Wang Q, et al. Ring structure amino acids affect the suppressor activity of melon aphid-borne yellows virus P0 protein[J]. Virology, 2010, 406(1):21-27.
[8] Jin HL, Zhu JK. A viral suppressor protein inhibits host RNA silencing by hooking up with Argonautes[J]. Genes & Development,2010, 24:853-856.
