壳聚糖及丁二酸酐酰化壳聚糖双氧水降解行为的研究
2013-01-14代元坤贺继东
代元坤,贺继东,安 康,肖 娴,刘 朋,况 波
(青岛科技大学 橡塑材料与工程教育部重点实验室山东省橡塑材料与工程重点实验室,山东 青岛266042)
壳聚糖(Chitosan,CS)是一种天然高分子碱性多糖,由甲壳素部分脱乙酰制得,分子量从几十万到几百万不等。由于具有优良的物理化学性能及生物相容性能,广泛应用于食物、农业、制药及化妆品等领域[1]。
壳聚糖溶解性差,只溶于稀的盐酸、硝酸等无机酸和大多数有机酸,不溶于水和碱性溶液,化学性质不活泼,使得其应用受到很大的限制。经过降解后的低聚壳聚糖分子量(Mw=1000~10 000)较小,不仅保持了高聚壳聚糖所具有的功能,如降低胆固醇、降血压、降血脂、防治糖尿病、强化肝脏机能、治疗烧烫伤等,而且还具有许多高聚壳聚糖所不具备的生理活性和功能,如保湿性、免疫调节、防癌、调节肠道菌群、抗菌防腐、作为功能性甜味剂及营养强化剂载体、排除体内有毒有害物质、诱导植物产生抗毒素等。
壳聚糖的降解方法分为物理降解法、生物降解法和化学降解法等。物理降解法包括辐射降解法[2]、光降解法[3]、超声波降解法[4,5]。生物降解法所采用的降解酶包括能专一性地催化水解甲壳素、壳聚糖的酶,主要有甲壳素酶、壳聚糖酶以及能脱除甲壳素中乙酰氨基上的乙酰基的脱乙酰基酶;另外,非专一性的水解酶如蛋白酶、脂肪酶、溶菌酶、纤维素酶、半纤维素酶等对甲壳素和壳聚糖也有降解功能[6-10]。化学降解法主要包括酸降解法[11,12]和氧化降解法[13]等。
作者采用丁二酸酐制备酰化壳聚糖,然后在双氧水氧化降解体系下制备低分子量壳聚糖和低分子量丁二酸酐酰化壳聚糖;讨论该体系下壳聚糖及丁二酸酐酰化壳聚糖的降解速率,通过红外光谱分析双氧水对低分子量壳聚糖和低分子量丁二酸酐酰化壳聚糖结构的影响。
1 实验
1.1 试剂与仪器
壳聚糖(脱乙酰度为81%),青岛利中甲壳质公司;盐酸(质量分数36%~38%)、双氧水(30%)、无水Na2CO3、冰乙酸、丁二酸酐等均为分析纯。
乌氏粘度计;TENSOR-27型傅立叶红外光谱仪(KBr压片),德国BRUKER公司。
1.2 方法
1.2.1 丁二酸酐酰化壳聚糖(CHS)的制备
称取干燥好的壳聚糖2g置于三口烧瓶中,加入150mL水,称取无水碳酸钠2g及一定量丁二酸酐,混合均匀后,分4次(每30min加1次)加入反应体系,在常温下搅拌反应3h。反应停止后将产物倒入烧杯,用NaOH溶液调至碱性,使没反应完的壳聚糖沉淀析出,离心,去沉淀。滤液用HCl调至酸性,酰化壳聚糖析出,过滤,沉淀用大量的丙酮浸泡,过滤并冲洗3次,在通风橱中放置2d,最后于60℃真空烘箱中干燥2h,即得丁二酸酐酰化壳聚糖。
1.2.2 低分子量壳聚糖(LCS)的制备
取0.500g壳聚糖、0.6mL冰乙酸及一定体积去离子水加入三口瓶中,60°C恒温,一次性加入5%(体积分数,下同)双氧水,反应总体积为100mL,在氮气保护下反应。从开始反应起每隔50min移取2mL反应液于试管,静置。反应结束后调pH值为碱性,加甲醇沉淀,过滤,将白色沉淀用甲醇洗3次,于60℃真空烘箱中干燥,即得低分子量壳聚糖。
1.2.3 低分子量丁二酸酐酰化壳聚糖(LCHS)的制备
取4g丁二酸酐酰化壳聚糖溶于150mL去离子水中,调pH值为中性,搅拌下加入5%的双氧水50mL,60℃恒温降解。从开始反应起每隔30min移取2mL反应液于试管,静置。反应结束后调pH值为中性,加3倍的甲醇沉淀,过滤,将白色沉淀用甲醇洗3次,于60℃真空烘箱中干燥,即得低分子量丁二酸酐酰化壳聚糖。
1.2.4 分子量的测定
溶剂的配制:配制0.2mol·L-1CH3COOH+0.1mol·L-1CH3COONa溶剂50mL,用G3型砂芯漏斗过滤,恒温待用。
待测溶液的配制:分别取2mL静置后的样品,用0.2mol·L-1CH3COOH+0.1mol·L-1CH3COONa溶剂配成20mL 0.05%的待测溶液,经G3型砂芯漏斗过滤到干燥的50mL容量瓶中,恒温待用。
特性粘度([η])的测定:将乌氏粘度计垂直固定于(25±0.02)℃恒温水浴中,移取10mL过滤好的待测溶液注入其中,恒温10min,使待测溶液温度与水浴温度达到平衡后,测试待测溶液的流出时间t,实验结束后测定溶剂的流出时间t0。
分子量(M)的测定:王伟等[14]测定的此溶剂体系下脱乙酰度为84%的壳聚糖溶液的K值为1.424×10-3、α值为0.96,因此,可按公式[η]=KMα=1.424×10-3M0.96计算分子量。
2 结果与讨论
2.1 红外光谱分析
2.1.1 壳聚糖及丁二酸酐酰化壳聚糖的红外光谱(图1)

图1 壳聚糖及丁二酸酐酰化壳聚糖的红外光谱Fig.1 The IR spectra of CS and CHS
由图1可看出,丁二酸酐酰化壳聚糖在3389cm-1、1557cm-1、1737cm-1左右出现了比较明显的吸收峰,其中3389cm-1处是酰胺键中N-H的伸缩振动峰、1737cm-1处是酰胺键中C=O的伸缩振动峰、1557 cm-1处是酰胺键中N-H的弯曲振动峰。由此说明在氨基上发生了酰化反应。由图1还可看出,壳聚糖酰化后在1082cm-1处的-OH峰值变小,说明也有一部分反应发生在羟基上。
2.1.2 壳聚糖及其降解产物的红外光谱
壳聚糖在降解过程中除发生糖苷键断裂外,还可能存在开环等副反应,如果副反应过多,会影响壳聚糖的基本结构,则无法保持壳聚糖的原有性质。壳聚糖及其降解产物的红外光谱如图2所示。
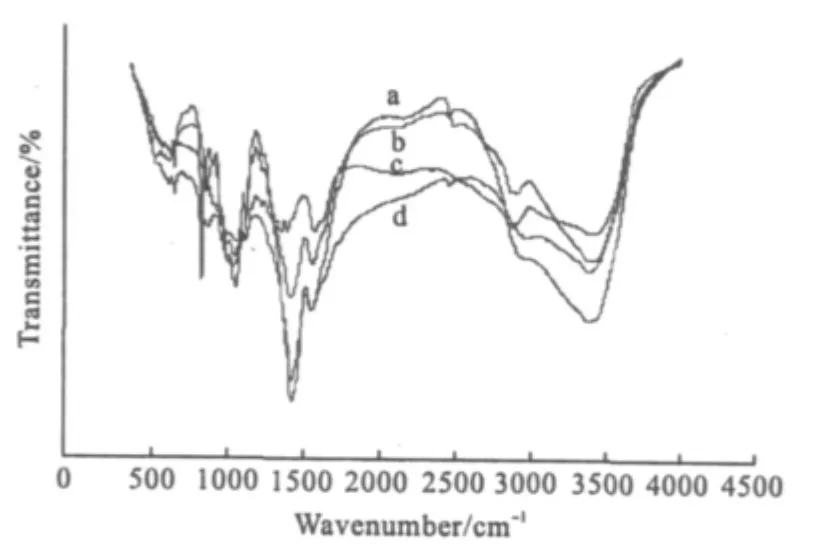
图2 壳聚糖及其降解产物的红外光谱Fig.2 The IR spectra of CS and LCS
由图2可看出,壳聚糖降解后,-NH2、-OH的特征吸收峰依然存在,且-N-H剪式振动和-NH2伸缩振动更明显,说明降解后壳聚糖单元基本结构没有发生明显变化,只是糖苷键断裂,分子量降低,某些特征吸收峰(如-NH2)变强。
2.1.3 丁二酸酐酰化壳聚糖及其降解产物的红外光谱(图3)

图3 丁二酸酐酰化壳聚糖及其降解产物的红外光谱Fig.3 The IR spectra of CHS and LCHS
由图3可以看出,丁二酸酐酰化壳聚糖降解后,酰胺键的特征峰没有发生变化;在2944cm-1、1663cm-1处分别出现了醛基的C-H、C=O伸缩振动峰,表明在降解过程中生成了醛基;在811cm-1处的糖环峰无明显变化,表明双氧水降解并没有破坏吡喃糖环;在1000cm-1左右的C-O-C伸缩振动峰强度变弱,表明主链的C-O-C部分断裂。
2.2 壳聚糖及丁二酸酐酰化壳聚糖的降解速率
壳聚糖及丁二酸酐酰化壳聚糖在双氧水中降解时的分子量与降解时间关系曲线见图4。

图4 降解产物分子量与降解时间的关系Fig.4 The relationship between molecular weight of degraded products and degradation time
由图4可知,对于壳聚糖和丁二酸酐酰化壳聚糖,降解主要发生在反应开始后的2~3h内,之后降解产物的分子量趋于稳定,约为20 000。在降解反应开始时,壳聚糖与丁二酸酐酰化壳聚糖的降解速率基本一致,当反应进行到一定程度后,壳聚糖的降解趋于终止,而丁二酸酐酰化壳聚糖降解产物的分子量仍在下降。表明在相同的双氧水浓度及降解温度下,丁二酸酐酰化壳聚糖的降解程度相对壳聚糖更大,说明壳聚糖经丁二酸酐酰化之后在双氧水体系中更容易发生降解。
3 结论
在简单均相体系下,采用双氧水降解壳聚糖所得低分子量产物基本保持了高分子量壳聚糖的结构特征。当双氧水体积分数为5%、降解温度为60℃时,壳聚糖及丁二酸酐酰化壳聚糖的氧化降解主要在反应开始后的2~3h内完成,能得到分子量为20 000左右的降解产物。同时,在相同条件下,丁二酸酐酰化壳聚糖更容易在双氧水体系中发生降解。
[1]Rinaudo M.Chitin and chitosan:Properties and applications[J].Progress in Polymer Science,2006,31(7):603-632.
[2]Choi W S,Ahn K J,Lee D W,et al.Preparation of chitosan oligomers by irradiation[J].Polymer Degradation and Stability,2002,78(3):533-538.
[3]李治,刘晓非,杨冬芝,等.壳聚糖降解研究进展[J].化工进展,2006,19(6):20-23.
[4]Xing R,Liu S,Yu H H,et al.Salt-assisted acid hydrolysis of chitosan to oligomers under microwave irradiation[J].Carbonhydrate Research,2005,340(13):2150-2153.
[5]Popa-Nita S,Lucas J M,Ladaviere C,et al.Mechanisms involved during the ultrasonically induced depolymerization of chitosan:Characterization and control[J].Biomacromolecules,2009,10(5):1203-1211.
[6]Rinaudo M,Domard A.Solution Properties of Chitosan[M].New York:Elsevier Applied Science,1998:71-86.
[7]Muzzarelli R A A.Chitin and its derivatives:New trends of applied research[J].Carbohyr Polym,1983,3(1):53-75.
[8]Yalpani M.New Technologies for Healthy Foods and Nutraceuticals[M].USA:ATL Press,1997:334.
[9]刘晓,石瑛,白雪芳,等.甲壳低聚糖的酸水解[J].中国水产科学,2003,10(1):69-72.
[10]Heggset E B,Hoell I A,Kristoffersen M,et al.Degradation of chitosans with chitinase G from streptomyces coelicolor A3(2):Production of chito-oligosaccharides and insight into subsite specificities[J].Biomacromolecules,2009,10(4):892-899.
[11]Trombotto S,Ladaviere C,Delolme F,et al.Chemical preparation and structural characterization of a homogeneous series of chitin/chitosan oligomers[J].Biomacromolecules,2008,9(7):1731-1738.
[12]Tommeraas K,Varum K M,Christensen B E,et al.Preparation and characterisation of oligosaccharides produced by nitrous acid depolymerisation of chitosans[J].Carbohydr Res,2001,333(2):137-144.
[13]Chang K L B,Tai M C,Cheng F H.Kinetics and products of the degradation of chitosan by hydrogen peroxide[J].J Agric Food Chem,2001,49(10):4845-4851.
[14]王伟,薄淑琴,秦汶.不同脱乙酰度壳聚糖Mark-Houwink方程的订定[J].中国科学:B辑,1990,(11):1126-1131.
