钙离子阻滞剂异搏定对挤压伤大鼠保护作用的实验研究
2013-01-09杨昌宇刘开俊
杨昌宇,刘开俊
挤压伤(crush injury)是一种常见的创伤,多见于自然灾害、交通事故和战伤,病死率极高。挤压伤死亡原因在急性期主要是低血容量休克和高血钾症[1]。在后期,急性肾功能衰竭、多器官功能衰竭综合征(multiple organ dysfunction syndrome,MODS)和脓毒症为最重要致死因素[2]。研究表明,骨骼肌受到长时间挤压时,损伤贯穿于整个缺血期和再灌注期。而缺血期和再灌注期损伤都与大量Ca2+内流,导致细胞内外Ca2+浓度改变,形成细胞内Ca2+超载有关[3]。
目前关于挤压伤研究大都是针对受损器官的保护。本实验旨在建立挤压伤动物模型的基础上,采用钙离子阻滞剂盐酸维拉帕米注射液(异搏定),通过抑制细胞内钙超载的发生,探讨钙离子阻滞剂对挤压伤的保护作用。本研究目的不是探讨对受损伤器官的作用,而是主要针对减少代谢毒性物质氧自由基和减少代谢毒性物质进入血液循环对全身损害作用。
材料与方法
1 材料
1.1 主要试剂和药物 丙二醛测定试剂盒(南京建成生物工程研究所)、冰醋酸(广州新港化工厂)、异博定(上海禾丰制药有限公司)、戊巴比妥钠(武汉合中医药化工有限公司)。
1.2 实验动物 SD雄性大鼠40只,体重190~250g(购至同济医学院实验动物中心)。
1.3 主要仪器 PE聚乙烯导管(美国健康医疗仪器国际公司)、紫外可见分光光度计uv-3600(日本岛津)、全自动生化分析仪(日本岛津)、恒温水浴箱(武汉科学仪器厂)、低速离心机LD4-2型(北京医用离心机厂)、微量式移液器(北京明力普瑞科技有限公司)、漩涡混合仪(步海泸西分析仪器厂)、加热搅拌器(深圳Bio-Tek科学仪器厂)、普通光学显微镜(日本OLYMPUSTOKYO)、医用净化超净工作台(苏州净化设备公司)。
2 实验方法
2.1 鼠颈外静脉持久性置管 用1%戊巴比妥钠50mg/kg腹腔注射麻醉大鼠后,常规无菌操作。于颈中线偏左侧,切开皮肤,解剖并游离左颈外静脉,结扎颈外静脉远端,将导管插入颈外静脉,深约2.5~3.0cm,用丝线结扎固定。将颈部导管引至项部皮肤下露出体外并固定,用于给药和取血。
2.2 大鼠挤压伤模型的建立 采用Akimau的方法,将大鼠俯卧于1块12cm×9cm×1cm木板上,重量约3.0kg。大鼠四肢分别固定与木板四角铁制的固定杆上。用2块带槽的木块固定两侧大腿,保护股骨不致被压断,3.5kg铅块由上至下均匀挤压,持续挤压 6h[4]。
2.3 实验分组 40只大鼠随机分为4组,分别为:(1)对照组(A):不挤压动物并注射生理盐水1ml/kg/h;(2)一般治疗组(B):在挤压时至解压后3h仅注射生理盐水1ml/(kg·h);(3)早期钙离子阻滞剂(calcium channel blocker,CCB)异博定治疗组(C):挤压后当即输注异搏定2mg/kg及输注生理盐水1ml/(kg·h)至解压后3h;(4)解压后CCB异搏定治疗组(D):挤压时和解压后注射生理盐水1ml/(kg·h),并在解压后5min内开始输注异搏定2mg/kg治疗。
2.4 血清肌酸激酶(CK)的测定 分别在解压前5min、解压后3h通过颈外静脉导管抽血各取全血标本1.0ml,3000r/min离心15min,生化自动分析仪检测血清CK含量。
2.5 血清丙二醛(MDA)的测定 血清MDA水平检测采用硫代巴比妥法 。血清标本抽取方法同上。MDA含量测定按试剂盒操作表制备空白管、标准管和各测定管;旋涡混匀器混匀,试管口用聚乙烯薄膜扎紧,用针头刺1个小孔;95℃水浴,40min;取出后流水冷却,3500r/min,离心10min;取上清液,532nm处,1cm光径,蒸馏水调零,测各管吸光度值(A532nm)。
血清MDA计算公式:血清中MDA含量(nmol/ml)=(测定管吸光度-测定空白管吸光度/标准管吸光-标准空白管吸光度)×标准品浓度(10nmol/ml)×样本测试前稀释倍数。
2.6 血清超氧化物歧化酶(SOD)的测定 血清SOD水平检测采用黄嘌呤氧化酶法 。血清标本抽取方法同上,3000r/min离心15min。按试剂盒要求配制各试剂,用旋涡混匀器充分混匀,置37℃恒温水浴40min。加入显色剂。混匀,10min后倒入1cm光径比色杯中,蒸馏水调零,波长550nm处比色。
血清SOD活力计算公式:SOD活力(U/ml)=(对照管吸光度-测定管吸光度)/50% ×反应体系的稀释倍数×样本测试前的稀释倍数。
2.7 挤压伤后大鼠活率测定 4组大鼠解压3h后拔颈静脉导管,结扎插管的颈静脉,缝合颈部创口后释放,重新放回笼中提供正常的饮食。从解压后开始共计观察72h,并分别在 12、18、24、36、72h 各时间段记录大鼠死亡只数,以观察挤压后72h各组存活率。
3 统计学分析
结 果
1 挤压伤各组血清CK水平的变化
各挤压伤组CK水平明显增高。但早期使用CCB治疗组血清CK水平在各挤压伤组最低。在解压后3h,单纯挤压伤组血清CK水平最高,与对照组及CCB治疗各组间具有统计学意义(P<0.01),见表1。
表1 挤压伤后大鼠血清CK水平的变化(±s,u/L)

表1 挤压伤后大鼠血清CK水平的变化(±s,u/L)
与对照组比较:▲P<0.01;与一般治疗组比较:●P<0.01
组别 例数 解压前5min 解压后3h A组 10 2066.89±198.64 2065.91±198.64●B组 10 6340.23±299.67▲ 9212.50±567.87 C组 10 4176.72±376.49▲● 6857.58±409.68●D组 10 6340.85±299.69▲ 8318.75±545.98●
2 挤压伤各组MDA血清水平的变化
挤压前5min,挤压伤各组大鼠血清MDA含量升高,与对照组比较差异有显著意义。在挤压伤各组血浆中,早期使用CCB治疗组含量最低。与其他挤压伤组比较具有统计学意义。解压后3h,在挤压伤各组大鼠血浆中,一般治疗组MDA含量升高最为明显,解压后运用CCB治疗组含量次之,早期使用CCB治疗组含量最低。一般治疗组MDA含量与其他组间具有统计学意义(P<0.01),见表2。
表2 挤压伤后大鼠血清MDA水平的变化(±s,nmol/L)

表2 挤压伤后大鼠血清MDA水平的变化(±s,nmol/L)
与对照组比较:▲P<0.01;与一般治疗组比较:●P<0.01
组别 例数 解压前5min 解压后3h A组 10 4.14 ±0.33 4.14±0.33●B组 10 7.34±0.24▲ 8.89±0.15 C组 10 5.40±0.46▲● 6.20±0.37●D组 10 7.65±0.55▲ 8.01±0.38●
3 挤压伤各组血清SOD水平的变化
挤压各组血清SOD在解压前5min含量与对照组比较明显升高,具有显著差异。其中早期使用CCB治疗组含量最低,与其他挤压伤组含量具有统计学意义。解压后3h,血浆SOD水平均降低,其中一般治疗组血清SOD含量最低,早期使用CCB治疗组含量最高,一般治疗组血清SOD含量与各组间具有统计学意义,见表3。
表3 挤压伤后大鼠血清SOD水平的变化(±s,u/L)

表3 挤压伤后大鼠血清SOD水平的变化(±s,u/L)
与对照组比较:▲P<0.01;与一般治疗组比较:●P<0.01
组别 例数 解压前5min 解压后3h A组 10 2066.95±199.84 2066.95±198.84●B组 10 6339.15±298.74▲ 9212.51±569.87 C组 10 4177.12±378.41▲● 6858.43±409.73●D组 10 6342.14±299.74▲ 8319.05±545.88●
4 挤压伤后大鼠存活率
在挤压伤各组大鼠中,死亡大多数发生在24h内,约占死亡总数的81%,死亡原因可能与高血钾和低血容量休克有关。一般治疗组10只大鼠24h内死亡7只(死亡率为70%),72h内死亡8只(死亡率为80%);挤压后CCB治疗组24h内死亡5只(死亡率为50%),72h死亡8只(死亡率为80%);早期运用钙离子阻滞剂组72h死亡例数仅为2例(死亡率为20%),见表4。4组总体之间有显著性统计学差异(P=0.0012<0.01)。早期运用钙离子阻滞剂组死亡例数与一般治疗组比较,有显著差异(P=0.01),见图1。
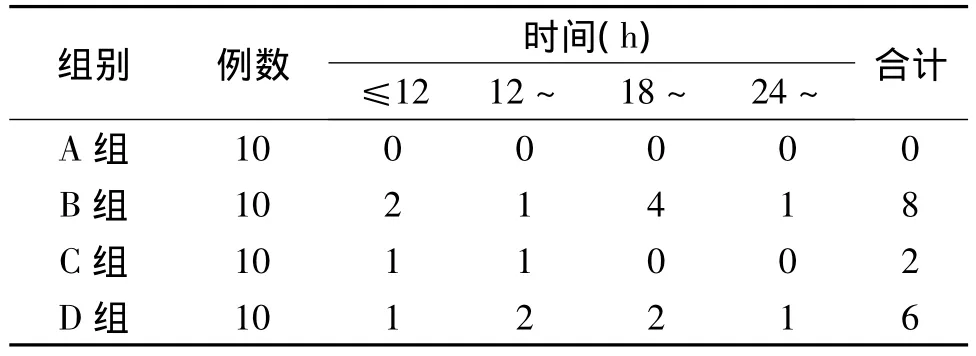
表4 各组挤压伤大鼠72h各时间段死亡例数
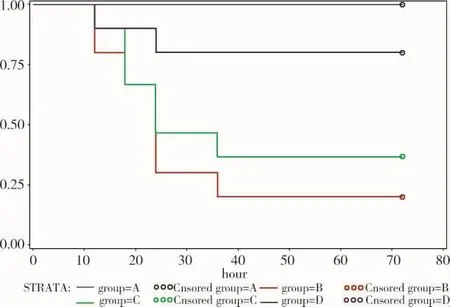
图1 各治疗组大鼠生存曲线的比较
讨 论
骨骼肌能耐受轻微的缺血2h,2~4h的缺血可导致不可逆的解剖功能的改变。在缺血期由于肌肉受到机械挤压,导致肌细胞膜牵张感受器,激活离子通道开放,促使Ca2+内流。组织灌溉不足和细胞缺氧使细胞无氧代谢增多,三磷酸腺苷(ATP)生成减少,Na+/K+-ATP泵活性降低,造成细胞内Na+排出减少,浓度增高。再灌注后细胞为了恢复正常的生理功能,一方面激活Na+/K+-ATP泵,另一方面快速激活Na+/Ca2+交换蛋白,以加快Na+细胞外流,以维持细胞内环境稳定,同时也将大量Ca2+运入细胞内。血液再灌注时细胞为了排出过多的H+,也通过Na+/H+交换,使胞外Na+内流,而再次通过Na+/Ca2+交换,促进Ca2+内流。缺血再灌注期也可通过第二信使途径增加Na+/Ca2+交换,使胞浆Ca2+浓度升高。另一方面,在再灌注时细胞产生的大量的自由基,破坏细胞膜结构,也可促进钙超载的发生。
肌肉坏死一般发生在缺血6h[5-6]。肢体较长时间受到挤压时,受压部位肌肉内的血液供氧发生障碍,甚至阻断。组织细胞发生缺血缺氧后,功能下降,甚至坏死,并释放毒性坏死产物。当解压后,组织细胞重新获得血液氧气供给,损伤应随即停止,但相应的组织细胞功能,代谢障碍及结构破坏更为严重,即出现了缺血再灌注损伤[7]。而缺血再灌注损伤在造成挤压局部组织细胞损伤的同时,更严重的是起其他远隔部位脏器的损害[8]。其主要机制是受挤压局部组织细胞的有害物质随血液循环,影响及损害其他器官组织,严重可造成多个脏器功能衰竭。
研究表明,骨骼肌细胞Ca2+的改变是缺血期和再灌注期挤压组织损伤的主要原因之一。其机制为在缺血期Ca2+在细胞内大量聚集,从而激活中心蛋白水解酶、Ca2+依赖磷酸激酶、核酸蛋白酶及脂质过氧化反应使受压骨骼肌细胞变性、坏死、横纹肌溶解。另一方面,当肌肉组织受到挤压发生缺血缺氧时,产生大量一氧化氮和氧自由基。这些自由基可通过直接攻击生物大分子,膜通道后增加炎症细胞的黏附和游出,脂质过氧化作用等方式造成细胞结构损伤和功能代谢障碍[9]。作为自由基脂质过氧化的醛或终产物之一MDA,毒性作用最大,可使酶等带有氨基的大分子化合物发生交联,加重了有活性的蛋白质变性;同时也破坏体内的核酸和染色体[9]。它的含量反应机体脂质过氧化的程度,可间接反应组织受自由基损伤的程度。SOD是一种重要的氧自由基清除剂,他对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除歧化超氧阴离子,其活性高低可反应体内抗自由基水平、SOD和MDA可间接反应自由基代谢水平。肌酸激酶在肌细胞中含量丰富,当肌细胞损伤时,其大量进入血,其在血清中的水平与肌肉的损伤程度相关联,也是反映肌肉损伤的重要指标之一。本实验通过血清CK、MDA、SOD水平作为反映大鼠受挤压损伤程度和抗氧自由基指标。CCB是一组能够阻止各种病理因素导致Ca2+细胞内流的药物,在心血管疾病治疗中广泛应用。而近年来发现CCB可选择阻断在缺血缺氧等病理状态下的钙超载,而不影响正常的细胞钙平衡[10]。研究表明钙离子阻滞剂异搏定能减轻大鼠在组织缺血再灌注损伤过程中脂质过氧化,抑制钙离子内流,降低组织细胞的破坏程度[11]。
本研究表明对照组血清CK、MDA明显低于其他挤压伤组血清,具有统计学意义(P<0.01)。说明由于物理挤压和缺血再灌注损伤促使肌细胞大量破坏,导致细胞内物质CK和代谢产物MDA大量入血而异常增高。通过在解压前和解压后应用CCB治疗组血清MDA、CK水平低于一般治疗组(P<0.01),其中解压前5minCCB治疗组血清CK、MDA明显低于其他两挤压伤组(P<0.01),提示CCB不但能够减轻机械挤压对下肢的损伤,而且对解压后缺血再灌注氧自由基对机体的损伤亦有保护作用(如表1、2)。
而作为氧自由基清除剂SOD在细胞损伤时也大量入血,因此在解压前5min各挤压伤组明显高于对照组,具有统计学意义(P<0.01)。其中早期CCB治疗组SOD水平明显低于其他两挤压伤组(P<0.01)。但解除挤压后随着氧自由基的大量消耗,血清 SOD水平 逐渐下降,其中解压后3h各CCB治疗组SOD水平明显低于一般治疗组(P<0.01),说明CCB能够通过减少氧自由基的产生和降低SOD的消耗,从而降低氧自由基对机体的损伤,使血清SOD水平可维持较高水平(如表3)。通过生存分析比较亦发现早期使用钙离子阻滞剂干预组的大鼠,其72h存活率明显高于单纯挤压伤组(P<0.01),其原因可能为减少血液循环中氧自由基等有害物质对全身损伤。
本实验通过各大鼠挤压伤组分别对肌肉损伤的重要指标肌酸激酶,反映组织受自由基损伤程度的脂质过氧化物的终产物之一MDA,抗自由基水平氧自由基清除剂SOD血清水平及72h存活率比较,发现CCB治疗组各项结果明显优于单纯治疗组。提示钙离子阻滞剂能够减轻挤压伤对机体的损伤。其可能机制为钙离子阻滞剂通过阻断损伤肌细胞Ca2+内流病理过程,一方面减轻局部骨骼肌的损伤,另一方面减少代谢毒性物质和氧自由基进入血液循环对全身的损害。而生存分析比较提示早期CCB治疗组存活优于解压后治疗组,说明CCB对挤压伤的治疗应及早进行。
[1] Erek E,Sever MS,Serdengecti K,et al.An overviewof morbidity and mortality in patients with acute renal failure due to crush syndrome:the Marmara earthquake experience[J].Nephrol Dial Transplant,2002,17(1):33 - 40.
[2] Smith J,Greaves I.Crush injury and crush syndrome:a review[J].J Trauma,2003,54(5S):S226 -230.
[3] Tsung A,Kaizu T,Nakao A,et al.Ethyl pyruvate ameliorates liver ische-reperfusion injury by decreasing hepatic necrosis and apoptosis[J].Transplantation,2005,79(2):196-204.
[4] Akimau P,Yoshiya K,Hosotsubo H,et al.Newexperimental model of crush injury of the hind limbs in rats[J].J Trauma,2005,58(1):51 -58.
[5] Starer M,Mullins R.Rhabdomyolysis and myoglobinurie re-nal failure in trauma and surgical patients:a review[J].J Am Coll Surg,1998,186(6):693 -716.
[6] Tountas CP,Bergman RA.Tourniquet ischemia:ultra structural and histochemical observations of ischemic human muscle and nerve[J].J Hand Surgy(Am),1997,2(1):7.
[7] Oden M.The role reperfusion-induced injury in the pathogenesis of thecrush syndome[J].NewEngl J Med,1991,324(20):1417-1422.
[8] Kalia N,Brown NJ,Wood RF,et al.Effects of intestinal ischemia reperfusion injury on rat peripheral blood neutrophil activation[J].Dig Dis Sci,2003,48(9):1677 -1684.
[9]王立金.挤压伤与多器官功能不全综合征[J].中国煤炭工业医学杂志,2004,7(10):907 -909.
[10]刘小红,李文秀.钙离子通道阻滞剂对缺血缺氧性脑损伤作用的研究[J].国外医学妇幼保健分册,1996,7(1):10-12.
[11]宋炬赫,高丽萍.钙拮抗剂减轻大鼠皮瓣缺血再灌注损伤的效应[J].中国临床康复,2006,10(4):78-79.
