沉默AFP基因可抑制肝癌HepG2细胞Survivin mRNA的表达*
2013-01-07方紫凌张慧卿韩小妮王农荣熊建萍张焜和
方 念 方紫凌 张慧卿 韩小妮 黄 根 王农荣 熊建萍 张焜和
甲胎蛋白(alpha-fetoprotein,AFP),作为血清标记物已广泛应用于肝细胞癌(hepatocellular carcinoma,HCC)的临床诊断、治疗及预后判断[1]。近年研究表明,AFP在HCC的细胞增殖和凋亡中发挥重要作用[2-3]。Survivin是近年发现的凋亡蛋白抑制因子家族成员,其最显著的特点是仅在各种肿瘤中表达,而在正常分化组织中沉默,是当今研究的热点之一[4]。研究表明,肝癌组织中Survivin呈高表达状态,是独立的预后不良因素[5]。目前,肝癌细胞AFP与Survivin之间调控关系的研究,国内外鲜有报道。本研究以肝癌细胞HepG2为研究对象,通过RNA干扰技术沉默AFP,检测细胞凋亡和Survivin基因表达的变化,以探讨肝癌AFP基因靶向RNA干扰治疗的可行性。
1 材料与方法
1.1 材料
RPMI 1640培养基购自美国GibcoBR公司;胎牛血清由杭州四季青生物制品公司提供;Lipofectami-neTM2000转染试剂购自美国绿阳公司;AFP定量测定试剂盒(ELISA)由郑州安图绿科生物工程有限公司提供;AFP基因的RNA干扰系列和相关引物由上海生工生物工程公司设计与合成。
1.2 方法
1.2.1 细胞培养 肝癌细胞株HepG2细胞由南昌大学消化研究所惠赠,将细胞生长于含10%胎牛血清的RPMI-1640培养基中,接种于37℃,5%CO2,饱和湿度的孵箱中培养。
1.2.2 实验分组 本研究实验细胞共分为3组,即实验组、脂质体+空质粒对照组和空白组。
1.2.3 ELISA法测定HepG2细胞上清液AFP 接种培养HepG2细胞,分别收集转染前和转染后12、24、48 h的细胞培养上清液,3 000 rpm,4℃离心10 min,取上清液。按照试剂盒说明书操作,采用ELISA法检测AFP含量。
1.2.4 siRNA沉默HepG2细胞AFP基因 1)本研究选取的AFP siRNA目的基因片段:5'-AACTCAGTGAGGACAAACTAT-3',送上海生工设计、合成干扰系列和引物。上游引物系列:5'-AAA TAC ATC CAG GAG AGC CA-3',下游引物系列:5'-CTG AGC TTG GCA CAG ATC CT-3。2)构建载体:参照亓同钢等[6]报道的方法构建AFP基因siRNA表达质粒。3)质粒转染:取对数生长期的HepG2细胞,经0.25%胰蛋白酶消化,用不含血清、抗生素的RPMI 1640培养基将细胞重悬。每组设立3个复孔,加质粒和经稀释的LipofectamineTM2000转染复合物,室温孵育4 h,于12 h和24 h更换培养基,48h收获细胞。
1.2.5 细胞增殖与凋亡的检测 1)MTT法检测HepG2细胞增殖:收集转染前和转染后12、24、36、48 h的HepG2细胞,每组设9个复孔,每孔终体积为200 μL,每孔内加入20 μL MTT溶液(3 g/L),将细胞移入培养箱继续培养6h。吸去培养基,每孔内加入150 μL DMSO,振荡摇匀,用酶标仪于490 nm波长条件下测定吸光度值。2)AnnexinⅤ-FITC/PI双染色流式细胞仪检测HepG2细胞凋亡:收集转染前和转染后12、24、48 h HepG2细胞,用不含EDTA的胰蛋白酶消化、收集总细胞,PBS洗涤2次,弃上清。加入400 μL结合缓冲液使细胞重悬,再加6 μL Annexin V-FITC,4 μL PI,室温避光孵育15 min。采用激发波长488 nm,分别以红色和绿色荧光通道检测细胞凋亡。
1.2.6 逆转录-PCR检测Survivin基因 采用RT-PCR半定量检测各组转染前后Survivin基因的表达,收集各组转染前和转染后12、24、48 h的HepG2细胞,以合成的Survivin基因特异性引物进行扩增。上游引物系列:5'-CCG CAT ACA GTG GTC GAG AGA-3',下游引物系列:5'-GTG TAG GGT GTA GAA TCC TGT TCA-3'。
2 结果
2.1 转染前后各组细胞上清液AFP水平
采用ELISA法检测HepG2细胞上清液AFP浓度,所得结果(表1)。
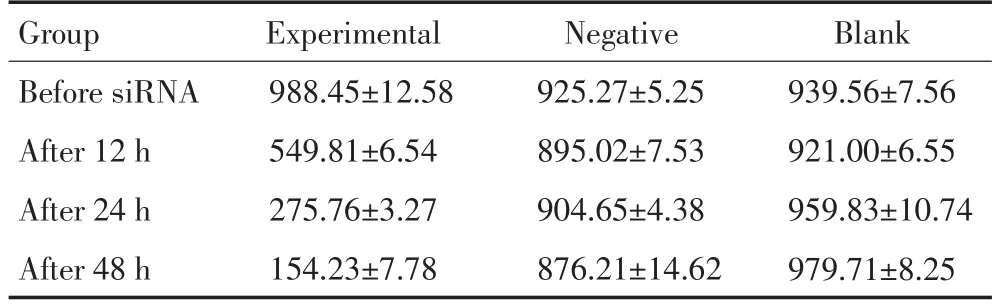
表1 转染前后肝癌细胞培养上清液中AFP的浓度(ng/mL)Table1 AFP level in the supernatant of hepatocellular carcinoma HepG2 cells
2.2 AFP siRNA转染后HepG2细胞生长活力下降
收集经转染后12、24、36、48 h的HepG2细胞,采用MTT法检测细胞活性(图1),结果发现转染24 h和48 h后转染组与对照组间有显著性差异(P<0.01)。
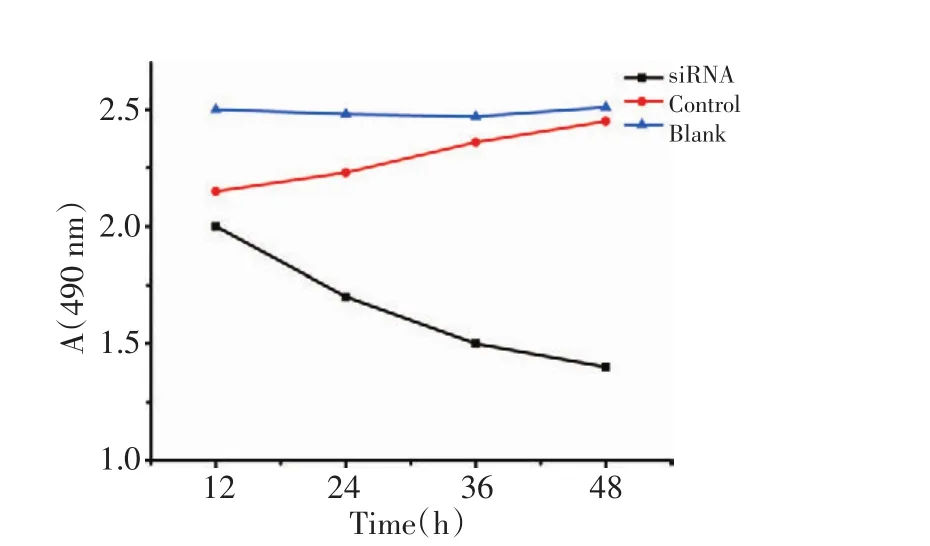
图1 MTT检测AFP siRNA转染后HepG2细胞增殖Figure1 Effects of AFP siRNA on HepG2 cell proliferation detected by MTT assay
2.3 AFP siRNA转染后HepG2细胞凋亡增加
本研究检测了转染AFP-siRNA 48 h后,各组HepG2细胞的凋亡率。结果发现转染组AFP-siRNA的细胞凋亡率为35.6%,较转染前增加了24.3%。阴性对照组和空白组细胞凋亡率分别为12.5%和11.3%,实验组细胞凋亡率较阳性对照组和阴性对照组明显升高,差异有统计学意义(P<0.05,图2)。
2.4 HepG2细胞AFP siRNA对Surivivin基因表达的影响
收集12、24和48 h后转染组与对照组细胞,经基因扩增,UV凝胶图像分析仪分析电泳结果,AFP-siRNA转染24、48 h后Survivin mRNA较转染前减少59%、78%。HepG2细胞上清液AFP水平与HepG2细胞Survivin-mRNA表达的变化具有较强的一致性(图3)。
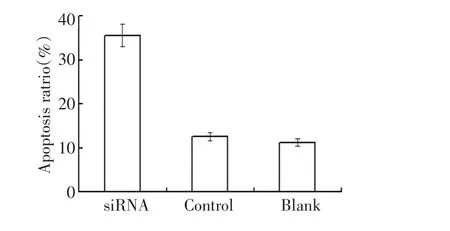
图2 转染AFP-siRNA-48 h后HepG2细胞凋亡率Figure2 Effects of AFP siRNA on HepG2 cell apoptosis
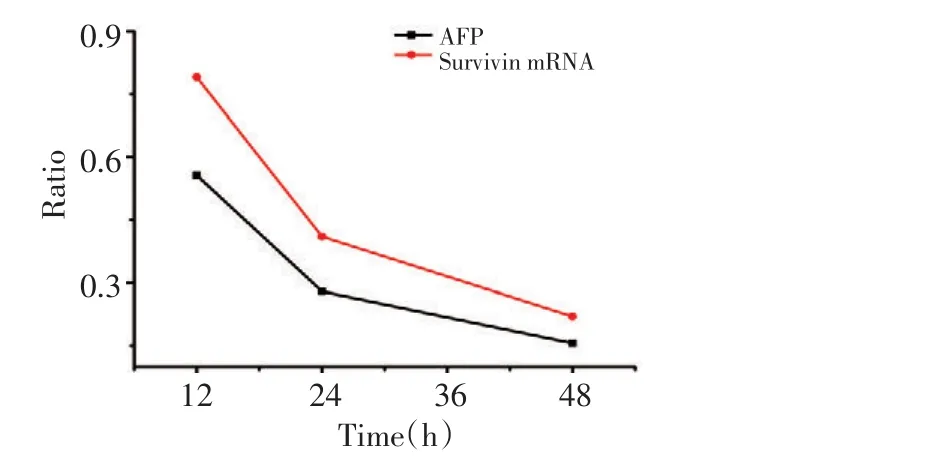
图3 AFP-siRNA转染后AFP和Survivin mRNA表达的变化Figure3 Changes in AFP and Survivin mRNA expression after AFP-siRNA silence
3 讨论
由于大量慢性乙型肝炎感染人群的存在,原发性肝癌仍是我国高发的重大疾病[7]。近年来,肝癌的治疗效果有所提高,其主要原因之一是以AFP为基础的血清学检测技术以及结合现代影像技术的进步,提高了肝癌的早期诊断率,进而提高了肝癌患者的早期处理比例[8]。AFP广泛应用于HCC的诊断、监测和随访,但其生物学功能直到近来才引起人们注意。大量研究证实,AFP具有复杂的生物学功能,如促进肝癌细胞增殖、抑制凋亡和免疫逃避[2,9]。
本研究通过小RNA干扰技术沉默肝癌HepG2细胞中AFP基因的表达,结果显示,在转染48 h后,肝癌细胞培养上清液中AFP的浓度明显下降[由(988.45±12.58)ng/mL降至(154.23±7.78)ng/mL],与对照组相比有显著差异,提示转染成功。转染48 h后,实验组肝癌细胞生长被抑制43.04%,而细胞凋亡率则增加24.3%,即沉默肝癌细胞AFP基因的表达后,细胞增殖降低,细胞凋亡增加,这与Yang等[3]报道的结果相似。
Survivin是一种凋亡抑制蛋白(inhibition apoptosis protein,IAP),在除甲状腺、胸腺及生殖腺以外的分化成熟的成人组织中表达缺失,而在绝大多数肿瘤组织中表达阳性,这种表达特性使其迅速成为恶性肿瘤诊断与治疗研究的新靶点。研究表明,Survivin在肝癌细胞高表达,调控着细胞的分裂、增殖和凋亡[10-11]。
如前所述,我们通过RNA干扰下调肝癌HepG2细胞AFP基因表达之后,肝癌细胞的凋亡率增加。本研究还观察到在转染的过程中,随着培养上清液AFP浓度的持续下降,Survivin mRNA的水平也逐渐降低,两者表现出较好的一致性。因此,我们推测细胞凋亡率的变化可能与Survivin的表达下降相关,即沉默AFP基因能抑制Survivin表达,进而促进凋亡。与我们的报道相符,Li等[12]在Bel7402细胞的研究中发现,通过AFP抗体抑制AFP的表达后Survivin水平明显降低,肝癌细胞凋亡效果加强,同时认为AFP通过上调Survivin的表达来抑制TRAIL诱导凋亡的活性。
AFP在肝细胞癌的发生、发展中发挥重要作用,通过本研究表明,通过RNA干扰技术阻断AFP表达,对于控制AFP阳性HCC的发展及术后复发可能具有重要价值。
1 Debruyne EN,Delanghe JR.Diagnosing and monitoring hepatocellular carcinoma with alpha-fetoprotein:new aspects and applications[J].Clin Chim Acta,2008,395(1-2):19-26.
2 Li M,Li H,Li C,et al.Alpha fetoprotein is a novel protein-binding partner for caspase-3 and blocks the apoptotic signaling pathway in human hepatoma cells[J].Int J Cancer,2009,124(12):2845-2854.
3 Yang X,Zhang Y,Zhang L,et al.Silencing alpha-fetoprotein expression induces growth arrest and apoptosis in human hepatocellular cancer cell[J].Cancer Lett,2008,271(2):281-293.
4 Chau GY,Lee AF,Tsay SH,et al.Clinicopathological significance of survivin expression in patients with hepatocellular carcinoma[J].Histopathology,2007,51(2):204-218.
5 Yang Y,Zhu J,Gou H,Clinical significance of Cox-2,Survivin and Bcl-2 expression in hepatocellular carcinoma(HCC)[J].Med Oncol,2011,28(3):796-803.
6 亓同钢,汪运山,王 芳,等.AFP基因siRNA表达质粒的构建及鉴定[J].山东大学学报,2004,42(3):353-354.
7 郑荣寿,张思维,吴良有,等.中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J].中国肿瘤,2012,21(1):1-12.
8 吴孟超.原发性肝癌的诊断及治疗进展[J].中国医学科学院学报,2008,30(4):363-365.
9 Um SH,Mulhall C,Alisa A,et al.Alpha-fetoprotein impairs APC function and induces their apoptosis[J].J Immunol,2004,173(3):1772-1778.
10 Zhu H,Chen XP,Zhang WG,et al.Expression and significance of new inhibitor of apoptosis protein survivin in hepatocellular carcinoma[J].World J Gastroenterol,2005,11(25):3855-3859.
11 Zhao X,Ogunwobi OO,Liu C.Survivin inhibition is critical for Bcl-2 inhibitor-induced apoptosis in hepatocellular carcinoma cells[J].PLoS One,2011,6(8):e21980.
12 Li M,Zhou S,Liu X,et al.alpha-Fetoprotein shields hepatocellular carcinoma cells from apoptosis induced by tumor necrosis factor-related apoptosis-inducing ligand[J].Cancer Lett,2007,249(2):227-234.
