抑制JNK信号通路下调A549中LRP表达可增强顺铂化疗敏感性*
2013-01-07傅应亚韩晓黎黎友伦
傅应亚 韩晓黎 黎友伦
肺癌是绝大多数国家恶性肿瘤死亡的首要原因。肺癌中约80%为非小细胞肺癌,病死率高。顺铂是目前肺癌化疗的一线推荐药物,其抗肿瘤作用已得到肯定,但极易形成耐药,故限制了它的应用。因此,如何提高化疗敏感性、减少耐药以提高疗效、延长患者生存期已成为近年来肺癌临床治疗急需解决的问题之一。
细胞内药物蓄积减少是肺癌顺铂耐药分子机制之一。肺耐药蛋白(lung resistance protein,LRP)是Scheper等[1]在P-gp(p-糖蛋白)阴性的多药耐药性肺癌细胞系SW-1573/2R 120中发现的一种高表达的蛋白。LRP是一种穹窿体蛋白(major vault protein,MVP),主要存在于核膜和胞浆囊泡,参与药物进出胞核及囊泡运输。因此,LRP通过阻止药物进入胞核,把胞浆的药物运入囊泡,通过胞吐作用排出,导致细胞内药物蓄积减少,诱导耐药。研究发现,LRP在肺癌组织中高表达,且与肺癌细胞分型、吸烟、化疗耐药等有关[2]。用顺铂、阿霉素、博莱霉素分别短期处理肺癌细胞株,均可使细胞LRP mRNA表达增高,而仅顺铂的化疗反应性和LRP mRNA表达水平之间存在显著相关性。Osborn等[3]认为JNK信号通路是细胞应答抗癌药物的重要组成成分,可能在化疗耐药中起着重要的作用。Levresse等[4]研究发现铂类药物可促使JNK持续活化及下游c-jun的表达,从而减少药物引起的凋亡,抑制JNK的活化可以增加小细胞肺癌的药物敏感性。
由此可知,抑制JNK的活化可增强肺癌化疗敏感性,而LRP的高表达与化疗耐药密切相关,因此,本实验拟用JNK信号通路特异性抑制剂SP600125抑制该通路,检测其对LRP的影响,初步探讨两者的关系及其可能的机制。
1 材料与方法
1.1 材料
人肺腺癌细胞A549来自重庆医科大学肿瘤实验室细胞库,RPMI-1640购自Gibco公司(GrandIsland,NY,USA),胎牛血清购自四季青(浙江天杭生物科技有限公司),青链霉素混合液购自Hyclone公司(Logan,UT,USA),0.25%含EDTA的胰酶购自上海碧云天生物技术有限公司,CCK-8试剂盒购自中国广州奕源生物科技有限公司,顺铂购自Sigma公司(St.Louis,MO,批号:p4394-25mg),SP600125购自Sigma公司(St.Louis,MO,批号:s5567-10mg),BCA工作液购自美国Thermo scientific公司(Waltham,MA),BeyoEcl plus化学发光试剂盒购自上海碧云天生物技术有限公司,兔抗JNK1/2、P-JNK1/2购自abcam公司(Cambridge,UK),鼠抗LRP购自SANTA CRUZ公司(CA,USA),兔抗GAPDH购自北京康为世纪生物科技有限公司,辣根过氧化物酶标记的羊抗兔IgG和羊抗鼠IgG购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 A549细胞用含10%胎牛血清,1%青链霉素的RPMI-1640培养液培养,放于37℃,5%CO2湿润的恒温孵箱中,细胞呈贴壁生长,每隔2~3 d换液,待细胞长到培养瓶的70%~80%时,用0.25%含EDTA的胰酶消化、传代。
1.2.2 CCK-8法检测药物对A549细胞的毒性作用 A549细胞分为2组,顺铂单药组及顺铂+SP600125组。顺铂单药组设置药物浓度梯度(0、1、2、4、8、16 μg/mL),顺铂+SP600125组先用SP600125(4 μg/mL)预处理1 h后再加入上述不同浓度的顺铂处理72 h。主要步骤:选择处于对数生长期的细胞,制备单细胞悬液,接种到96孔板中,每孔5×103个细胞,加入药物,每个浓度设3个复孔,处理72 h,加入10%CCK-8溶液,放入37℃,5%CO2湿润的恒温孵箱中1.5 h,用酶标仪测定OD值,波长为450 nm。实验重复3次。用下述公式计算抑制率:抑制率(%)=(对照组-处理组)/(对照组-空白组)×100%。用中效方程式计算IC50。
1.2.3 流式细胞术检测细胞凋亡率 细胞分为4组:对照组、顺铂组(16 μg/mL)、顺铂组(16 μg/mL)+SP600125(2 μ g/mL)组 、顺 铂 组(16 μ g/mL)+SP600125(4 μg/mL)组。后两组先用SP600125预处理1 h,再加入顺铂。细胞按上述处理后,每组收集1×106个细胞,用PBS洗涤2次后,加入1 mL PBS制成单细胞悬液,按Annexin V-FITC/PI双标记法检测细胞凋亡率。实验重复3次。
1.2.4 Western blot法检测蛋白表达 A549细胞分两批处理,均分为4组,第一批:对照组、顺铂2 μg/mL组、顺铂8 μg/mL组、顺铂16 μg/mL组;第二批:对照组、顺铂组(16 μg/mL)、顺铂组(16 μg/mL)+SP600125(2 μg/mL)组、顺铂组(16 μg/mL)+SP600125(4 μg/mL)组。检测各处理组细胞中JNK、P-JNK、LRP的表达,内参为GAPDH蛋白。主要步骤:细胞株处理、蛋白提取、电泳及转膜,孵一抗、二抗,显影。用Quantity One软件分析各条带吸光度值,实验重复3次。
1.3 统计学处理
2 结果
2.1 顺铂单药对LRP表达的影响
用不同浓度顺铂作用于A549细胞72 h,然后提取总蛋白,用Western blot法检测细胞中LRP的表达量。随着顺铂浓度的增加,LRP的表达量增加,其中在8 μg/mL时LRP表达量最高,而达16 μg/mL时其表达量略有下降。8 μg/mL、16 μg/mL组与对照组比较均具有统计学意义(P<0.05,图1)。
2.2 顺铂单药对JNK、P-JNK蛋白表达的影响
用不同浓度顺铂作用于A549细胞72 h,后提取蛋白,用Western blot法检测JNK、P-JNK的表达情况。随着顺铂浓度增加,P-JNK表达增多,其中在16 μg/mL时表达最多。而JNK总蛋白无明显变化(图2a)。
2.3 SP600125预处理的A549细胞JNK、P-JNK的变化情况
SP600125为JNK信号通路的特异性抑制剂,A549细胞先用不同浓度SP600125预处理1 h,然后加入16 μg/mL顺铂作用72 h后提取蛋白。用Western blot法检测JNK、P-JNK蛋白的变化情况。随着SP600125浓度增加,P-JNK表达水平逐渐降低,在4 μg/mL时P-JNK明显被抑制(图2b)。
2.4 SP600125预处理的A549细胞中LRP的变化情况
由Western blot的结果可知,用SP600125预处理的A549细胞,LRP表达水平较顺铂单药处理组低(P<0.05),且SP600125浓度越高,LRP表达水平越低(P<0.05,图3)。
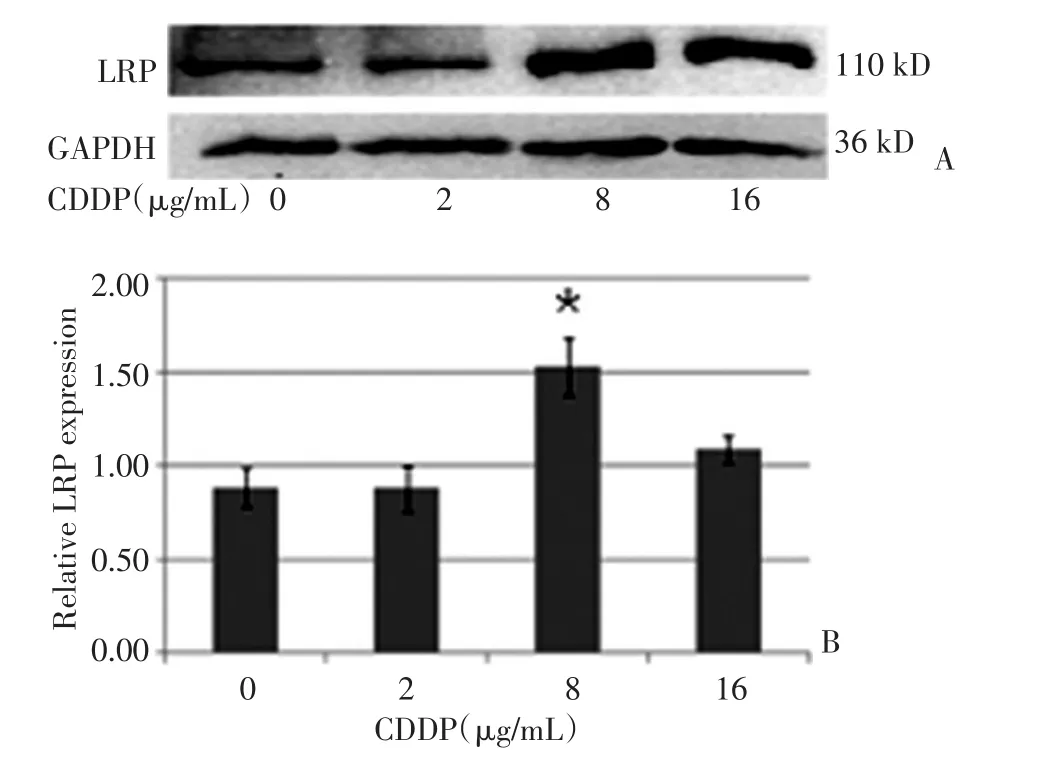
图1 不同浓度顺铂对A549细胞LRP表达的影响Figure1 Effect of CDDP on the LRP mRNA expression in A549 cells
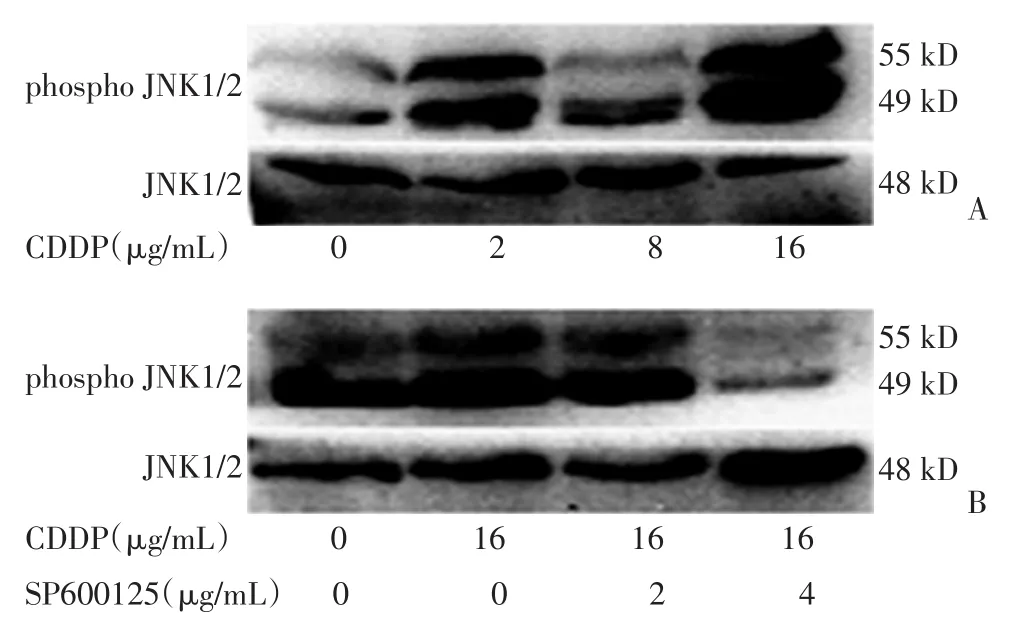
图2 不同浓度顺铂对A549细胞LRP表达的影响Figure2.Effect of CDDP on LRP expression in A549 cells
2.5 顺铂及SP600125联合顺铂对A549细胞的生长抑制作用
CCK-8法检测结果显示,顺铂联合SP600125组细胞生长抑制率高于顺铂单药组。用中效方程式计算的半数抑制浓度IC50。顺铂单药组IC50为9.41。SP600125+CDDP组,即先用SP600129(4 μg/mL)预处理1 h,再加入不同浓度的顺铂处理72 h。经之前的实验显示,4 μg/mL的SP600125可阻断JNK信号通路的磷酸化,但该浓度对A549细胞几乎无毒性作用(图4)。SP600125+CDDP组IC50为6.54,较顺铂单药组明显降低。由以上结果可知,用SP600125预处理的A549细胞,对顺铂的敏感性增加。
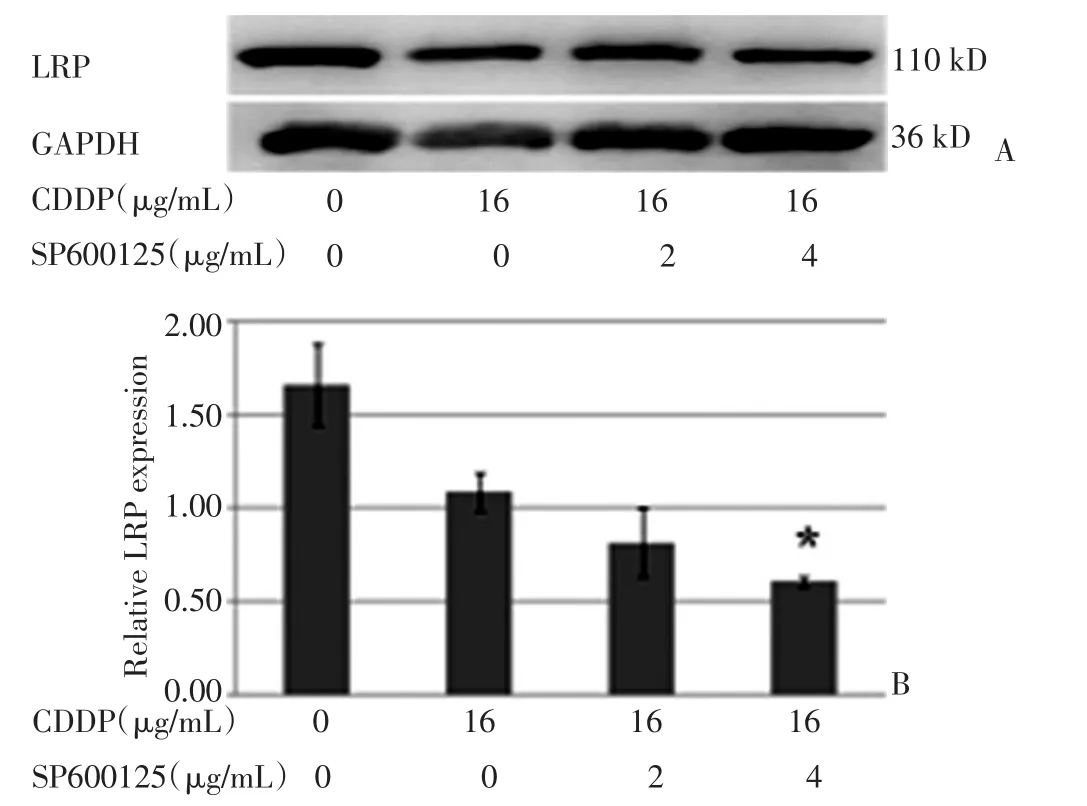
图3 用SP600125预处理的A549细胞,LRP的变化情况Figure3 Effect of SP600125 on LRP expression in A549 cells.
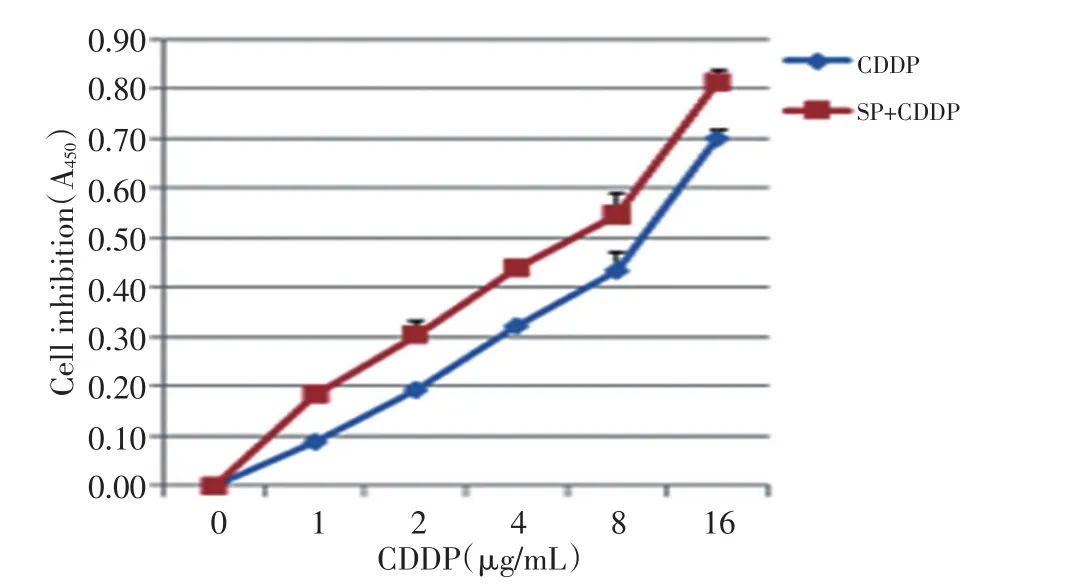
图4 顺铂及SP600125联合顺铂对A549细胞的生长抑制作用。与对照组比较,顺铂组除 1 μg/mL外,余均有统计学意义(P<0.05);SP600125+CDDP组与对照组比较均有统计学意义(P<0.05)Figure4 Cell inhibition of CDDP or CDDP combined with SP600125(SP+CDDP)in A549 cells.Significant differences were found between the CDDP and SP+CDDP groups,except for the 1 μg/mL CDDP group(P<0.05)
2.6 细胞凋亡率的变化
按实验设计分组,其中SP600125(2 μg/mL)+顺铂组(16 μg/mL)、SP600125(4 μg/mL)+顺铂组(16 μg/mL)分别用相应浓度的SP600125预处理1 h,然后加入16 μg/mL的顺铂处理72 h,收集细胞,用Annexin V-PI双染色法检测细胞凋亡。结果显示:顺铂组(16 μ g/mL)细胞凋亡率高于对照组(P<0.05),SP600125(2 μg/mL)+顺铂组(16 μg/mL)高于顺铂组(P<0.05),而SP600125(4 μg/mL)+顺铂组(16 μg/mL)高于 SP600125(2 μg/mL)+顺铂组(16 μg/mL)(P<0.05)。由此我们得出结论,用SP600125预处理的A549细胞可增强顺铂促凋亡的作用,且随着SP600125浓度的增加其促凋亡的作用增加(图5,表1)。
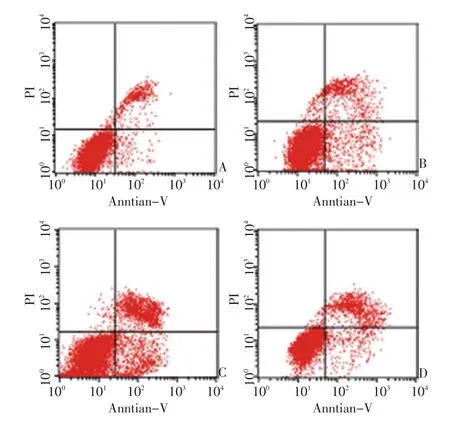
图5 不同处理组A549细胞凋亡的情况Figure5 Effect of the JNK inhibitor on the CDDP-induced apoptosis in A549 cells

表1 SP600125预处理后顺铂对A549细胞凋亡情况Table1 Effect of the c-Jun N-terminal kinase(JNK)inhibitor on the CDDP-induced apoptosis in A549 cells
3 讨论
细胞凋亡的起始及完成需要细胞内外死亡通路的激活,然而多种细胞内信号通路则调控着凋亡的过程,其中包括JNK信号通路[5]。JNK是丝裂原活化蛋白激酶(mitogen activated-protein kinase,MAPK)家族主要成员之一,大量实验提示JNK信号通路在细胞分化、细胞凋亡和应激反应中起着至关重要的作用。但对于其在细胞凋亡及耐药中的作用尚存在争议。
一方面,JNK信号通路的活化促进细胞增殖、化疗耐药。Nateri等[6]研究发现敲除c-Jun基因或者特异性的使c-jun失活,可使小鼠肠道肿瘤变小,延长小鼠的寿命。Kuntzen等[7]利用SP600125和siRNA抑制JNK的活性,发现可以增强CD95介导的细胞凋亡,引起细胞周期阻滞。Cripe等[8]在对阿霉素耐药的白血病细胞株HL-60/ADR中发现JNK的持续激活和c-jun的过度表达与耐药性存在正相关,抑制JNK的活性可以降低多药耐药相关蛋白1的表达,增强细胞对药物的敏感性。Levresse等[9]发现铂类药物可使JNK持续活化和促进下游c-jun的表达,从而减少药物引起的凋亡,抑制JNK的活化可以增加小细胞肺癌的药物敏感性。李大卫等[10]发现在胃癌SGC7901和SGC7901/DDP中,用SP600125阻滞JNK信号通路,可增强该两种细胞株对顺铂的敏感性,伴P-gp的表达明显减低,说明了抑制JNK信号通路可能是通过降低P-gp的表达逆转该胃癌细胞株顺铂的耐药。
另一方面,JNK信号通路的活化促进细胞凋亡。Mansouri等[11]在对顺铂敏感的卵巢癌细胞株中,顺铂可持续激活JNK,并引起其下游c-jun的过度磷酸化,形成转录激活因子AP-1,上调死亡配体FasL的表达,从而引起细胞凋亡。Li等[12]在卵巢癌细胞株A2780和耐顺铂细胞株A2780/DDP中,转染JNK-dn基因可抑制顺铂诱导的JNK的活性,阻断顺铂诱导的细胞凋亡;转染JNK1-wt基因可使JNK持续活化,并使死亡配体FasL表达上调,细胞凋亡率增加。提示野生型JNK1基因能逆转A2780/DDP对顺铂的耐药。Sanchez-Perez等[13]研究发现 MAPK 磷酸酶CL100/MKP-1和Hvh-5的表达,可选择性的抑制CDDP诱导的JNK的激活,进而保护人类胚胎细胞(293T)免受CDDP诱导的凋亡。
由此可知,JNK信号通路在肿瘤耐药中具有双重作用,可能与细胞类型的不同、凋亡刺激物的特点、JNK活化持续时间以及其他信号通路的活化有关[5]。
本实验结果证实,在肺腺癌A549细胞中,顺铂可激活JNK信号通路,同时上调肺耐药蛋白LRP的表达,且具有浓度依赖性。用JNK信号通路抑制剂SP600125抑制JNK的磷酸化后,LRP的表达明显降低,抑制了细胞的生长,促进了细胞的凋亡。
研究发现,活化的JNK可经核转位进入细胞核激活各自的核内转录因子如 Elk-1、c-Jun、c-fos、ATP-2、p53、c-Myc以及非转录因子,如Bcl-2超家族(Bcl-2、Bcl-xl、Bim、BAD)[5],通过磷酸化调节转录因子的活性,对基因转录进行调节,产生一系列广泛而重要的生物学效应,包括炎症、细胞生长、增殖、分化、细胞周期阻滞、凋亡等。Shimamoto等[14]发现在人结直肠癌SW-620细胞中顺铂可上调LRPmRNA及蛋白的表达,其机制可能与增强了LRP启动子的活性相关。Shinoda等[15]发现在小细胞肺癌细胞株GLC4和NCI-H82细胞株中,多柔比星可诱导MRP1和JNK的激活,用SP600125预处理或转染JNK1/2反义寡核苷酸的细胞株,可见MRP1的表达明显降低,与JNK信号通路的下游分子P-c-jun与MRP1的启动子结合,促进MRP1的表达有关。
LRP与MRP、P-gp同属于MDR的经典途径,以及活化的JNK对基因转录的调节作用,由此我们推论,活化的JNK信号通路上调LRP的表达,可能与激活的JNK信号通路相关分子与LRP启动子结合,增强其活性有关。
综上所述,JNK信号通路参与了肺癌顺铂化疗耐药途径,抑制JNK信号通路可通过下调LRP的表达增强其化疗敏感性,故对JNK信号通路的深入研究有望为肺癌治疗提供新的靶点。
1 Scheper RJ,Broxterman HJ,Scheffer GL,et al.Overexpression of a M(r)110,000 vesicular protein in non-P-glycoprotein-mediated multidrug resistance[J].Cancer Res,1993,53(7):1475-1479.
2 刘耀斌,石彦涛,李永军,等.肺耐药蛋白与肺癌[J].国外医学(呼吸系统分册),2001,21(2):107-109.
3 Osborn MT,Chambers TC.Role of the stress-activated/c-Jun NH2-terminal protein kinase pathway in the cellular response to adriamycin and other chemotherapeutic drugs[J].J Biol Chem,1996,271(48):30950-30955.
4 Levresse V,Marek L,Blumberg D,et al.Regulation of platinumcompound cytotoxicity by the c-Jun N-terminal kinase and c-Jun signaling pathway in small-cell lung cancer cells[J].Mol Pharmacol,2002,62(3):689-697.
5 Liu J,Lin A.Role of JNK activation in apoptosis:a double-edged sword[J].Cell Res,2005,15(1):36-42.
6 Nateri AS,Spencer-Dene B,Behrens A.Interaction of phosphorylated c-Jun with TCF4 regulates intestinal cancer development[J].Nature,2005,437(7056):281-285.
7 Kuntzen C,Sonuc N,De Toni EN,et al.Inhibition of c-Jun-N-terminal-kinase sensitizes tumor cells to CD95-induced apoptosis and induces G2/M cell cycle arrest[J].Cancer Res,2005,65(15):6780-6788.
8 Cripe LD,Gelfanov VM,Smith EA,et al.Role for c-jun N-terminal kinase in treatment-refractory acute myeloid leukemia(AML):signaling to multidrug-efflux and hyperproliferation[J].Leukemia,2002,16(5):799-812.
9 Levresse V,Marek L,Blumberg D,et al.Regulation of platinumcompound cytotoxicity by the c-Jun N-terminal kinase and c-Jun signaling pathway in small-cell lung cancer cells[J].Mol Pharmacol,2002,62(3):689-697.
10 李大卫,彭志海,李真真,等.氨基末端激酶参与胃癌顺铂耐药机制的研究[J].中华胃肠外科杂志,2008,11(2):159-162.
11 Mansouri A,Ridgway LD,Korapati AL,et al.Sustained activation of JNK/p38 MAPK pathways in response to cisplatin leads to Fas ligand induction and cell death in ovarian carcinoma cells[J].J Biol Chem,2003,278(21):19245-19256.
12 Li F,Meng L,Zhou J,et al.Reversing chemoresistance in cisplatin-resistant human ovarian cancer cells:a role of c-Jun NH2-terminal kinase 1[J].Biochem Biophys Res Commun,2005,335(4):1070-1077.
13 Sánchez-Pérez I,Martínez-Gomariz M,Williams D,et al.CL100/MKP-1 modulates JNK activation and apoptosis in response to cisplatin[J].Oncogene,2000,19(45):5142-5152.
14 Shimamoto Y,Sumizawa T,Haraguchi M,et al.Direct activation of the human major vault protein gene by DNA-damaging agents[J].Oncol Rep.2006,15(3):645-652.
15 Shinoda C,Maruyama M,Fujishita T,et al.Doxorubicin induces expression of multidrug resistance-associated protein 1 in human small cell lung cancer cell lines by the c-jun N-terminal kinase pathway[J].Int J Cancer,2005,117(1):21-31.
(2013-06-30收稿)
(2013-08-12修回)
