超临界CO2诱变枯草芽孢杆菌的研究
2013-01-06鄢洪德申屠樟萍钱俊青
鄢洪德,申屠樟萍,钱俊青
(1浙江工业大学 生物与环境工程学院,浙江 杭州 310014;2浙江工业大学 药学院,浙江 杭州 310014)
CO2是一种性质稳定、无毒性、不易燃、经济、环保的可再生资源,在Tc>31.1℃和Pc>7.38 MPa时达到临界状态,超临界状态下的CO2具有低粘度、高扩散的物理性质,因此具有良好的传质特性,其作为一种环境友好型溶剂,已广泛应用于萃取、反应、分析检测等多个领域[1]。近年来,超临界CO2杀灭微生物的能力也引起了广泛的关注。在适当的压力和较低温度下,超临界CO2对细菌、酵母、真菌等微生物有显著的致死效果[2-4]。此外,研究还表明超临界CO2除了影响细胞活力外,细胞代谢也会受到显著影响[5]。压力对生物系统的正常运转可进行干扰,从而诱发遗传途径的变化使得突变的发生[6]。因此,超临界CO2作为一种特殊的压力,有望成为一种新型的诱变剂。Zhang等利用超临界CO2诱变黄杆菌YY25以提高其产脂肪酶的活力,突变株比野生株的产酶活力提高了44.2%[7]。本研究利用超临界CO2诱变枯草芽孢杆菌,诱变效果以其产淀粉酶活力的变化表示,研究诱变条件,如压力、温度、诱变时间等对诱变效果的影响,进一步考察超临界CO2作为一种新型无毒的诱变剂的潜力。
1 材料与方法
1.1 菌种
枯草芽孢杆菌Bacillus subtilis K2为实验室保藏菌种。
1.2 培养基及培养条件
斜面保存培养基:牛肉膏 0.3%,蛋白胨1.0%,氯化钠 0.5%,琼脂 2%,pH7.0;平板计数培养基:牛肉膏 0.5%,蛋白胨 1.0%,氯化钠 0.5%,琼脂 2%,pH7.0;平板筛选培养基:牛肉膏 0.5%,蛋白胨 1.0%,氯化钠 0.5%,可溶性淀粉 0.2%,琼脂 2%,pH7.0;发酵培养基:牛肉膏 0.3%,蛋白胨1.0%,氯化钠 0.5%,葡糖糖 0.5%,pH7.0。菌株K2划线接种于斜面培养基,培养7—8 h后,用无菌水将菌苔洗下,置于带玻璃珠的无菌三角烧瓶中。然后将该烧瓶置于45℃水浴摇床中断链24 h,使芽孢分散成单个个体。继而将该芽孢悬液置于60℃水浴中30 min,杀死残余的营养体,然后用无菌水将芽孢悬液稀释成108 cfu/mL的浓度,待用。产酶发酵培养:菌株活化后接种于发酵培养基,于37℃,200 r/min培养48 h。
1.3 超临界CO2诱变
用图1所示的超临界CO2装置处理芽孢悬液[7]。分别用75%的乙醇和无菌水清洗恒温压力容器,然后加入30 mL芽孢悬液,密封。接着CO2通过高压活塞泵注入容器。当达到设定的温度和压力后,开始计时。处理结束,打开放空阀门释放出CO2,打开接液阀门收集处理后的芽孢悬液。
1.4 细胞存活率测定
将处理后的样品和原始样品分别梯度稀释,取0.1 mL稀释液涂布于平板计数培养基,每组涂布3个平行样,37℃条件下培养48 h后观察各组样品的菌落数,根据公式C=Log(N/No)计算存活率,其中C为存活率,No是未处理的菌落数,N是处理后的菌落数。
1.5 突变筛选
1.5.1 突变初筛方法
透明圈法:将处理后的样品和原始样品分别梯度稀释,取0.1 mL稀释液涂布于平板检测培养基,每组涂布3个平行样,37℃条件下培养48 h。为便于透明圈测定,控制稀释度使检测平板上的菌落数<10个,并对菌落进行标号,将对应菌落挑至新的平板,记上同一标号。然后在原检测培养基平板上滴加碘液,直至弥漫整个平板,稍停片刻,测量菌落形成的透明圈的大小,计算透明圈直径与菌落直径的比值(HC值)。筛选其中HC值较大的菌落保存,用于进一步复筛。

图1 超临界CO2处理系统
1.5.2 突变复筛方法(酶活力检测方法)
将HC值较大的菌株接入发酵培养基进行产淀粉酶培养,测定酶活力。菌种活化后,分别接入发酵培养基中,37℃,200 r/min培养48h。取发酵液于4 000 r/min离心10 min除去菌体,取上清液进行酶活力测定。淀粉酶活力测定采用碘比色法。取5.0 mL 0.125%可溶性淀粉溶液预热10 min后加入0.5 mL酶液,反应5 min,加入5 mL 0.1 mol/L的硫酸终止反应。取0.5 mL反应混合物和5.0 mL稀碘液混匀,显色。以加入失活酶的反应液为对照,在620 nm处测定光密度[8]。淀粉酶活力的定义为:该反应条件下,5 min水解1mg淀粉的所需的酶量为一个酶活力单位(U)。
2 结果与讨论
2.1 诱变压力的影响
压力是影响微生物进化的重要因素。设定相同的处理温度37℃,在不同的压力下处理枯草芽孢杆菌的芽孢悬液,处理时间30 min。处理后菌体存活率曲线如图2所示,随着压力的增加,菌体存活率呈缓慢直线下降的趋势。不同压力下菌体的菌落直径以及透明圈直径如表1所示。结果表明,随着诱变压力的增加,除了HC值先增后减之外,菌落直径、透明圈直径并未
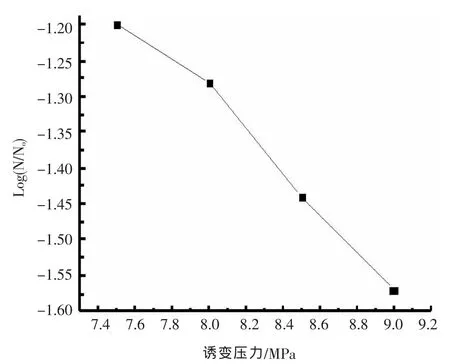
图2 诱变压力对存活率Log(N/No)的影响
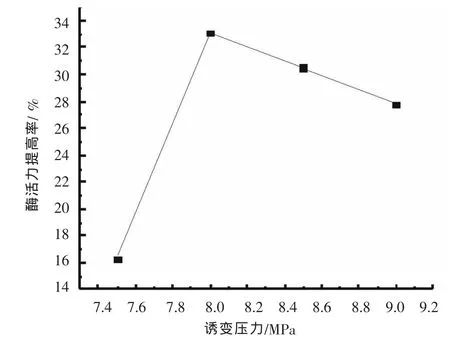
图3 诱变压力对突变株酶活力的影响
呈现一定的规律性关系。其中,菌落直径、透明圈直径、HC值的最大值以及相应的平均值均在8.0 MPa处理时有最大值。挑选其中HC值大的菌落,进行发酵培养,检测酶活力,其结果见图3。随着诱变压力的增加,酶活力的提高百分率先增后减。在压力为8.0 MPa时达到了最高值。诱变压力从7.5 MPa增加至8.0 MPa,酶活力的提高率的变化很快。而继续增加诱变压力,酶活力则出现缓慢下降。因此进一步的实验选择诱变压力为8.0 MPa。

表1 诱变压力的影响
2.2 诱变温度的影响
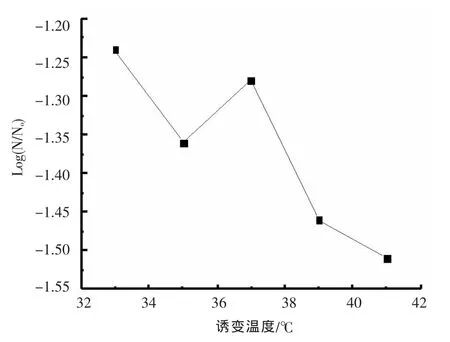
图4 诱变温度对存活率Log(N/No)的影响

图5 诱变温度对突变株酶活力的影响
温度也是超临界CO2诱变的一个重要因素。Spilimbergo等[9]曾研究发现温度在CO2失活微生物的过程中起主要的作用。选择诱变压力为8 MPa,在不同的温度下处理枯草芽孢杆菌的芽孢悬液,处理时间30 min。处理后菌体存活率曲线如图4所示,曲线呈马鞍型曲线,当处理温度从33℃增加至35℃时,菌体存活率下降,但当温度增加至37℃时,菌体存活率反而上升,温度继续增加,菌体存活率又下降。这可能是因为细胞内某些修复机制被激活的缘故,因此存活率呈现暂时升高[10]。不同处理温度下菌体的菌落直径以及透明圈直径如表2所示,在39℃诱变处理下,所得到的菌落直径与平均直径最大,33℃条件下,突变菌株的透明圈及其平均值最大,而在37℃下的HC值及平均值最大。挑选其中HC值大的菌落,进行发酵培养,检测酶活力,其结果见图5。当温度从33℃到37℃之间,酶活有显著的提高,酶活提高率从1.83%上升到25.26%。当诱变温度为39℃和41℃时,突变株的酶活力皆低于原始菌株,而且,酶活力降低的趋势越明显。这与马鞍形曲线的鞍型区容易发生突变一致。因此进一步实验选择诱变温度为37℃。
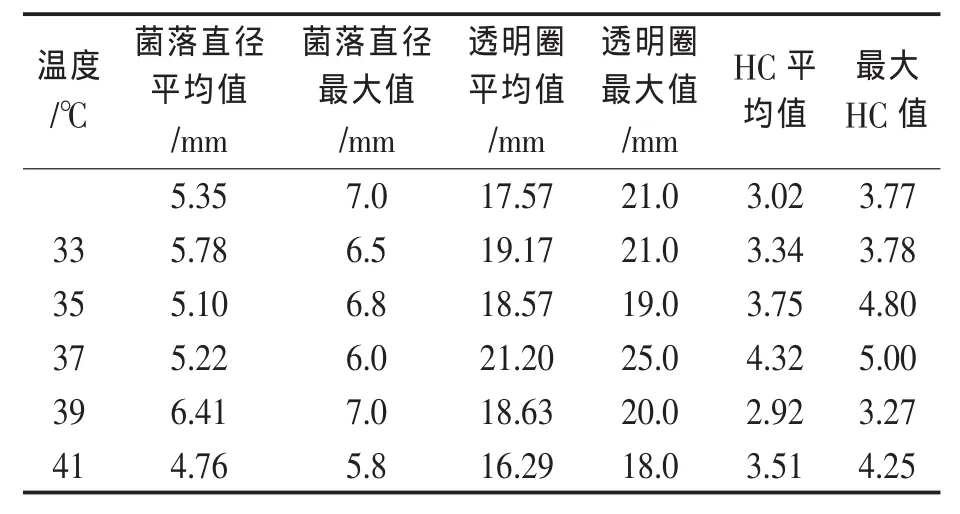
表2 诱变温度的影响
2.3 诱变时间的影响

图6 诱变处理时间对存活率Log(N/No)的影响
在37℃,8 MPa下对枯草芽孢杆菌的芽孢悬液进行处理不同时间。菌体存活率曲线如图6所示,随着处理时间的延长,菌体存活率不断降低。不同处理时间菌体的菌落直径以及透明圈直径如表3所示,诱变处理30 min时,所得到的菌落的HC值及平均值最大。而其他处理时间下,突变株的HC值皆小于原始菌株。挑选其中HC值大的菌落,进行发酵培养,检测酶活力,其结果见图7。处理时间从10 min到30 min之间酶活力提高率不断增加,在30 min时达到最高值,提高约33.1%。但是,处理时间为10 min时,酶活力小于原始菌株的酶活力,说明此时突变株多为负突变。而在30 min之后,直到50 min,酶活力的提高百分率在不断地减小。在处理时间为50 min时,酶活提高率小于0,也即此时突变株多为负突变。
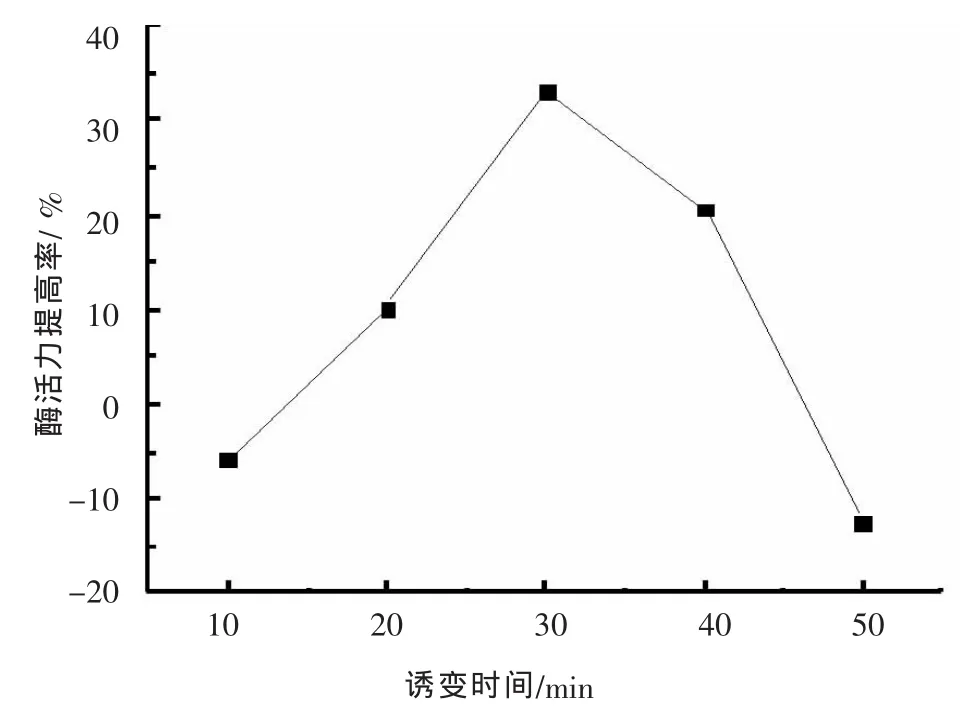
图7 诱变处理时间对酶活提高百分率的影响
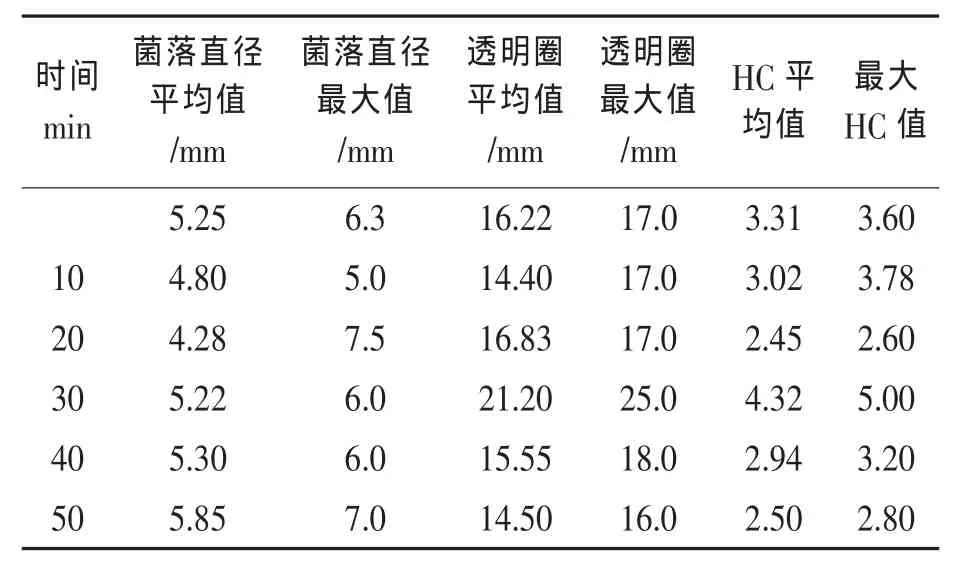
表3 诱变时间的影响
3 结 论
通过超临界CO2诱变淀粉酶产生菌Bacillus subtilis K2,对诱变条件如压力、温度、时间进行了考察,发现最佳的诱变条件为:压力8.0 MPa,温度37℃,时间30 min。并从中筛选出一株酶活力提高约33%的突变株,说明超临界CO2可作为一种绿色的有潜力的诱变剂。
[1]陈洪,苏畅,张兆斌,等.超临界二氧化碳的四个应用方向[J].生物加工过程,2005,3(4):14-18.
[2]Damar S,Balaban M O.Review of dense phase CO2technology:Microbial and enzyme inactivation,and effects on food quality[J].Journal of Food Sciene,2006,71(1):1-11.
[3]Zhang J,Davis T A,Matthews M A,et al.Sterilization using high-pressure carbon dioxide[J].Journal of Supercritical Fluids,2006,38:354-372.
[4]Garcia-Gonzalez L,Geeraerd A H,Spilimbergo S,et al.High pressure carbon dioxide inactivation of microorganisms in foods:The past,the present and the future[J].International Journal of Food Microbiology,2007,117:1-28.
[5]Fabre C E,Condoret J S,Marty A.Extractive fermentation of aroma with supercritical CO2[J].Biotechnol.Bioeng.,1999,64:392-400.
[6]Tenaillon O,Denamur E,Matic I.Evolutionary significance of stress-induced mutagenesis in bacteria-a review[J].Trends Microbiol.,2004,12:264-270.
[7]Zhang Q Y,Qian J Q,Guo H,et al.Supercritical CO2:A novel environmentally friendly mutagen[J].Journal of Microbiological Methods,2008,75:25-28.
[8]朱何东.高温α-淀粉酶产生菌的筛选及酶学性质研究[D].四川:四川大学微生物学,2006.
[9]Spilimbergo S,Bertuccoa A,Lauro F M,et al.Inactivation of Bacillus subtilis spores by supercritical CO2treatment[J].Innov Food Sci Emerg Technol.,2003,4:16-165.
[10]Su C X,Zhou W,Fan Y H,et al.Mutation breeding of chitosanase-producing strain Bacillus sp.S65 by low-energy ion implantation[J].Journal of Industrial Microbiology&Biotechnology,2006,33:1037-1042.
