1例大剂量甲氨蝶呤致急性肾衰竭患者的药学服务
2013-01-04庞露吴斌杜晓明肇丽梅中国医科大学附属盛京医院药学部院血液科辽宁沈阳0004
庞露,吴斌,杜晓明,肇丽梅 (中国医科大学附属盛京医院,.药学部,.院血液科,辽宁 沈阳0004)
甲氨蝶呤(methotrexate,MTX)为叶酸还原酶抑制剂,通过抑制二氢叶酸还原为有生理活性的四氢叶酸,从而阻断DNA的生物合成,发挥抗肿瘤作用。大剂量甲氨蝶呤(highdose methotrexate,HD-MTX)是指用药剂量超过1.0g·m-2,临床上广泛应用于急性淋巴细胞白血病、淋巴瘤、骨肉瘤等疾病的治疗。MTX不仅可消灭肿瘤细胞,对正常组织细胞同样有杀伤作用。与HD-MTX毒性密切相关的不是的峰浓度,而是MTX一定浓度下的暴露时间[1]。当用药后出现MTX排泄延迟时,其不良反应发生几率会大大增大,严重时可致急性肾衰竭(acute renal failure,ARF),威胁生命[2-3]。MTX的排泄延迟是指用药24 h后血药浓度(C24h)≥10.0μmol·L-1,48 h的血药浓度(C48h)≥1.0μmol·L-1,72 h的血药浓度(C72h)≥0.1μmol·L-1[4](定义时间点及浓度不统一,如有研究定义为C24h>15μmol·L-1,C48h>1.5 μmol·L-1,C72h>0.15μmol·L-1[5])。本文报导一例使用HD-MTX后,出现ARF及MTX排泄延迟的病例,临床药师通过参与该病例的救治,分析可能导致MTX排泄延迟和AFR的原因,总结治疗中的注意事项,减少不良反应发生。
1 病例介绍
患者,男,66岁,确诊非霍奇金淋巴瘤11个月,复诊化疗入院。患者11个月前因右下腹疼痛,于我院行左、右半横结肠切除,术后病理诊断:小肠及肠系膜淋巴结弥漫大B细胞型淋巴瘤,后确定诊断为非霍奇金淋巴瘤(弥漫大B细胞型)Ⅳ期,IPI评分3分。已行CHOP方案化疗6次。停疗后每月复查,发现疾病进展,再次予E-CHOP方案化疗2次,RCHOP方案化疗2次。患者现有间断发热,体温最高39℃,偶有咳嗽、咳痰,上腹不适,食欲较差,其余无明显不适。患者47年前曾行阑尾切除术;有支气管哮喘病史15年,每年夏季发作,发作时静滴地塞米松可缓解,近1年未用药;2年前曾患多发性脑梗死,现左眼颞侧偏盲;无肝肾病病史;青霉素过敏。入院查体:体温36.5℃,血压120/80 mmHg,心率80次/min,呼吸18次/min。右侧经腹直肌长约10 cm手术切口,右下腹可见一长约10 cm的斜行手术疤痕,中、上腹部可触及一大小约6 cm×8 cm大小包块,质韧,无触痛。入院后实验室及辅助检查:(1)血常规:WBC6.9×109/L,Hb 72 g·L-1,PLT168×109/L;(2)血清β2微球蛋白:4.5 mg·L-1;(3)胸部CT:肺斑片结节影较前增多、范围增大,右侧心膈角处淋巴结较前增大、增多。其余化验及检查无明显异常。入院诊断:非霍奇金淋巴瘤(弥漫大B细胞型)Ⅳ期IPI评分3分;肺炎。
2 治疗过程
患者基础疾病为肿瘤,有长期化疗史,近期存在发热、咳嗽,影像学提示存在肺部感染,从宿主因素、临床表现、影像学等考虑不排除真菌感染,给予拉氧头孢(噻吗灵注射剂)1.0g,q12 h+伊曲康唑(斯皮仁诺注射液)200 mg,qd(首日给药频次为q12 h)静脉滴注抗感染治疗,临床症状逐渐缓解,给药10 d后复查胸部CT:双肺仍见多发炎症改变;双侧胸腔新发少量积液;腹腔少量积液,伴上腹部改变,请结合腹部相关检查;余所见基本同前。考虑患者多次化疗后效果不佳,疾病出现进展,更换化疗方案为大剂量甲氨蝶呤3.0g·m-2冲击治疗,具体方案为:MTX总量5.0g,其中0.5 g作为突击剂量0.5 h内静脉滴注,剩余4.5 g于随后23.5 h内持续泵入,同时给予复方二氯醋酸二异丙胺注射液、泮托拉唑钠(泰美尼克注射剂)、左卡尼汀(可益能注射液)等辅助治疗,给药前及给药后给予常规水化、碱化、亚叶酸钙(calcium leucovorin,CF)溶液漱口及冲洗肛周。MTX给药结束12 h开始给予CF30 mg,q6 h静脉注射(首剂加倍)。患者化疗第2天一般状态良好,第3天时出现腹胀、排尿困难,四肢轻度水肿,测定MTX给药44 h血清药物浓度(C44h)>120μmol·L-1,血清肌酐(Scr)为216.5μmol·L-1,血 K+2.75 mmol·L-1,尿pH为6.0,出现 MTX严重排泄延迟及急性肾功能损伤。
3 主要救治过程及药学服务
3.1 增加调整CF剂量 目前认为最有效的MTX解毒剂为羧肽酶 G2(carboxypeptidase G2,CPDG2),该药为肽链端解酶,可以将 MTX水解为无活性的代谢产物排出体外,但该药国内暂未上市,因此仅能选择CF进行解救。CF可直接提供叶酸在体内的活化形式,可以拮抗MTX对细胞的毒性作用。本院使用HD-MTX时经验性给予CF的剂量为30 mg,q6 h静脉注射(首剂加倍),目前,对于HD-MTX后发生AFR并MTX排泄延迟的CF剂量及给药频次的调整尚无统一标准,一般情况下根据表1进行剂量调整,但未提到该药的最大用药剂量[6]。临床药师查阅相关文献,建议CF剂量不宜过大,不能完全按照 MTX浓度×体质量(kg)计算,原因如下:(1)有报道,当 MTX血药浓度超过100μmol·L-1,足量的CF浓度不能竞争性逆转毒性反应[7];(2)国外有报导一名18岁患者CF解救日剂量为10 g,但该患者仅为CF解救,未行血液净化,同时存在鼻出血、呕吐症状,情况较为严重,因此CF解救量较大[8],而本文中患者年龄较大,与国外人种体质不同,症状仅有腹胀、乏力,一般状态尚可,应酌情将CF减量;(3)CF主要也经肾脏排泄,剂量过大时也可能影响患者肾功能;(4)患者同时行血液净化治疗。综上原因,临床药师建议CF日剂量不宜超过10 g。临床医生从安全性考虑,最终将CF剂量调整为1.0g,q6 h静脉注射,该剂量共使用4 d,以后根据表1调整,每6 h1次。

表1 根据44~48 h的MTX浓度调整CF给药剂量表Tab 1 The table of CF dosage adjusted according to the plasma concentration of MTX(tested at 44~48 hours from MTX injection)
3.2 加大碱化、水化力度 因患者此时尿pH值呈酸性,增加碳酸氢钠注射液用量,加强碱化力度,同时监测尿pH值及血气变化,根据结果调整碳酸氢钠注射液用量。患者前6日每日出液量在3 000~5 000 mL(尿量+血液净化滤出液体量),停止血液净化后,尿量逐渐增加,每日保持在1 500 mL以上。
3.3 停用可能影响MTX排泄或肾功能药物 临床药师通过查阅患者医嘱及分析患者目前病情,认为可停用部分可能影响MTX排泄或肾功能药物:(1)伊曲康唑(斯皮仁诺注射液):该药辅料羟丙基-β-环糊精主要通过肾小球滤过,重度肾损害的患者(肌酐清除率<30 mL·min-1)禁用本品,药师计算此时患者肌酐清除率为26.02 mL·min-1,建议停用;(2)拉氧头孢(噻吗灵注射剂):该药主要经肾脏排泄,可能与MTX竞争排泄通道,考虑患者目前无发热等肺炎临床症状,建议停用;(3)泮托拉唑钠(泰美尼克注射剂):患者目前无明显消化道反应,停用泮托拉唑钠(泰美尼克注射剂),该药为质子泵抑制剂(proton pump inhibitors,PPI),近年来有研究认为,PPI与HD-MTX联合使用,可能会导致 MTX排泄延迟,建议二者避免合用,涉及到的PPI制剂包括奥美拉唑、兰索拉唑、埃索美拉唑、泮托拉唑等[5,9]。建议将泮托拉唑钠(泰美尼克注射剂)改为法莫替丁(高舒达片)及磷酸铝(洁维乐凝胶)保护消化道黏膜。临床医生结合患者病情,同意临床药师以上建议,减少药物相互作用对MTX排泄及患者肾功能的影响。
3.4 血液净化 在发现患者出现AFR及 MTX排泄延迟后,紧急行连续静脉-静脉血液透析滤过(CVVHDF),共行6次,MTX血药浓度降低至3.36μmol·L-1时,停止CVVHDF解救,继续使用CF解救。治疗期间Scr变化见图1。
3.5 其他 根据患者化验指标,给予呋塞米利尿、氯化钾补钾,输血、输白蛋白等对症治疗。
该患者经以上救治措施,在化疗第19天,MTX血药浓度降至0.1μmol·L-1,停止解救。其中CF解救18日,CVVHDF血液净化6次,抢救后MTX血药浓度变化见图2。停止血液净化后出现Scr一过性升高现象,但随着MTX血药浓度下降,Scr逐渐下降。
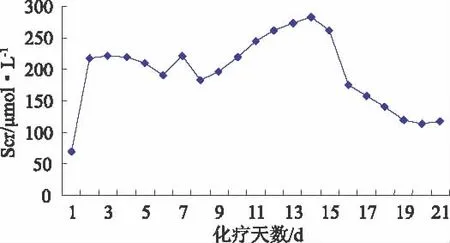
图1 Scr随化疗天数变化图Fig 1 Changes of Scr map with the chemotherapy days
患者在治疗过程中,虽出现AFR及MTX严重排泄延迟,但因抢救及时,辅助治疗措施适当,未出现黏膜炎、肝毒性、胃肠道反应等其他不良反应,患者一般状态良好。停止解救及抗感染治疗后,Scr逐渐恢复至117.3μmol·L-1、血象恢复至 WBC4.0×109/L,NEU2.92×109/L,Hb62 g·L-1,PLT25×109/L后出院。
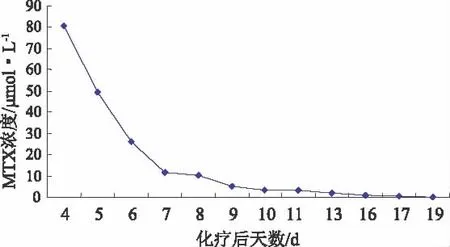
图2 抢救后MTX血药浓度变化图Fig 2 Changes of MTX plasma concentration after rescue
4 讨论
AFR是HD-MTX的不良反应之一,严重者可能导致患者死亡,如何减少或避免该不良反应成为临床使用该方案的重点。目前虽对MTX所致AFR的病例报道较多,但多数仅对其发生及治疗过程等进行简单报导,未系统分析机体状态、联合用药等可能影响MTX排泄的因素及药学服务情况。本文通过临床药师参与1例使用HD-MTX方案后出现AFR的病例的救治过程,分析出现排泄延迟的原因,提供相关药学服务,并结合临床药学实践工作,查阅相关文献,为临床医生提供实施该方案时的注意事项:
4.1 选择合适的治疗时机 该患者行HD-MTX冲击前肺CT显示存在少量胸腹水,这些生理性第三空间的存在可能导致MTX在胸腹水中蓄积,消除半衰期延长,出现排泄延迟的概率增大,毒性增加。而肾功能异常会使MTX排泄受限。因此,完善治疗前各项检查,选择合适的治疗时机尤为重要。
4.2 治疗前及治疗期间足量的水化碱化 MTX在人尿液中的溶解度与pH值有关,尿液pH7.5时MTX在尿中溶解度是pH5.5时的10倍[10]。在治疗过程中若尿液呈偏酸性,则使MTX易在肾内结晶沉积,引起急性肾损伤。因此要给予足量的水化及碱化,保证足够的尿量及适当的尿pH值。
4.3 避免使用可能存在相互作用的药物 目前,关于PPI制剂、抗感染药物如阿莫西林、苯唑西林、环丙沙星等、伊马替尼、非甾体类抗炎药等药物与HD-MTX联合使用时,可能导致 MTX排泄延迟已有较多报道[5,9,11-15],因此,治疗期间要尽量减少不必要的联合用药,必须使用时,也应避免选择可能存在相互作用的药物。
4.4 治疗期间各项指标的监测 如每日出入液体量,肾功能、尿pH值、MTX血药浓度监测等。尿量减少是预示出现肾功能损伤的因素之一,当患者出现尿量减少时,要注意监测肾功能,及早发现是否出现肾功能异常;尿pH值受食物、药物、疾病等多种因素影响,且肿瘤细胞的大量破坏也可能增加尿酸水平,因此,治疗期间也需要注意尿pH变化,根据变化调整碱化量;MTX血药浓度监测是调整CF解救量的根据,及时根据血药浓度调整CF用量既可以避免过度解救,也可以防止解救不足产生不良反应。
4.5 生活方式的干预 如少食多餐、避免进食刺激性及酸性食物,多食用清淡易消化食物、多饮水等,良好的生活方式也是减少不良反应发生、提高用药安全的关键之一。
临床药师在进行HD-MTX的药学实践时,通过以上注意事项,可以减少HD-MTX实施过程中出现排泄延迟及不良反应的发生概率。但结合临床实际,治疗期间加强各项指标的监测虽然可以早期发现不良反应,提早给予相应措施,但频繁样品采集会增加患者的困扰及治疗费用,因此,如何最大程度提高用药安全性、减轻患者生理及经济负担,在安全性及经济性之间寻找一平衡点,应成为今后临床药师工作的一项重要内容。
[1]Rask C,Albertioni F,Bentzen S M,etal.Clinical and pharmacokinetic risk factors for high-dose methotrexatevc-induced toxicity in chidren with acute lymphoblastic leukemia-alogistic regression analysis[J].Acta Oncol,1998,37(3):277-284.
[2]韩峰,张嵘,肇丽梅,等.大剂量甲氨蝶呤致急性肾功能不全2例[J].中国医院药学杂志,2009,29(2):175.
[3]杨薇,顾健.大剂量甲氨蝶呤化疗相关性肾衰竭[J].药物不良反应杂志,2010,12(6):426-428.
[4]徐卫群,汤永民,方澄清,等.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病排泄延迟分析[J].中华血液学杂志,2005,26(1):15-18.
[5]Santucci R,Leveque D,Lescoute A,etal.Delayed elimination of methotrexate associated with co-administration of proton pump inhibitors[J].Anticancer Res,2010,30(9):3807-3810.
[6]王弘,迟昨非,李爽,等.大剂量甲氨喋呤治疗180例儿童急性淋巴细胞白血病的疗效、副作用和血药浓度监测意义[J].中国实验血液学杂志,2011,19(4):949-952.
[7]Buchen S,Ngampolo D,Melton RG,etal.Carboxypeptidase G2 rescue in patients with methotrexate intoxication and renal failure[J].Br J Cancer,2005,92(3):480-487.
[8]Flombaum CD,Meyers PA.High-dose leucovorin as sole therapy for methotrexate toxicity[J].J Clin Oncol,1999,17(5):1589-1594.
[9]Suzuki K,Doki K,Homma M,etal.Co-administration of proton pump inhibitors delays elimination of plasma methotrexate in high-dose methotrexate therapy[J].Br J Clin Pharmacol,2009,67(1):44-49.
[10]Sand TE,Jacobsen S.Effect of urine pH and flow on renal clearance of methotrexate infusion[J].Cancer Chemother Pharmacol,1984,13(1):9-13.
[11]Ronchera CL,Hernandez T,Peris JE,etal.Pharmacokinetic interaction between high-dose methotrexate and amoxycillin[J].Ther Drug Monit,1993,15:375-379.
[12]Titier K,Lagrange F,Pehourcq F,etal.Pharmacokinetic interaction between high-dose methotrexate and oxacillin[J].T-her Drug Monit,2002 ,24(4):570-572.
[13]Dalle JH,Auvrignon A,Vassal g,etal.Interaction between methotrexate and ciprofloxacin[J].J Pediatr Hematol Oncol,2002,24(4):321-322.
[14]van hest RM,Schnog JB,Vantveer MB,etal.Extremely slow methotrexate elimination in a patient with t(9;22)positive acute lymphoblastic leukemia treated with imatinib[J].Am J Hematol,2008,83(9):757-758.
[15]Joerger M,Huitema AD,Bongard HJ,etal.Determinants of the elimination of methotrexate and 7-hydroxy-methotrexate following high-dose infusional therapy to cancer patients[J].Br J Clin Pharmacol,2006,62(1):71-80.
