药品不良事件数据挖掘研究进展
2013-01-04王丽伟于跃王伟吉林大学公共卫生学院医药信息与卫生管理学系吉林长春3002美国梅奥医学中心明尼苏达州5590
王丽伟,于跃,王伟 (.吉林大学公共卫生学院医药信息与卫生管理学系,吉林 长春3002;2.美国梅奥医学中心,明尼苏达州,5590)
近年来发生的一系列药品安全性事件严重威胁着人类的健康。据世界卫生组织(World Health Organization,简称WHO)统计,因药物不良事件住院的患者占住院人数的5%~10%,而住院患者中发生药物不良事件的人数达10%~20%,致死率为0.24%~2.9%[1],每一次药物不良事件都会延长2.2 d的住院时间[2],药物不良事件的发生日益成为一个严重的公共卫生问题。我国食品药品监督管理局对药物不良反应与药品不良事件进行了辨析:药品不良事件和药品不良反应含义不同。一般来说,药品不良反应是指因果关系已确定的反应,而药品不良事件是指因果关系尚未确定的反应。它在国外的药品说明书中经常出现,此反应不能肯定是由该药引起的,尚需要进一步评估[3]。根据《药品不良反应报告和监测管理办法》(卫生部令第81号),新的药品不良反应是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
20世纪60年代“反应停”(thalidomide)事件之后,许多国家引入了药物警戒(phamacovigilance)系统对上市药品进行监测。例如美国食品药品管理局(food and drug administration,FDA)的药物不良事件报告系统(adverse event reporting system,AERS)数据库主要用于发现那些在临床试验阶段由于出现频次低而没有被识别出的罕见严重不良事件。如果在AERS中发现潜在的安全问题,FDA将进行药物流行病学研究以进一步评价该不良事件,确定药物与不良事件之间的因果关系。基于对药物不良事件的安全评价,FDA可能采取一系列的法规调整以提高产品安全及保障公众健康,如更新药品说明信息,限制使用药品,向公众介绍新的安全相关信息,或在少数情况下,从市场上撤销该药品[4]。一项研究确定了自发报告数据库数据挖掘在药品安全性信号早期发现中的作用,研究结果发现,利用药品批准上市2~3年后的AERS数据进行挖掘,之后2~3年FDA的多半活动都可以通过数据挖掘来预测,而且数据挖掘所检测到的信号多半都可以与FDA所采取的措施相对应[5]。对自发病例报告的分析是发现上市药物未知的安全性问题的最重要方法之一[6]。
1 药品不良事件挖掘的数据来源
由制药商、监管机构和公共卫生监测中心维护的很多数据库都包含有药物上市后的不良反应报告信息,这些数据库都可用于药物安全性的数据挖掘研究。同样的研究也可应用于疫苗安全性数据库。这些数据库通过自愿或被动监测的自发报告系统获得不良反应信息。每个数据库都有自己的数据录入规范、结构和报告规范。所有的数据库都有一些局限性,如不良事件报告不全,与药物暴露数据没有明确联系,缺乏对照组,报告存在潜在的偏倚,数据的不完整或丢失,和因果关系不明。尽管存在这些复杂性,自发的不良反应数据库已经成功地在上市药品中发现众多安全问题。2002年,我国国家中心与各省级药物不良事件监测中心联网实现了省中心报告的电子化,但是数据库并不能公开获取且报告量较小,暂无法支持分析研究。
目前,最常应用于数据挖掘的国家数据库之一是美国FDA所公开发行的AERS。尽管它仍受到自愿上报计划和相关偏倚的限制,但它的优点在于它的数据向公众提供,并且包括大量药品不良反应的数据;这个数据库非常庞大(收集了从1968年以来的约4 300万条数据),并且除了国内的自发报告,该数据库还包括非美国来源的严重的不良反应报告和严重的药物上市后临床试验报告。FDA还在定量信号监测方面进行了开创性的工作,并且已经将这些方法应用于几种上市药品的决策支持。AERS系统的主要限制是时滞(通常有3~6个月的时滞)和在公开发行版本中病例叙述的缺失。公众可以索取带有叙述的病例报告,但是获得报告却需要几个月的时间[7]。
2 药品不良事件数据挖掘的国内外研究
2.1 单一药物与不良事件的数据挖掘
2.1.1 挖掘方法 数据挖掘工具通常能够帮助我们在庞大的带有嘈杂数据的数据库中找出有价值的优先信息,并且这些工具已经被医学研究所应用于药物警戒领域。现有的回顾性文献阐述了他们在药品安全性评估上的应用[8-10],但是目前还没有将这些工具的有效性与面对面式的基于案例的传统方法相比较的前瞻性研究。进行数据挖掘研究的挑战是缺乏评估其挖掘有效性的金标准与如何判定可疑安全性问题的阈值。
1974年,Finney描述了“反应比值信号”(reaction proportion signaling)的概念。利用数据库中的所有记录,可以构建出四格表,然后即可以确定出比值失衡的药品——不良事件组合,用来检测信号[11],见表1。目前,在药物不良事件监测领域中常用的数据挖掘方法都属于或者基于比值失衡测量法(disproportionality measures,DPA),主要是用于对药品——不良事件之间关联的“出乎意料”程度进行定性[12],通常要使用预先设定的比值失衡阈值来筛选潜在的不良事件,然后进行更深入的调查。
目前常用的数据挖掘方法包括美国FDA使用的多项伽玛泊松分布缩减法(multi-item gamma poisson shrinker,MGPS);WHO Uppsala监测中心使用的贝叶斯判别可信区间传播神经网络法(Bayesian confidence propagation neural network,BCPNN);英国药品管理局使用的比例报告比值比(proportional ADR reporting ratio,PRR),以及其他国家自发报告中心和药品安全研究机构使用的报告比值比(reporting odds ratio,ROR)及发病率比值(incidence rate ratios,IRRs)等。诸多数据挖掘方法应用于药品不良反应信号的检出和分析都是可行的,没有哪种单一的方法能够完全优于或完全取代其他方法,可根据不同的研究目的选择一种或多种适宜的算法[13]。
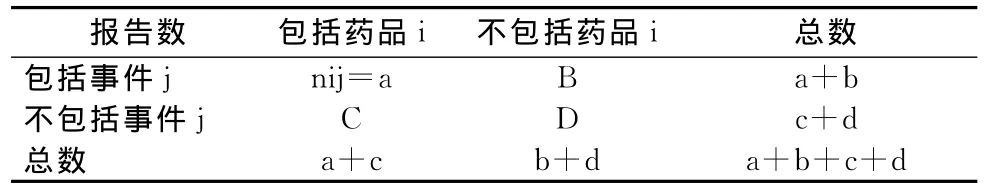
表1 比值失衡测量法所基于的四格表Tab 1 The 2×2 contingency table for DPA method
PRR,ROR和IRRs属于频次法(frequency methods),主要计算数据库中某种药物报告频次相对于利用数据库中全部药物信息估算的预期报告频次是否更高。例如PRR=[a/(a+c)]/[b/(b+d)]测量的就是包括某种药物的报告中某些事件的发生率与不包括某种药物的报告中该事件的发生率的比值。MGPS与BCPNN属于贝叶斯方法,这种方法在频次法的基础上使用贝叶斯统计模型对结果进一步处理,可以有效减少由于年龄、性别等背景因素的差别,并作出更准确的估算[14]。
2.1.2 数据挖掘内容 对单一药物不良事件信号的海量数据挖掘和药品警戒已经成为医学信息学领域当前的研究热点。例如:Poluzzi等[15](2009)利用数据挖掘方法发现了抗菌剂利奈唑胺(linezolid)、卡泊芬净(caspofungin)、泊沙康唑(posaconazole)、印地那韦(indinavir)与那非那韦(nelfinavir)导致尖端扭转型室速的不良事件信号;Ali等[16]发现阿利吉仑(aliskiren)具有潜在的血管神经性水肿和肾功能不全不良事件[16];Chen等[17]发现了泰利霉素(telithromycin)相关的肝毒性;Kadoyama等[18-20]发现了紫杉醇及紫杉萜类抗癌药品的过敏反应以及铂类抗癌药品的不良事件。
Davis等[21]撰文列举了英国过去十年间将自发性报告作为充分理由进行药物管理活动的例子。Wysowski等[22]列出了1980-2005年期间从美国市场上撤销的22种药品,其中20种药品的撤出依赖于对自发不良事件报告的分析。曲格列酮(troglitazone)、特非那丁(terfenadine)和替马氟沙星 (temafloxacin)也是自发报告提供关键证据支持药品撤销的显著例子[23-24]。
2.2 多种药物相互作用与不良事件的数据挖掘 当一种药物影响到另一种药物的作用时即发生药物相互作用。这种作用可能会导致药动学或者药效学上的改变,从而提高或者降低药物的功效,可能导致不良事件报告数量的增加或减少。对药物相互作用不良事件数据挖掘的思路基本上是从单一药物不良事件挖掘的原则拓展得到的,即如果两者药物联合使用时可疑的不良事件报告比单独使用药物时的可疑不良事件报告更频繁,那么这两种药物的组合可能存在药物之间的相互作用。但是对药物相互作用不良事件数据挖掘的研究难度较大,现有的方法研究都属于探索性研究。有研究通过逻辑回归分析利用不良事件的报告比值比(reporting odds ratios,ROR)来检测可能出现的药物相互作用[25]。也有学者提出使用加性模型(additive model)与 (multiplicative model)检测药物相互作用产生的不良事件信号,结果发现加性模型在检测信号方面更加敏感,而乘性模型在对由加性模型所检测出的信号强度的定性方面会有所助益[26]。另有研究在多种药物相互作用产生不良反应的数据挖掘中探索使用了相关规则挖掘方法,认为该方法在初步检测药物相互作用的不良事件方面是有效[27]。Tatonetti等[28]利用监督机器学习的方法检测出隐藏的药物相互作用并利用电子病历对研究结果进行了验证。这种方法也可以用于发现新的药物相互作用,提供了一种利用不良事件数据来研究体外药物相互作用的重要方法。
目前对多种药物相互作用情况下大规模数据挖掘的方法并不成熟,药物相互作用的挖掘方法还处于改进和研发阶段,也是未来的研究趋势之一。
2.3 我国药品不良事件数据挖掘研究现状 国内也有少数学者对该领域进行了探索研究。叶小飞[1](2011)研究了基于自发呈报系统与循证医学的药物不良事件信号挖掘,对上海市药物不良事件监测中心2009年30 105条数据进行了分析;尚鹏辉等人[13](2009)分析介绍了各种数据挖掘技术;钱轶峰等[29](2010)介绍比较了联合用药不良事件信号的数据挖掘方法。国内相关研究主要利用我国国内的药物不良事件数据库进行信号挖掘,或者探讨药物不良事件数据挖掘的方法,或者对美国AERS数据挖掘及应用进行简介,对药品不良事件数据挖掘的研究尚属初级阶段,应用于挖掘的不良事件报告数量较小且研究较少。
3 药物不良事件数据挖掘案例分析
本文选取Kadoyama等[18]的研究作为药物不良事件数据挖掘研究的实例分析,该课题组对AERS数据库中抗癌药物过敏反应案例进行了数据挖掘,以探测紫杉醇等抗癌药物的不良事件。其首先利用文本挖掘方法,将数据库中不规范的药物名称进行了修正;然后利用美国国立癌症研究所规定的不良事件术语规范词表(the national cancer institute common terminology criteria for adverse events,NCI-CTCAE version 4.0)对数据库中抗癌药物相关的过敏不良事件名称进行了规范;接下来对紫杉醇、多烯紫杉醇等抗癌药物的过敏不良事件根据轻微、严重和致死3个层次进行了统计;然后分别利用PRR、ROR、信息成分(information component,IC)和经验贝叶斯几何平均数(empirical Bayes geometric mean,EBGM)4种算法对不良事件数据进行挖掘,对11种产生过敏不良反应的抗癌药物进行了探测(致死过敏不良反应探测情况如表2所示);结论认为通过数据挖掘,探测出紫杉醇可能会产生轻微、严重以至于致死的不良事件,多烯紫杉醇探测出可能会产生致死的不良事件,而甲基苄肼、天冬氨酰酶、替尼泊苷、依托泊苷等药物并没有足够的不良反应事件总数用以进行数据挖掘探测;最终认为使用数据挖掘方法对AERS数据库进行数据挖掘来确认药物的不良事件是可靠而有效的。
4 展望
4.1 研究新的数据挖掘方法 患者用药的状况通常比较复杂,不良事件的发生很多情况下也有多种药物相互作用的原因,然而目前多数研究所使用的数据挖掘算法主要用于确定某种药品与某种不良事件之间的关系,针对预先选择的某几种药品挖掘其不良事件信号,少数研究针对药物-药物相互作用,但是研究对象仅限于谨慎选择的少数药物[25-26],主要原因是缺乏对多种药物相互作用情况下大规模数据挖掘的方法。对药物相互作用的新算法的探索性研究还不能真正应用到相应的国家级药物不良事件报告数据库的常规性检测,如何从海量数据库中药物相互作用的数据中进行知识发现,获得成熟的挖掘方法,是一个亟待解决的问题。
4.2 建立标准化的药品不良事件知识库 AERS数据库是目前免费获取的主要数据库,其中的报告来自患者、卫生医务人员、律师等人,自由的录入方式导致药名存在不同写法甚至拼写错误。如果直接利用数据库中所录入的非标准化名称进行挖掘,会造成同种药物不良反应信号被数据噪声所影响,从而无法准确统计与分析,因此在数据挖掘之前,需要对药品数据集中的药名进行标准化,将不同形式的药名统一到同一概念下。已有的研究对药名进行的标准化都是在特定的挖掘目的下进行的,标准化后的数据主要用于具体研究的具体目的,没有考虑到与其他卫生领域的数据进行互操作,也无法进行二次利用。RxNorm是美国国立医学图书馆开发并提供免费使用的临床药品标准术语[30]。在2004年创建之后,RxNorm已越来越多地被生物医学信息学领域作为一种新兴的临床药品信息交换标准。利用RxNorm对AERS数据库中的药名进行标准化,并为给学界提供一个免费、可以重复利用的药品不良事件知识库,将促进不良事件信号的挖掘研究。
4.3 利用其他电子健康数据验证不良事件信号 临床数据是验证数据挖掘所建立假说的一个关键因素[31]。从数据挖掘分析中所得到的药物不良事件信号被视为假说,并需要进行进一步的调查(通过个别病历的回顾和其他的相关信息如文献或前期临床试验)来确定这些报告是否提供了可信的安全性资料。目前多数的数据挖掘研究局限于产生假说,仅有少数的综合性研究通过电子病历中的数据对所检测出的药物不良事件进行验证。随着卫生数据标准的不断发展,对数据进行标准化并与电子病历数据互联,可实现对假说的进一步验证,是该领域研究的未来发展方向之一。
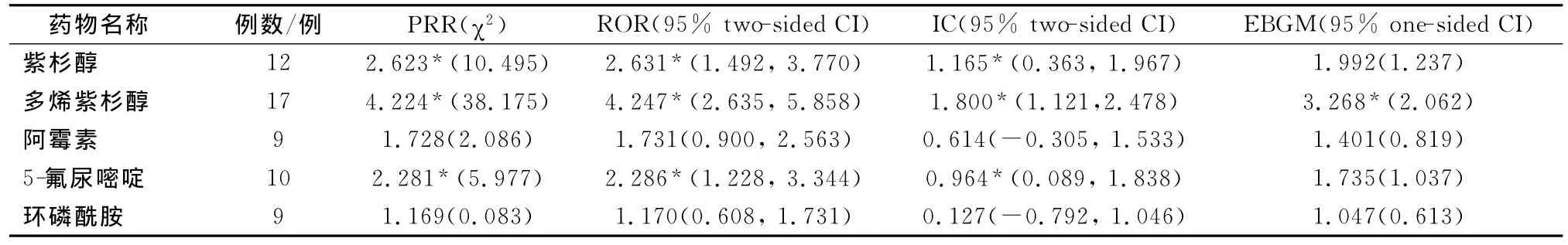
表2 抗癌药物致死过敏不良事件的信号探测[18]Tab 2 Signal detection for anticancer agent-associated lethal hypersensitivity reactions[18]
5 结语
从国际视角来看,药物不良事件的数据挖掘是医学信息学以及药物警戒领域的一个比较活跃的研究领域,相对成熟的挖掘方法已经在国家级的药物不良事件报告数据库的挖掘中发挥重要作用,同时新的挖掘方法例如相关规则挖掘方法与机器学习等不断被改进、引入到该领域,以期获得更加可靠和准确的结果。从药物不良事件数据库的海量数据中挖掘药物不良事件信号是药品管理及决策的重要基础,并将为医学科研节省大量资源,为疾病的防治发现重要依据,对于提高医疗质量具有重要意义。
[1]叶小飞.基于自发呈报系统与循证医学的药品不良反应信号挖掘[D].第二军医大学,2011.
[2]Handler SM,Altman RL,Perera S,etal.A systematic review of the performance characteristics of clinical event monitor signals used to detect adverse drug events in the hospital setting[J].J Am Med Inform Assn,2007,14(4):451-458.
[3]国家食品药品监督管理总局.[DB/OL],[2013.2.15].http://www.sda.gov.cn/WS01/CL0747/63731.html.
[4]FDA adverse event reporting system (FAERS) (formerly AERS).[EB/OL].[2013-7-15].http://www.fda.gov/cder/aers/default.htm.
[5]Hochberg AM,Reisinger SJ,Pearson P,etal.Using data mining to predict safety actions from FDA adverse event reporting system data[J].Drug Inform J,2007,41(5):633-642.
[6]Rawlins M.Spontaneous reporting of adverse drug reactions.I:the data[J].Br J Clin Pharmaco,1988,26(1):1.
[7]Almenoff JS PE,Gibbs TG,DuMouchel W,etal.Novel statistical tools for monitoring the safety of marketed drugs[J].Clin Pharmacol Ther,2007,82(2):157-166.
[8]Szarfman A,Machado SG,ONeill RT.Use of screening algorithms and computer systems to efficiently signal higher-Than-Expected combinations of drugs and events in the US FDAs spontaneous reports database[J].Drug Safety,2002,25(6):381-392.
[9]Lindquist M,Stahl M,Bate A,etal.A retrospective evaluation of a data mining approach to aid finding new adverse drug reaction signals in the WHO international database[J].Drug Safety,2000,23(6):533-542.
[10]Almenoff J,Tonning JM,Gould AL,etal.Perspectives on the use of data mining in pharmacovigilance[J].Drug Safety,2005,28(11):981-1007.
[11]Finney DJ.Systemic signalling of adverse reactions to drugs[J].Methods Inf Med,1974,13(1):110.
[12]Bate A,Evans SJ.Quantitative signal detection using spontaneous ADR reporting[J].Pharmacoepidemiol Drug Saf,2009,18(6):427-436.
[13]尚鹏辉,詹思延.数据挖掘在药物不良事件信号检出和分析中的应用 [J].中国药品应用与监测,2009,6(3):187-190.
[14]Szarfman A,Tonning JM,Levine JG,etal.Atypical antipsychotics and pituitary tumors:apharmacovigilance study[J].J Human Pharmacol Drug Therapy,2006,26(6):748-758.
[15]Poluzzi E,Raschi E,Motola D,etal.Antimicrobials and the risk of torsades de pointes:the contribution from data mining of the US FDA Adverse Event Reporting System [J].Drug Safety,2010,33(4):303-314.
[16]Ali AK.Pharmacovigilance analysis of adverse event reports for aliskiren hemifumarate,a first-in-class direct renin inhibitor[J].Thera Clin Risk Manag,2011,7:337.
[17]Chen Y,Guo JJ,Healy DP,etal.Risk of hepatotoxicity associated with the use of telithromycin:a signal detection using data mining algorithms[J].Ann Pharmacotherapy,2008,42(12):1791-1796.
[18]Kadoyama K,Kuwahara A,Yamamori M.Hypersensitivity reactions to anticancer agents:Data mining of the public version of the FDA adverse event reporting system,AERS[J].J Exper Clin Cancer Res:CR,2011,30(1):93.
[19]Sakaeda T,Kadoyama K,Okuno Y.Adverse event profiles of platinum agents:Data mining of the public version of the FDA adverse event reporting system,AERS,and reproducibility of clinical observations[J].Int J Med Sci,2011,8(6):487.
[20]Sakaeda T,Kadoyama K,Yabuuchi H,etal.Platinum agentinduced hypersensitivity reactions:Data mining of the public version of the FDA adverse event reporting system,AERS[J].Int J Med Sci,2011,8(4):332.
[21]Davis S,King B,Raine JM.Spontaneous reporting UK [J].Pharmacovigilance,2002:199-215.
[22]Wysowski DK,Swartz L.Adverse drug event surveillance and drug withdrawals in the United States,1969-2002:the importance of reporting suspected reactions[J].Arch Inter Med,2005,165(12):1363.
[23]Moore TJ,Psaty BM,Furberg CD.Time to act on drug safety[J].JAMA,1998,279(19):1571-1573.
[24]Cruzan S.FDA Talk Paper:FDA proposes to Withdraw Seldane Approval[R].1997.
[25]Van Puijenbroek EP,Egberts ACG,Meyboom RHB,etal.Signalling possible drug drug interactions in a spontaneous reporting system:delay of withdrawal bleeding during concomitant use of oral contraceptives and itraconazole[J].Br J Clin Pharmacol,1999,47(6):689-693.
[26]Thakrar BT,Grundschober SB,Doessegger L.Detecting signals of drug drug interactions in a spontaneous reports database[J].Br J Clin Pharmacol,2007,64(4):489-495.
[27]Harpaz R,Chase H,Friedman C.Mining multi-item drug adverse effect associations in spontaneous reporting systems[J].BMC bioinformatics,2010,11(Suppl 9):S7.
[28]Tatonetti NP,Fernald GH,Altman RB.A novel signal detection algorithm for identifying hidden drug-drug interactions in adverse event reports[J].J Am Med Inform Assoc,2012,19(1):79-85.
[29]钱轶峰,罗宝章,叶小飞,等.检测联合用药不良事件信号的数据挖掘方法 [J].中国卫生统计2010,27(1):31-34.
[30]An Overview of RxNorm.[DB/OL],[2013.1.15].http://www.nlm.nih.gov/research/umls/rxnorm/overview.html.
[31]Ritchie MD,Denny JC,Crawford DC,etal.Robust replication of genotype-phenotype associations across multiple diseases in an electronic medical record[J].Am J Human Gen,2010,86(4):560-572.
