华法林基于药物基因组学个体化给药方案的评价
2013-01-04刘俊徐航葛卫红陈小芳皖南医学院弋矶山医院药剂科安徽芜湖400南京大学医学院附属南京鼓楼医院江苏南京0008
刘俊,徐航,葛卫红,陈小芳 (.皖南医学院弋矶山医院药剂科,安徽 芜湖400;.南京大学医学院附属南京鼓楼医院,江苏 南京0008)
华法林(warfarin)是20世纪40年代美国Wisconsin大学合成的临床最常用的防治血栓栓塞的口服抗凝药,因其具有抗凝和溶栓双重调节作用、疗效显著、作用持续时间长、服用方便、价格低廉而应用于心脏人工瓣膜置换术后、非瓣膜性心房纤颤或心房扑动、肺栓塞以及深静脉血栓抗凝的治疗。因华法林血药浓度与疗效存在明显个体差异、药物安全范围窄且存在较多的影响因素,故华法林的临床治疗剂量不易掌握。华法林用量不足容易形成血栓,使用过量可增加出血风险。较为科学的给药方式是通过监测患者的凝血酶原时间-国际标准化比值(PT-INR),将INR控制在理想的抗凝强度范围内,而达到抗血栓且不增加出血风险的目的。
近年来,随着遗传药理学和华法林基因多态性研究日益成熟,遗传因素与华法林个体剂量的关系得到广泛认可,美国食品药品监督管理局(FDA)于2007年8月要求将细胞色素P4502C9(CYP2C9)和维生素K环氧化物还原酶复合体亚单位1(VKORC1)基因型检测纳入华法林说明书中的警示信息栏内,医药界开始不断尝试通过对患者进行基因型检测,以求建立华法林个体化给药模型,如Wen模型[1]、Ohno模型[2]等。通过基于药物基因组学的华法林个体化给药模型以确定华法林抗凝治疗的适宜剂量,达到个体化给药[3]目的。此外,国际华法林药物基因组联合会(international warfarin pharmaeogenetics consortium,IWPC)收集了5 700例来自4大洲9个国家的21个研究机构使用华法林达到稳定临床疗效的患者信息,并建立数据库。Klein等[4]对此数据库进行筛选和验证,建立了IWPC模型,是目前涉及病例规模最大的模型。通过对心脏瓣膜手术患者进行基因检测,并利用IWPC模型计算出华法林预测剂量,同时对患者进行PTINR监测,可以依据监测结果调整华法林至稳定剂量,并比较华法林的预测剂量与稳定剂量的差异,以了解基因检测在确定华法林合适剂量中的临床应用价值。
1 资料与方法
1.1 临床资料 选取南京鼓楼医院心胸外科2012年1月-2012年6月行心脏瓣膜手术患者425例,记录患者基本信息,包括性别、年龄、体质量、身高、体质量指数、体表面积、瓣膜手术类型、肝肾功能、合并用药和疾病状态等。(1)纳入标准:患者年龄≥18岁,汉族人;华法林均需达到稳定剂量,即华法林连续服用时间≥3个月,连续4次INR达目标抗凝强度,监测间隔时间至少为1周。(2)排除标准:心功能Ⅲ级或以上;肝功能不全,血清转氨酶大于正常值3倍或胆红素大于正常值2倍;肾功能不全,血清肌酐值≥200μmol·L-1;严重营养不良;妊娠期妇女;甲状腺功能异常者。
按照预先设定的标准,共纳入407例患者,将其随机分为对照组和试验组,试验组在进行华法林抗凝治疗前给予基因型检测。
1.2 抗凝标准 采用低强度抗凝标准,其中瓣环植入、生物瓣膜置换、主动脉瓣机械瓣置换(aortic valve replacement,AVR)INR控制在1.6~2.2,二尖瓣机械瓣置换(mitral valve replacement,MVR)、主动脉瓣及二尖瓣双瓣机械瓣置换(double valve replacement,DVR)INR控制在1.8~2.5。
1.3 抗凝治疗 所有患者术后24~48 h开始给予华法林(芬兰奥立安药业,3.0mg·片-1)抗凝治疗。对照组按照患者体质量确定华法林初始剂量为3.0~4.5 mg·d-1,试验组根据“基因检测报告”中患者基因型并结合美国FDA建议的华法林初始剂量确定华法林首次剂量,见表1。瓣环植入、生物瓣置换、AVR患者采取就低原则,MVR、DVR患者采取就高原则。“基因检测报告”结果建议的初始剂量为3.0~4.0mg·d-1,瓣环植入、生物瓣置换、AVR患者服用3.0mg·d-1,MVR、DVR患者服用3.75 mg·d-1。

表1 美国FDA建议的华法林初始剂量(mg·d-1)Tab 1 The initial doses of warfarin recommended by FDA in USA (mg·d-1)
对照组华法林口服第2天开始每日监测PTINR值,依据监测结果调整华法林剂量至目标抗凝强度。试验组华法林自第2剂开始按“基因检测报告”预测剂量,采用就近原则服用,维持剂量服用2剂后,每日监测PT-INR值,并根据INR值调整华法林剂量。举例:“基因检测报告”结果预测剂量为3.15 mg·d-1,则患者实际应服用3.0mg·d-1,2 d后根据INR值进行剂量调整;“基因检测报告”结果预测剂量为3.65 mg·d-1,则患者实际应服用3.75 mg·d-1,2 d后根据INR值进行剂量调整。
1.4 基因型检测 取外周静脉血2 mL,-20℃保存;利用全血基因组抽提试剂盒(上海百傲科技有限公司,BST01010)提取患者基因组DNA,-20℃冷冻保存;分批将提取好的基因组DNA进行CYP2C9*3、VKORC1-1639位点聚合酶连反应(PCR),对所需片段进行扩增,采用限制性片段长度多态性(RFLP)方法和测序技术对患者进行基因检测,并利用BE-2.0基因图象分析软件(软件登记号:2002SR3064)确定患者基因分型。
1.5 模型验证[5]比较试验组和对照组住院期间华法林抗凝治疗时间、华法林用药3,5,7 d及出院前INR达标率、药物不良反应发生情况以及华法林稳定剂量。将试验组患者的基因型和其他信息代入IWPC给药方程中,计算华法林预测周剂量(mg·wk-1),再进一步确定华法林预测日剂量(mg·d-1)。比较华法林预测日剂量与华法林稳定日剂量的差值,包括绝对差值和百分绝对差值。其中绝对差值=预测剂量-稳定剂量;百分绝对差值=(预测剂量-稳定剂量)/稳定剂量×100%。以华法林稳定剂量为纵坐标,华法林预测剂量为横坐标作散点图,并得到拟合直线,对华法林稳定剂量与预测剂量进行相关性分析并以拟合指数R2作为判断模型准确性的指标,R2小于0.50提示模型准确性较差。
1.6 统计学处理 采用SPSS 11.5统计软件包进行各项统计分析。计量资料以±s表示,进行t检验,计数资料以频数表示,研究对象 Hardy-Weinberg遗传平衡的符合程度、组间基因型及等位基因频率等计数资料的比较进行χ2检验,以P<0.05为差异有统计学意义,并采用线性回归分析比较华法林稳定剂量与预测剂量的相关性。
2 结果
2.1 患者基本情况 试验组203例(49.88%),对照组204例(50.12%),2组患者基本信息比较差异无统计学意义,详见表2。
表2 试验组和对照组患者基本信息(±s)Tab 2 The general information of patients in the test group and the control group(±s)
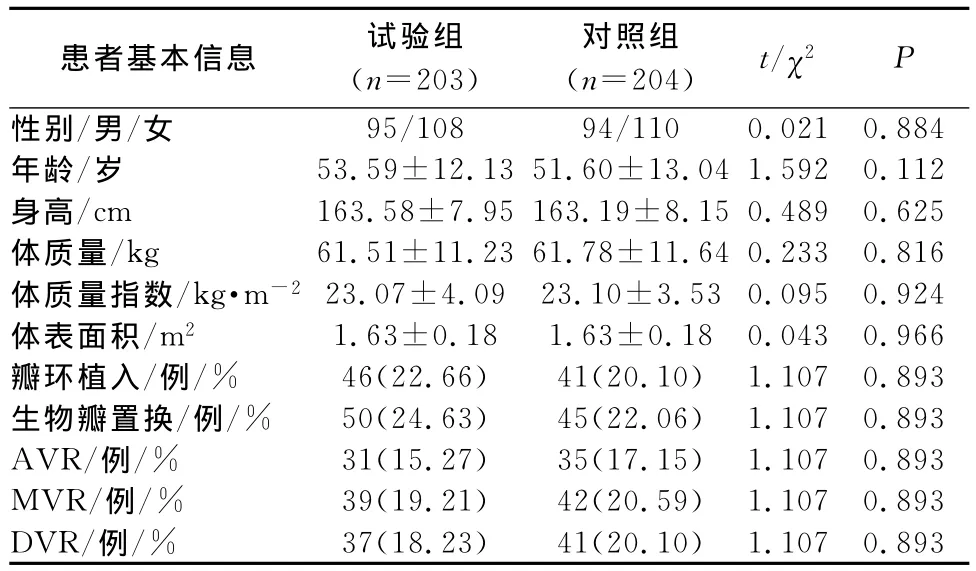
表2 试验组和对照组患者基本信息(±s)Tab 2 The general information of patients in the test group and the control group(±s)
患者基本信息 试验组(n=203)对照组(n=204) t/χ2P性别/男/女 95/108 94/110 0.021 0.884年龄/岁 53.59±12.13 51.60±13.04 1.592 0.112身高/cm 163.58±7.95 163.19±8.15 0.489 0.625体质量/kg 61.51±11.23 61.78±11.64 0.233 0.816体质量指数/kg·m-2 23.07±4.09 23.10±3.53 0.095 0.924体表面积/m2 1.63±0.18 1.63±0.18 0.043 0.966瓣环植入/例/% 46(22.66) 41(20.10) 1.107 0.893生物瓣置换/例/% 50(24.63) 45(22.06) 1.107 0.893 AVR/例/% 31(15.27) 35(17.15) 1.107 0.893 MVR/例/% 39(19.21) 42(20.59) 1.107 0.893 DVR/例/% 37(18.23) 41(20.10) 1.107 0.893
2.2 基因检测结果 按照患者CYP2C9*3基因型不同分为AA(*1/*1)型和 AC(*1/*3)型,VKORC1-1639G/A基因型分为 AA型、GA型和GG型,所有基因分布符合Hardy-Weinberg遗传平衡(P>0.05),见表3。

表3 CYP2C9*3和VKORC1-1639基因型与等位基因的频率分布(例,%)Tab 3 Allelic frequency and genotypic frequency of CYP2C9*3 and VKORC1-1639(cases,%)
2.3 华法林抗凝治疗结果 随着抗凝治疗时间的延长,INR达标率逐渐上升,且试验组INR在抗凝治疗3,5 d及出院前达标率均明显高于对照组(P<0.01),但两组华法林总的用药时间和华法林稳定剂量比较,差异无统计学意义。住院期间两组患者均未出现血栓栓塞事件,试验组发生轻度出血2例,其中皮下出血1例,鼻出血1例,对照组出现3例鼻出血,给予对症处理后好转。2组患者华法林抗凝治疗情况见表4,图1。
表4 2组患者华法林抗凝治疗基本情况(±s)Tab 4 The general situation of warfarin anticoagulation in the two groups(±s)

表4 2组患者华法林抗凝治疗基本情况(±s)Tab 4 The general situation of warfarin anticoagulation in the two groups(±s)
观察指标 试验组(n=203)对照组(n=204) t/χ2P用药天数/d 10.44±5.68 9.96±3.54 1.030 0.304华法林稳定剂量/mg·d-1 3.00±1.23 3.05±1.01 0.439 0.661不良反应/例/% 2(0.99) 3(1.47) 0.198 0.657
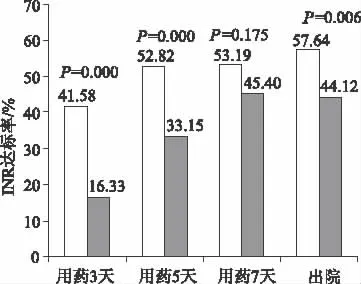
图1 2组患者华法林抗凝治疗不同时间点INR达标率Fig 1 INR target rate of warfarin anticoagulation in different time of the two groups
试验组华法林预测剂量为(3.36±0.77)mg·d-1,明显高于华法林稳定剂量(3.00±1.23)mg·d-1(t=34.88,P=0.000),其绝对差值为(0.83±0.61)mg·d-1,百分绝对差值为(37.36±48.51)%,且华法林预测剂量与稳定剂量存在相关性(P=0.000,r=0.332,R2=0.110),其相关性曲线见图2。
3 讨论

图2 华法林模型预测剂量与稳定剂量的相关性(n=203,P=0.000,R2Linear=0.11)Fig 2 The correlation diagram of warfarin prediction doses and stability doses(n=203,P=0.000,R2Linear=0.11)
3.1 CYP2C9、VKORC1基因多态性与华法林个体剂量关系 华法林在体内主要通过肝脏CYP2C9代谢为无活性的6-和7-羟基化合物。CYP2C9基因存在野生型CYP2C9*1和变异型CYP2C9*2~CYP2C9*13[6],其中与华法林代谢最密切基因突变型为CYP2C9*2和CYP2C9*3。CYP2C9*2和CYP2C9*3变异可使CYP2C9酶活性降低,华法林的代谢及消除减少而导致发生出血症状。研究表明[7-8],携带 CYP2C9*2或 CYP2C9*3等位基因的患者较携带CYP2C9*1/*1的患者,华法林日均剂量明显减少(P<0.000 1),华法林过量的发生率较高。
VKORC1对凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ和抗凝蛋白C、S的活化起关键作用,华法林为VKORC1特异性抑制剂,阻碍维生素K由环氧化物转化为氢醌型,阻断凝血因子的活化而发挥抗凝作用。VKORC1主要由VKORC1基因编码,VKORC1在其启动子区存在-1639G/A 及-1173C/T 位点多态性,这两个多态性位点与华法林剂量的个体差异有密切关系。国内外研究资料表明[9-10],VKORC1的基因多态性对华法林剂量及维持时间均有明显影响(P<0.05)。
3.2 CYP2C9和VKORC1基因突变频率CYP2C9和VKORC1基因突变频率存在明显民族和种族分布差异。CYP2C9*2和CYP2C9*3等位基因突变频率在高加索人群中较高,分别达到8%~20%和6%~10%,而在亚洲人群中比较少,CYP2C9*2的突变型稀有或缺失,CYP2C9*3的突变型也仅有1%~4%[11]。本次研究发现,在中国汉族人群中,CYP2C9*3以野生型(AA型)为主,占总数的95.07%,CYP2C9*3基因突变型(AC型)频率为4.93%,略高于文献报道,未检测到CYP2C9*2的突变型。亚洲人VKORC1基因型以-1639AA型和-1173TT型为主。Yang等[12]研究显示,亚洲人群 VKORC1-1639AA、GA、GG基因型频率分别为80.4%,18.3%和1.3%,而西方高加索人群分别为16.3%,48.9% 和36.7%;VKORC1-1173TT、CT、CC 基因型频率分别为81.8%,16.8%,1.4%,高加索 人分别 为17.3%,47.4% 和33.5%。顾强等[13]研究表明,中国重庆地区汉族人VKORC1-1639AA型为86%,GA和 GG分别为12% 和 2%。结果显示,VKORC1-1639AA 型81.77%,GA 型17.24%,GG 型0.99%,与文献报道[12-13]基本一致。
3.3 华法林基于基因检测个体化给药评估 华法林预测剂量与稳定剂量虽存在一定相关性,但也存在差异,预测剂量明显高于稳定剂量(P=0.000),其绝对差值为(0.83±0.61)mg·d-1,百分绝对差值为(37.36±48.51)%,高于国内相关文献报道[5]。R2值为0.11,表明本研究对纳入对象采用IWPC模型预测华法林稳定的给药剂量准确性较差,且由表4可知,试验组和对照组华法林抗凝治疗时间、华法林稳定剂量及不良反应发生率均无明显差异(P>0.05),但有意义的是试验组华法林在治疗3,5 d和出院前的INR达标率明显高于对照组(P<0.01),尤其是在华法林治疗前5 d,INR达标率明显提高(P=0.000),这可以减少因仅凭患者体质量值确定华法林首次剂量带来的治疗盲目性,上述结果提示患者基因型检测对于指导华法林抗凝治疗具有一定的临床意义,尤其在确定华法林初始治疗剂量,提高华法林初始治疗抗凝达标率方面具有指导意义。
华法林预测剂量与稳定剂量存在偏差,可能与IWPC模型纳入人群的基本特征背景与本研究人群的基本特征背景存在差异有关。IWPC模型具有明确的种族特征,其纳入的主要人群为高加索人,由于基因型、饮食习惯及地域分布不同,亚洲人对华法林的敏感性显著高于高加索人,达到相同抗凝强度亚洲人所需的华法林剂量要低于高加索人[4-5]。另外,IWPC模型采用中等强度抗凝标准,其INR值为2.0~3.0(目标值2.5),而本次研究采用的是低强度抗凝标准,这可能是导致华法林预测剂量明显高于华法林稳定剂量的另一原因。本次研究仅检测了患者CYP2C9、VKORC1基因型,研究表明[14],华法林的抗凝疗效还受到CYP4F2、CYP2A6、载脂蛋白E(ApoE)、γ谷氨酰羧化酶(GGCX)、多药耐药基因(MDR1)等基因的调控。因此,单凭 CYP2C9、VKORC1基因型确定华法林预测剂量可能是导致华法林预测剂量明显高于华法林稳定剂量的又一原因。此外,生活方式、生理病理状态、药物等非遗传因素对华法林抗凝治疗亦存在显著影响[15]。如腹泻、发热、吸烟、饮酒等均可减弱华法林抗凝作用,而肝肾功能不全会影响机体对华法林的代谢和消除,导致华法林消除半衰期延长造成华法林体内蓄积,从而增强其抗凝作用。此外,药物相互作用亦可影响华法林的疗效,非甾体抗炎药如阿司匹林、布诺芬、塞来昔布等可提高华法林游离血药浓度,增强抗凝作用;第二、三代头孢菌素、甲硝唑、阿奇霉素、克拉霉素、氟喹诺酮类等可抑制肠道细菌产生维生素K,使维生素K生成和吸收减少,维生素K依赖性凝血因子的合成障碍,亦可增强华法林的抗凝作用;胺碘酮、氟康唑等通过抑制华法林体内代谢而增强其抗凝作用;银杏叶提取物、丹参、当归、红花等活血化瘀类中药制剂可抑制血小板聚集,与华法林产生协同抗血栓作用。
4 讨论
尽管CYP2C9、VKORC1在解释华法林个体差异起着关键作用,但仍有近50%的剂量差异无法得到解释[16]。因此,FDA并未强制各医疗机构在进行华法林抗凝治疗前开展此类基因检测。本次研究亦发现单纯依据基因检测来确定华法林剂量存在一定偏差,还需结合其他临床因素来确定华法林最终维持剂量,提高华法林抗凝治疗的准确性和有效性。由于纳入的样本量较小,基因检测能否真正运用临床为临床治疗提供科学理论依据还需大规模临床验证,以期建立适合汉族人的华法林个体化给药模型,减少单凭临床经验进行抗凝治疗的弊端,科学指导临床进行华法林抗凝治疗,在发挥华法林抗凝作用同时,降低华法林抗凝过量带来的出血风险。
[1]Wen MS,Lee M,Chen JJ,etal.Prospective study of warfarin dosage requirements based on CYP2C9 and VKORC1 genotypes[J].Clin Pharamacol Ther,2008,84(1):83-89.
[2]Ohno M,Yamamoto A,Ono A,etal.Influence of clinical and genetic factors on warfarin dose requirements among Japanese patients[J].Eur J Clin Pharamacol,2009,65(11):1097-1103.
[3]Aomori T,Obayashi K,Fujita Y,etal.Influence of CYP2C9 and vitamin K oxide reductase complex(VKORC)1 polymorphisms on time to determine the warfarin maintenance dose[J].Pharmazie,2011,66(3):222-225.
[4]Klein TE,Altman RB,Eriksson N,etal.Estimation of the warfarin dose with clinical and pharmaeogenetic data[J].N Engl J Med,2009,360(8):753-764.
[5]余靓平,宋洪涛,曾志勇,等.基于药物基因组学的华法林给药模型的验证[J].中华心血管病杂志,2012,40(7):614-619.
[6]娄莹,李一石.华法林的药物基因组学及其合理应用[J].药物不良反应杂志,2011,13(1):32-37.
[7]Mikheeva IuA,Kropacheva ES,Ignat′ev IV,etal.Cytochrome P4502C9(CYP2C9)gene polymorphism and safety of therapy with warfarin[J].Kardiologiia,2008,48(3):52-57.
[8]张婷,胡永芳.中国人群华法林药效与细胞色素P4502C9基因多态性关系的系统评价和荟萃分析[J].中国临床药理学杂志,2009,25(6):526-529.
[9]Aomori T,Obayashi K,Fujita Y,etal.Influence of CYP2C9 and vitamin K oxide reductase complex(VKORC)1 polymorphisms on time to determine the warfarin maintenance dose[J].Pharmazie,2011,66(3):222-225.
[10]张海燕,薛领,戚传平,等.基因及临床因素对华法林剂量的影响研究[J].中国药房,2010,21(22):2049-2052.
[11]郑红艳,宋杰.CYP2C9和VKORC1基因多态性对华法林剂量的影响[J].医学综述,2011,17(2):178-180.
[12]Yang L,Ge W,Yu F,etal.Impact of VKORC1 gene polymorphism on inter-individual and interethnic warfarin dosage re-quirement-a systematic review and meta analysis[J].Thromb Res,2010,125(4):e159-e166.
[13]顾强,陈柏成,郝嘉,等.重庆地区人工机械瓣膜置换术后患者VKORC1-1639A/G遗传多态性与华法林剂量调整的研究[J].第三军医大学学报,2009,31(23):2370-2373.
[14]何志强,韩勇,彭雯,等.基因检测指导华法林个体化用药案例分析[J].中国医院药学杂志,2013,33(14):1188-1189.
[15]周玲,薛领,包健安.临床药师对心脏瓣膜置换术后抗凝治疗用药宣教切入点[J].中国医院药学杂志,2012,32(23):1915.
[16]葛卫红,于锋,阳丽梅.基因多态性与华法林剂量需求关系的研究进展[J].中国临床药理学杂志,2010,26(3):226-230.
