活性氧介导砷诱导的蚕豆保卫细胞死亡
2013-01-03薛美昭仪慧兰
薛美昭,仪慧兰
山西大学生命科学学院,太原030006
自然状态下,砷以较低浓度广泛存在于大气、水和土壤中。近年来砷化合物在工、农、医药业中的大量使用导致了环境的砷污染,部分地区土壤和水域环境中砷含量偏高,对生态系统和人类健康构成威胁[1]。氧化损伤是目前公认的砷毒性作用机制:无机砷可诱发生物机体内超氧阴离子(O2·-),羟基自由基(·OH)和过氧化氢(H2O2)的生成,这些活性氧分子(reactive oxygen species,ROS)能破坏细胞膜及胞内生物大分子如膜脂、蛋白和核苷酸[2],进而影响细胞和分子的结构与功能,使细胞生理功能紊乱,导致疾病发生甚至死亡。近期研究证实,胞内一定水平的ROS 分子具有信号分子的功能,参与介导多种生物学过程,但是ROS 在砷毒性作用过程中的信号作用机制还不清楚。
植物叶表面的气孔保卫细胞能够对多种内外刺激如光、湿度、CO2和激素等做出反应,是研究信号转导的模式实验系统[3-4],对环境变化反应灵敏而准确。近期,不少学者采用植物叶面保卫细胞研究环境污染物氰化物、二氧化硫和铝等的细胞毒性,揭示了环境化学物的毒性效应及其作用途径[5-7],发现了内源性ROS 在细胞死亡中的作用。因此,本研究以蚕豆气孔保卫细胞为实验模型,研究NaAsO2对气孔保卫细胞的毒性效应,为揭示砷毒性作用机制提供实验依据。
1 材料与方法(Materials and methods)
1.1 实验材料
蚕豆(Vicia faba L.)种子清洗后用自来水浸泡48 h,25℃湿纱布包裹催芽2 ~3 d,然后播种于较肥沃的营养土中。培养条件:光暗周期为14 h/10 h,温度18 ~25℃,光照强度240 μmol·m-2·s-1。幼苗长至4 周时取顶端第2 节完全展开的叶片,选非叶脉部位用镊子撕取其下表皮,切成长约1 cm、宽约0.5 cm 的表皮条,置于含2-(N-morpholino)ethanesulfonic(MES)的表皮条缓冲液中。MES 缓冲液含MES,用三羟甲基氨基甲烷调节pH 至7.0。
1.2 药物处理
用MES 缓冲液配制含NaAsO2浓度为0.1、0.3、1、3 和10 mg·L-1的溶液作为砷处理液。缓解组采用一定浓度拮抗剂分别与NaAsO2同时作用。MES 缓冲液作对照。每个处理用3 个不同蚕豆植株上的叶片,将表皮条置于含有不同药物的处理液中,于23℃光照3 h 后检测细胞活性和胞内ROS 水平。
依据文献资料,在砷处理液中加入外源抗坏血酸(AsA,1 mmol·L-1)和过氧化氢酶(CAT,1 000 U·mL-1)来降低砷胁迫引发的胞内ROS 升高[8],选用Ca2+特异性螯合剂乙二醇双四乙酸(EGTA,1 mmol·L-1)和质膜Ca2+通道抑制剂降低胞内Ca2+水平[7],用0.1 mmol·L-1的2-(2-氨基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(PD98059)抑制促分裂素原活化蛋白激酶(mitogen activate protein kinase,MAPK)活性[9]。
1.3 细胞活性检测
参照Yi 等实验方法[7],药物处理结束后,表皮条用0.1 mg·L-1的二乙酸荧光素(fluorescein diacetate,FDA)暗染10 min,荧光显微镜下观察、拍照。统计无绿色荧光的保卫细胞(死细胞)数与观察的保卫细胞总数,计算保卫细胞死亡率。每个处理至少选用3 个植株的不同叶片,每次至少观察2 000 个保卫细胞。保卫细胞死亡率(%)=死亡保卫细胞数/观察保卫细胞数×100%。
1.4 胞内ROS 水平检测
参照González 等的实验方法[10],药物处理结束后表皮条于10 μmol·L-1的活性氧荧光指示剂2',7'-二氯荧光黄双乙酸酯(2',7'-dichlorofluorescein diacetate,DCFH-DA)中暗孵育30 min 后,荧光显微镜(激发波长488 nm)下观察并拍照。使用图像分析软件Image-Pro Plus 6.0 测量每组3 个表皮条中约300 个细胞的荧光值,计算其平均值。将对照组荧光值计为1,各处理组的相对荧光值为处理组荧光值与对照组的比值。
1.5 数据分析
计算每组3 个重复实验的平均值和标准误,采用SPSS17.0 对实验结果进行F 检验后,采用Duncan 方法进行多重比较,分析不同处理组和对照组之间的差异显著性。
2 结果(Results)
2.1 砷处理对蚕豆保卫细胞活性的影响
根据FDA 染色原理,活细胞发出亮绿色荧光,若细胞荧光亮度降低说明细胞活性下降,不能很好地将FDA 水解为极性荧光素分子,将无绿色荧光的细胞记为死细胞。研究发现,0.1 mg·L-1的NaAsO2对保卫细胞活性无明显影响,0.3 ~10 mg·L-1的NaAsO2能致蚕豆气孔保卫细胞活性降低,且随着NaAsO2浓度的升高细胞存活率逐渐下降,10 mg·L-1处理组存活率下降了28.4%(图1),浓度大于10 mg·L-1时,多数细胞荧光微弱,显示细胞活性很低。
2.2 砷处理对蚕豆保卫细胞内ROS 水平的影响
用ROS 荧光探针DCFH-DA 标记后检测发现,对照组保卫细胞具较弱的绿色荧光,3 与10 mg·L-1的NaAsO2处理组保卫细胞内ROS 荧光信号强度明显增强,即胁迫组胞内ROS 水平升高(图2)。由此可见,砷处理组细胞活性降低伴随着胞内ROS 水平的升高。

图2 砷对蚕豆保卫细胞内ROS 水平的影响Fig.2 Changes of relative intensity of ROS fluorescence in V.faba guard cell exposed to arsenic
为证实ROS 与细胞死亡的关系,用一定浓度的抗氧化剂AsA 或CAT 与NaAsO2共同作用,检测ROS 水平降低后细胞死亡率的变化,发现2 种类型的抗氧化剂均可显著抑制砷诱发的细胞死亡(图3)。处理液中加入1 mmol·L-1的AsA 能抑制砷引起的细胞死亡,提高细胞存活率,使3 与10 mg·L-1NaAsO2处理组细胞存活率分别提高14.1%和23.5%;加入浓度为1 000 U·mL-1的CAT 同样能够显著降低砷诱导的细胞死亡率,使3 与10 mg·L-1NaAsO2组细胞存活率分别提高了15.4%和25.6%。研究结果表明,砷诱导的保卫细胞死亡与胁迫过程中胞内ROS 水平升高密切相关,ROS 参与介导了砷诱导的细胞死亡。
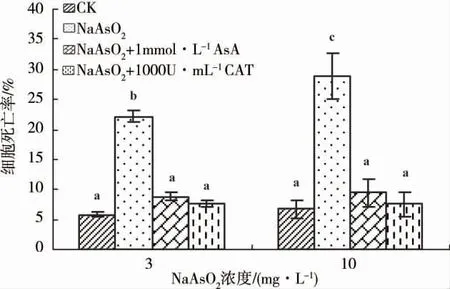
图3 抗氧化剂抗坏血酸(AsA)与过氧化氢酶(CAT)对砷致蚕豆保卫细胞死亡的抑制作用Fig.3 Antagonistic effects of antioxidants(AsA and CAT)on As-induced guard cell death in V.faba
2.3 Ca2+和MAPK 参与砷诱发的细胞死亡
在砷处理液中加入一定浓度的Ca2+干扰剂降低胞内Ca2+水平后,细胞存活率提高,死亡率下降(图4)。处理液中加入的Ca2+特异性螯合剂EGTA 后,3 和10 mg·L-1NaAsO2组细胞存活率分别提高4.3%和15.9%,与砷单独处理组相比均显著增高(P <0.05);加入0.1 mmol·L-1的Ca2+通道抑制剂LaCl3后,3 和10 mg·L-1NaAsO2处理组细胞存活率分别提高了15.0%和24.6%,亦显著高于砷单独处理组(P <0.05)。这表明,砷诱导的保卫细胞死亡与胁迫引发胞内Ca2+水平升高有关,在胞内Ca2+升高过程中胞外Ca2+内流发挥了重要作用。
用0.1 mmol·L-1的MAPK 抑制剂PD98059 与NaAsO2共同处理蚕豆表皮条后,保卫细胞存活率显著高于砷单独处理组(P <0.05),3 mg·L-1砷处理组死亡率接近对照水平(图5),说明MAPK 参与了砷诱发的细胞死亡过程。

图4 EGTA 与LaCl3对砷致蚕豆保卫细胞死亡的抑制作用Fig.4 Antagonistic effects of EGTA and LaCl3 on As-induced guard cell death in V.faba

图5 MAPK 抑制剂PD98059 对砷致蚕豆保卫细胞死亡的抑制作用Fig.5 Antagonistic effect of MAPK inhibitor PD98059 on As-induced guard cell death in V.faba
3 讨论(Discussion)
植物暴露于无机砷中会激发ROS 的产生,ROS具有很强的氧化能力,能直接破坏植物体内蛋白质、核苷酸、膜脂等生物大分子的结构,引发脂质过氧化反应[11],ROS 还可作为信号分子介导多种生物学过程。
本研究发现,NaAsO2处理诱发保卫细胞死亡和胞内ROS 水平升高同期发生。外源性给予ROS 清除剂AsA 和CAT 可降低非生物胁迫诱发的胞内ROS 水平[8],在NaAsO2处理液中加入AsA 或CAT后,NaAsO2诱发的细胞死亡被抑制,说明NaAsO2诱发蚕豆保卫细胞死亡与胞内ROS 升高有关,砷胁迫下保卫细胞内ROS 水平升高介导了蚕豆保卫细胞的死亡。本结果为ROS 参与砷毒性作用过程提供了直接证据。
MAPK 途径是氧化还原敏感的信号途径,可受ROS 调节。特异性激酶抑制剂PD98059 能抑制MAPK 的激活[9],从而阻断MAPK 信号通路。本研究中加入MAPK 抑制剂PD98059 后能显著抑制砷处理诱发的保卫细胞死亡,表明MAPK 可能作为ROS 下游信号参与介导了砷诱导的蚕豆保卫细胞死亡。
研究表明,胁迫产生的过量ROS 可激活质膜Ca2+通道和胞内Ca2+通透性离子通道,引起胞外Ca2+内流,导致胞内Ca2+水平升高[7,12-13]。Ca2+特异性螯合剂EGTA 能通过螯合作用降低细胞外Ca2+浓度从而有效阻止胞外Ca2+内流;LaCl3作为Ca2+通道特异性抑制剂,能有效阻止胞外Ca2+进入细胞;因此,加入外源EGTA 或LaCl3能有效降低胞内Ca2+[7]。本研究中,加入EGTA 或LaCl3后砷处理组细胞死亡率均显著降低,说明胞内Ca2+升高参与介导了砷诱发的细胞死亡,胞外Ca2+内流是胞内Ca2+升高的重要原因。因此,砷处理组蚕豆保卫细胞内ROS 水平升高可能通过激活质膜Ca2+通道,使胞外Ca2+内流,导致胞内Ca2+水平升高,从而激活相关下游信号引发细胞死亡。
胞质中Ca2+超载可影响细胞核与线粒体内的Ca2+水平,在Ca2+失衡的条件下基因表达、能量代谢、线粒体膜通透性等发生改变,可引发细胞坏死、凋亡、自噬性死亡[14]。细胞死亡信号途径中有很多Ca2+靶标,包括蛋白激酶、NO 合酶、核酸内切酶、磷脂酶、蛋白磷酸化酶、转谷氨酰胺酶、蛋白酶等。
依据细胞毒性机制研究理论,结合本研究结果,笔者认为,砷诱发植物细胞死亡可能通过下述3 条途径:(1)胁迫产生的ROS 可直接攻击DNA、蛋白质等生物大分子,使DNA 分子断裂、修复酶活性降低,DNA 损伤无法及时修复,导致细胞死亡[15];(2)ROS 激活质膜Ca2+通道,使胞外Ca2+内流,胞内Ca2+水平升高,进而激活Ca2+依赖性核酸内切酶,使细胞核DNA 在核小体连接处被切割,细胞凋亡;(3)胞内ROS 和Ca2+水平升高使线粒体膜通透性破坏,细胞色素c、凋亡诱导因子释放并于胞质中形成凋亡复合体,激活类Caspase 蛋白酶,特异性切割下游底物,细胞凋亡[16-17]。虽然砷胁迫可能激活多种细胞死亡途径,但本结果为细胞死亡的程序性调控提供了直接证据。
综上所述,一定浓度的砷可诱发蚕豆保卫细胞死亡,砷胁迫诱发胞内ROS 水平升高,ROS 激活质膜Ca2+通道,使胞外Ca2+内流,胞内Ca2+水平升高,激活了胞内Ca2+信号系统,Ca2+可激活细胞内死亡相关基因表达执行细胞死亡程序,引发细胞死亡。用植物细胞研究了砷毒性作用的信号途径,该途径与动物细胞中报道的结果相似[18-19],说明植物细胞在检测环境有毒物质的测试中同样有效,而运用蚕豆叶面气孔保卫细胞检测环境化学物的细胞毒性,具有取材简便、检测灵敏快速、重复性好等优点,因此,该方法可用于对环境化学物质毒性作用的检测和评价。
[1] Garelick H,Jones H,Dybowska A,et al.Arsenic pollution sources[J].Reviews of Environmental Contamination and Toxicology,2008,197:17-60
[2] Wu L H,Yi H L,Yi M.Assessment of arsenic toxicity using Allium/Vicia root tip micronucleus assays[J].Journal of Hazardous Materials,2010,176(1 -3):952-956
[3] Hetherington A M.Guard cell signaling[J].Cell,2001,107(6):711-714
[4] Schroeder J I,Allen G J,Hugouvieux V,et al.Guard cell signal transduction[J].Annual Review of Plant Physiology and Plant Molecular Biology,2001,52:627-658
[5] Samuilov V D,Kiselevshy D B,Sinitsyn S V,et al.H2O2intensifies CN–-induced apoptosis in pea leaves[J].Biochemistry,2006,71(4):384-394
[6] 刘鑫,仪慧兰.铝诱导蚕豆气孔保卫细胞凋亡研究[J].农业环境科学学报,2010,29(9):1659-1664.Liu X,Yi H L.Aluminum induces apoptosis in Vicia faba guard cells[J].Journal of Agro-Environment Science,2010,29(9):1659 -1664(in Chinese)
[7] Yi H L,Yin J J,Liu X,et al.Sulfur dioxide induced programmed cell death in Vicia guard cells[J].Ecotoxicology and Environmental Safety,2012,78:281 -286
[8] Bi Y H,Chan W L,Zhang W N,et al.Production of reactive oxygen species,impairment of photosynthetic function and dynamic changes in mitochondria are early events in cadmium-induced cell death in Arabidopsis thaliana[J].Biology of the Cell,2009,101(11):628-643
[9] Clarke A,Desikan R,Hurst R D,et al.NO way back:Nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures [J].The Plant Journal,2000,24(5):667 -677
[10] González A,de los'Angeles Cabrera M,Josefa Henr quez M,et al.Cross talk among calcium,hydrogen peroxide,and nitric oxide and activation of gene expression involving calmodulins and calcium-dependent protein kinases in Ulva compressa exposed to copper excess[J].Plant Physiology,2012,158(3):1451 -1462
[11] Stoeva N,Berova M,Zlatev Z.Effect of arsenic on some physiological parameters in bean plants[J].Biologia Plantarum,2005,49(2):293-296
[12] Pei Z M,Murata Y,Benning G,et al.Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells[J].Nature,2000,406(6797):731-734
[13] Mori I C,Schroeder J I.Reactive oxygen species activation of plant Ca2+channels.A signaling mechanism in polar growth,hormone transduction,stress signaling,and hypothetically mechanotransduction [J].Plant Physiology,2004,135(2):702-708
[14] Zhivotovsky B,Orrenius S.Calcium and cell death mechanisms:A perspective from the cell death community[J].Cell Calcium,2011,50(3):211-221
[15] Pan J W,Zhu M Y,Chen H.Aluminum-induced cell death in root-tip cells of barley[J].Environmental and Experimental Botany,2001,46(1):71-79
[16] 吴丽华,仪慧兰,张虎芳.NO 参与亚砷酸钠诱导酵母细胞死亡的调控[J].环境科学学报,2012,32(10):2612-2615 Wu L H,Yi H L,Zhang H F.Involvement of NO in sodium arsenite-induced yeast cell death[J].Acta Scientiae Circumstantiae,2012,32(10):2612-2616(in Chinese)
[17] Fleury C,Mignotte B,Vayssière J L.Mitochondrial reactive oxygen species in cell death signaling[J].Biochimie,2002,84(2-3):131-141
[18] Brookes P S,Yoon Y,Robotham J L,et a1.Calcium,ATP,and ROS:A mitochondrial love-hate triangle[J].American Journal of Physiology Cell Physiology,2004,287(4):C817-C833
[19] Shi Y F,Wei Y,Qu S,et al.Arsenic induces apoptosis of human umbilical vein endothelial cells through mitochondrial pathway [J].Cardiovascular Toxicology,2010,10(3):153-160
