16S rDNA 克隆文库解析江汉平原高砷地下水系统中的细菌多样性
2013-01-03罗艳谢作明周义芳王焰新甘义群
罗艳,谢作明,周义芳,王焰新,甘义群
中国地质大学(武汉)环境学院,武汉430074
砷是一种无色无味的剧毒物质,在极低浓度下就有很高的致毒性。砷污染已经成为全世界面临的最主要的环境问题之一。亚洲是地下水砷污染最为严重的地区,砷污染主要分布在孟加拉国、印度和中国[1]。世界卫生组织规定饮用水中砷的最高浓度为10 μg·L-1[2]。在世界范围内,由于长期饮用高砷地下水而导致砷中毒的事件已多有报道。长期暴露在高砷环境下,人体健康会受到威胁,高砷环境还会使皮肤角质化,甚至诱发皮肤癌和胃肠道癌,并影响中枢神经系统[3-4]。
我国地下水砷含量超标地区遍及山西、内蒙古、新疆、宁夏和台湾等地[5-9]。近年来,江汉平原地区出现的砷中毒现象引起了研究者的重视[10-11]。微生物对地下水中的砷的形态和分布特征都有重要影响,所以研究地下水系统中的细菌多样性有助于研究砷的迁移转化规律。现代分子生物学的方法为研究微生物的多样性提供了有效的手段,尤其是16S rDNA 克隆文库技术,该方法重复性好,携带的信息量大,应用广泛。然而目前很少有研究者开展耐砷基因文库方面的工作,通过构建16S rDNA 克隆文库,可以分析和研究环境中的细菌多样性和种群结构差异以及得到一些有砷抗性的微生物的序列。越来越多的研究表明[12-15],砷代谢微生物广泛参与了砷的地球化学循环,影响着环境中砷的地球化学行为。微生物对不同价态砷的溶解、迁移和利用的差异影响着砷形态的转化,表明了微生物在砷的生物地球化学循环中发挥着重要作用[16]。
本研究以仙桃沙湖高砷地区的土壤为例,运用16S rDNA 克隆文库方法分析土壤细菌多样性,并确定优势种群,对微生物的群落结构进行了初步分析。本研究可为江汉平原高砷地下水系统中微生物的群落组成和多样性提供一定的参考信息。
1 材料与方法(Materials and methods)
1.1 土壤样品的采集
采样地点为湖北省仙桃市沙湖镇某农户家门前的空地上,海拔18 m,位于30°9.393'N,113°40.655'E。在该地方打1 个50 m 的钻井,取埋深分别为9.9 ~10.1 m、15.7 ~16.0 m 的2 个土样放入冻存管中,再将冻存管放入-196℃液氮中保存。
1.2 土样中的As 含量
将埋深为9.9 ~10.1 m、15.7 ~16.0 m 的2 个土样分别编号为5 和7。分别准确称取5 号和7 号土样(50±1)mg 采用HNO3和HF 高温高压法消解土样,所用HNO3和HF 均为高纯,由市售分析纯HNO3和HF 蒸馏提纯制得。用质量分数为2%的HNO3稀释定容,最后用双道原子荧光分光光度计(AFS-930,北京吉天仪器有限公司)测定砷的浓度。5 号样和7 号样中的砷的浓度分别为为30.12 和30.27 μg·g-1。
1.3 16S rDNA 分析
总DNA 模板提取:称取0.2 ~0.5 g 土样,加1 mL buffer SLX Mlus 振荡3 ~5 min,加100 μL bufffer DS并振荡混合,90℃水浴10 min,3 000 r·min-1离心3 min,去上清液并且加入270 μL buffer sp2 振荡混合。4℃、3 000×g 下离心10 min,沉淀DNA,加200 μL Elution Buffer 65℃水浴20 min,溶解DNA。加50 μL HTR Reagent,13 000×g 下离心2 min,取上清液,加入等体积的XP2 Buffer,振荡混匀。全样加入到Hibind DNA 柱子中,10 000×g 下离心1 min,弃掉直流液,再加入300 μL XP2 Buffer 10 000×g 下离心1 min,用700 μL 的spw wash buffer 进行清洗2 遍,弃掉废液,加入60 μL 的Elution buffer 65℃水浴15 min,13 000×g下离心1 min,洗提DNA。
目的基因片段的PCR 扩增:选择通用引物27F(5'-AGAGTTTGATTCCTGGCTCAG-3')1492R(5'-GGCTACCTTGTTACGACTT-3')。PCR 反 应 体 系(50 μL):dNTP 混合物(2.5 mmol·L-1)4 μL;10×PCR buffer,PCR 扩增条件为:预变性温度94℃,5min;变性温度94℃,30s;退火温度55℃,1 min;延伸温度72℃,2 min;36 个循环后,72℃,延伸10 min。
16S rDNA 连接、转化和文库构建:将PCR 扩增产物用胶回收试剂盒回收纯化目标条带。纯化后与PMD19-T 载体连接,之后转化到大肠杆菌JM109感受态细胞中,37℃培养过夜。用X-gal 进行蓝白斑初步筛选,筛选具有氨苄青霉素抗性的阳性白色转化子,用无菌牙签挑取白色克隆子转接于LB/氨苄青霉素液体培养基中于恒温37℃摇床中培养4 ~5 h 后再做扩增,剔除假阳性克隆子,扩增引物为RV-M(5'-GAGCGGATAACAATTTCACACAGG-3')M13-47 (5'-CGCCAGGGTTTTCCCAGTCACGAC-3')。扩增条件为预变性温度94℃,10 min;变性温度94℃,30 s;退火温度53℃,30 s;延伸温度72℃,30 s;25 个循环后,72℃,延伸5 min。将阳性克隆子送至南京金斯瑞生物科技有限公司测序。结果用MEGA5 软件进行系统发育学分析,构建16S rDNA克隆文库。
2 结果与讨论(Results and discussion)
2.1 样品总DNA 提取和PCR 扩增结果
选取埋深分别为9.9 ~10.1 m、15.7 ~16.0 m 的2 个沉积物土样,分别提取了总DNA,且以其为模板进行16S rDNA 全长PCR 扩增,得到约1 500 bp大小的片段,回收纯化后电泳检测结果见图1。
图1 DNA 的PCR 产物电泳图注:M,DL2000;3 ~7,DNA 样品。Fig.1 Electrophoretogram of PCR products of DNA
2.2 土样的16S rDNA 系统发育分析
挑取5 号样(9.9 ~10.1 m)中的阳性克隆子进行测序,测序结果在GenBank 数据库中进行Blast 比对,后建立NJ(neighbor joining)进化树。从图2 可以看出,根据同源性可信度高低由NJ 进化树可将定属或定种的56 个菌株主要分为4 大类,伯克氏菌目(Burkholderiales)是文库中最大的细菌菌群,在文库中占39.29%,其次分别是假单胞杆菌目(Pseudomonadales)和肠杆菌目(Enterobacteriales),在文库中所占比例分别为37.50%和27.78%,乳杆菌目(Lactobacillales)是文库中最小的细菌菌群,在文库中占8.33%。
挑取7 号样(15.7 ~16.0 m)中的阳性克隆子进行测序,测序结果在GenBank 数据库中进行Blast比对,之后建立NJ 进化树。从图3 可以看出,根据同源性可信度高低由NJ 进化树可将定属或定种的78 个菌株主要分为4 大类,伯克氏菌目(Burkholderiales)是文库中最大的细菌菌群,在文库中占38.46%。其次分别是肠杆菌目(Enterobacteriales)和假单胞杆菌目(Pseudomonadales),分别占文库的24.36%和23.08%。放线菌目(Actinomycetales)是文库中最小的细菌菌群,在文库中占14.01%。
其中,在假单胞杆菌目中的不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)分别占23.21% 和14.29%,它们都是高耐砷的菌属。5 号样中的不动杆菌属和假单胞菌属分别占23.21%和14.29%,7 号样中的不动杆菌属和假单胞菌属分别占6.41%和16.67%。
将不同深度的5 号样和7 号样的测序结果进行对比可知,伯克氏菌目、假单胞杆菌目和肠杆菌目在文库中所占的比例最大。这3 个菌目构成了高砷系统中抗砷的优势菌群。它们都属于变形菌门,变形菌门根据rRNA 序列被分为5 个纲,用希腊字母α、β、γ、δ 和ε命名。伯克氏菌目属于β-proteobacteria,假单胞杆菌目和肠杆菌目属于γ-proteobacteria。目前可知γ-proteobacteria 是仙桃沙湖地区高砷地下水沉积物中耐砷微生物的主要类群。陈双喜和邵宗泽[17]在西南印度洋中脊深海沉积物中筛选到了8 株砷抗性菌,它们都属于γ-proteobacteria。γ-proteobacteria 类群在环境砷元素的生物地球化学循环中扮演着重要角色。伯克氏菌目(Burkholderiales)可以在某种条件下减少As(V)向As(Ш)的转化[18]。伯克氏菌目(Burkholderiales)中的丛毛单胞菌科(Comamonadaceae)是一种砷氧化反硝化细菌,目前研究者已将其从不同的受砷污染的湖泊、土壤、原始的沉积物及土壤中离了出来[19-22]。假单胞杆菌目中的不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)具有较强的抗性。Turpeinen 等[23]采用磷酸-脂肪酸分析(PLFA)法和16S rRNA 末端限制性片段多态性分析(t-RFLP)法研究了砷、铬和铜复合污染土壤中的微生物群落结构,发现仅有不动杆菌属和假单胞菌属的数量和活性增强。假单胞杆菌目中的不动杆菌属和假单胞菌属长期生活在砷胁迫环境下,通常具有砷抗性,它们是可将高毒性的As(Ш)氧化为低毒性的As(V)的细菌。在肠杆菌目(Enterobacteriales)中有很多“铁细菌”,它们是一种能使Fe(Ⅱ)氧化成Fe(III)并从中得到能量的一群菌落,如锈铁菌属和纤毛铁细菌属等。在水中能使亚铁化合物氧化,并使之生成三价的氢氧化铁沉淀。在含水层沉积物中铁的氧化物和氢氧化物是砷的最重要的吸附剂[24]。“铁细菌”氧化水中溶解的Fe(Ⅱ)和Mn(Ⅱ)形成不溶产物:氧化铁或氧化锰,并覆盖在过滤介质上形成天然(生物)吸附层。近年来,也有研究表明[25-26],微生物能利用铁的多种矿物质,并还原其中的铁氧化物或氢氧化物,砷随之被释放出来。在5 号样中出现了乳杆菌目,而在7 号样中却没有发现。乳杆菌目链球菌科链球菌属,是革兰氏染色阳性细菌,是一种营养要求较高的兼性厌氧或厌氧的菌种。在7 号样中出现了放线菌目,在5 号样中却没有找到。放线菌目,革兰氏染色阳性,不抗酸,不能运动,大部分嫌气或兼性嫌气,少数好气或兼性好气,大多为发酵型,少数为氧化型。5 号样和7 号样中出现的微生物的不同可能与土样的深度和砷的浓度有关。
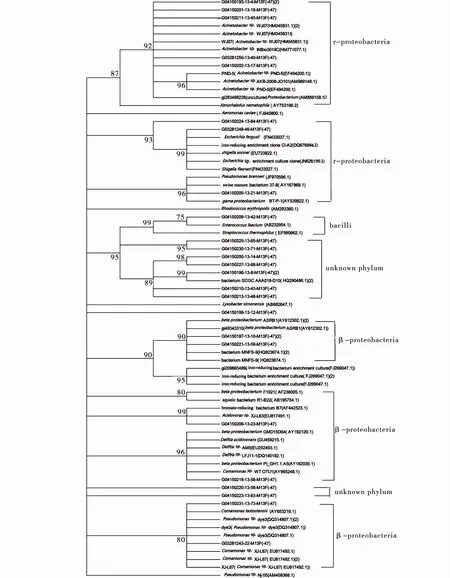
图2 5 号样的NJ 进化树Fig.2 NJ evolutionary tree of sample No.5

图3 7 号样的NJ 进化树Fig.3 NJ evolutionary tree of sample No.7
本研究对在江汉平原高砷地下水系统中的两个不同埋深沉积物样提取了土壤总DNA,并且构建了16S rDNA 克隆文库,结果可知伯克氏菌目、假单胞杆菌目和肠杆菌目构成了高砷系统中抗砷的优势菌群。由于研究只选取了2 个埋深的土壤,不能代表整个地下水系统,但是却为研究江汉平原高砷地下水系统中的微生物群落组成和多样性提供一定的参考信息。同时,通过分子生物学筛选出一些砷抗性菌群,可以考虑利用这些优势菌群来修复砷污染的土壤和地下水。微生物种类繁多,代谢方式多样,抗砷机理也不同,而目前对抗砷微生物种类研究由于环境条件的限制而有限,甚至有的抗砷机理还需完善,因而还需开展大量研究。在分子生物学水平研究砷污染环境中的微生物种群多样性,能够为研究砷的毒理效应以及砷对生态的影响提供一定的参考。同时如何将不同环境的水文地球化学条件与微生物研究联系起来,来探讨砷的生物地球化学循环也是一个难点问题。应用性更广泛的是:找到合适微生物资源,探索更合适、有效的原位修复技术来达到除砷目的也是目前的热点问题。
[1] 谢先军,王焰新,李俊霞,等.大同盆地高砷地下水稀土元素特征及其指示意义[J].地球科学(中国地质大学学报),2012,37(2):381-390 Xie X J,Wang Y X,Li J X,et al.Characteristics and implications of rare earth elements in high arsenic groundwater from the Datong Basin[J].Earth Science(Journal of China University of Geosciences),2012,37(2):381-390(in Chinese)
[2] World Health Organization.Guidelines for Drinking Water Quality.Recommendations[R].Geneva:World Health Organization,2004
[3] 王国荃,吴顺华.地方性砷中毒的研究进展[J].新疆医科大学学报,2004,27(1):18-20
[4] Rosado J L,Ronquillo D,Kordas K,et al.Arsenic exposure and cognitive performance in Mexican schoolchildren [J].Environmental Health Perspectives,2007,115(9):1371-1375
[5] 赵伦山,武胜,周继华,等.大同盆地砷、氟中毒地方病生态地球化学研究[J].地学前缘,2007,14(2):225-235 Zhao L S,Wu S,Zhou J H,et al.Eco-geochemical investigation on the endemic As and F poisoning in Datong Basin[J].Earth Science Frontiers,2007,14(2):225-235(in Chinese)[6] 何薪,马腾,王焰新,等.内蒙古河套平原高砷地下水赋存环境特征[J].中国地质,2010,37(3):781-788 He X,Ma T,Wang Y X,et al.Geochemical characteristics of the As-bearing aquifer in the Hetao Plain,Inner Mongolia[J].Geology in China,2010,37(3):781-788(in Chinese)
[7] 罗艳丽,余艳华,郑春霞,等.新疆奎屯垦区土壤砷含量及耐砷植物的筛选[J].干旱区资源与环境,2010,24(2):192-194 Luo Y L,Yu Y H,Zheng C X,et al.Arsenic concentrations in soils and plants in Kuitun Farm,XinJiang[J].Journal of Arid Land Resources and Environment,2010,24(2):192-194(in Chinese)
[8] 郁冬梅,吴学华,崔向红.从土壤地球化学看宁夏平罗县砷、氟中毒地方病的起因与分布[J].农业科学研究,2011,32(4):45-47 Yu D M,Wu X H,Cui X H.Causes and distribution of endemic disease about arseniasis and fluorosis in Pingluo Country from a view of geochemistry[J].Journal of Agricultural Sciences,2011,32(4):45-47(in Chinese)
[9] Lu K L,Liu C W,Wang S W,et al.Assessing the characteristics of groundwater quality of arsenic contaminated aquifers in the blackfoot disease endemic area[J].Journal of Hazardous Materials,2011,185(2-3):1458-1466
[10] 陈兴平,邓云华,张裕曾,等.湖北南洪村饮水砷含量及砷中毒调查[J].中国地方病防治杂志,2007,22(4):281-282 Chen X P,Deng Y H,Zhang Y Z,et al.The epidemiological survey and analysis to arsenism in Nanhong Village of Plain Hubei Province[J].Chinese Journal of Control of Endemic Diseases,2007,22(4):281-282(in Chinese)
[11] Huang S B,Wang Y X,Cao L,et al.Multidimensional spectrofluorometry characterization of dissolved organic matter in arsenic-contaminated shallow groundwater[J].Journal of Environmental Science and Health,Part A:Toxic/Hazardous Substances and Environmental Engineering 2012,47(10):1446-1454
[12] 洪斌.微生物对砷的地球化学行为的影响——暨地下水砷污染机制的最新研究进展[J].地球科学进展,2006,21(1):77-82 Hong B.Influence of microbes on biogeochemistry of arsenic—Mechanism of arsenic mobilization in groundwater[J].Advances in Earth Science,2006,21(1):77-82(in Chinese)
[13] Oremland R S,Stolz J F.The ecology of arsenic[J].Science,2003,300(5621):939-944
[14] 唐小惠,郭华明,刘菲.富砷水环境中微生物及其环境效应的研究现状[J].水文地质工程地质,2008(3):104-107 Tang X H,Guo H M,Liu F.Review of microbes and their effects in arsenic-rich waters[J].Hydrogeology and Engineering Geology,2008(3):104-107(in Chinese)
[15] 陈云嫩,柴立元.砷在地下水环境中的迁移转化[J].有色金属,2008,60(1):109-112 Chen Y N,Chai L Y.Migration and transformation of arsenic in groundwater[J].Nonferrous Metals,2008,60(1):109-112(in Chinese)
[16] Silver S,Phung L T.Genes and enzymes involved in bacterial oxidation and reduction of inorganic arsenic[J].Applied&Environmental Microbiology,2005,71(2):599-608
[17] 陈双喜,邵宗泽.西南印度洋中脊深海沉积物砷抗性菌的富集分离多样性分析[J].微生物学报,2008,48(10):1351-1355 Chen S X,Shao Z Z.Enrichment and diversity analysis of arsenite-resistant bacteria in deep sea sediment samples from southwest Indian Ocean ridge[J].Acta Microbiologica Sinica,2008,48(10):1351-1355(in Chinese)
[18] Yoshinaga M,Cai Y,Rosen B P.Demethylation of methylarsonicacid by a microbial community[J].Environmental Microbiology,2011,13(5):1205-1215
[19] Oremland R S,Hoeft S E,Santini J A,et al.Anaerobic oxidation of arsenite in Mono Lake water and by facultative,arsenite-oxidizing chemoautotroph,strain MLHE-1 [J].Applied & Environmental Microbiology,2002,68(10):4795-4802
[20] Rhine E D,Phelps C D,Young L Y.Anaerobic arsenite oxidation by novel denitrifying isolates[J].Environmental Microbiology,2006,8(5):899-908
[21] Sun W J,Sierra R,Field J A.Anoxic oxidation of arsenite linked to denitrification in sludges and sediments[J].Water Research,2008,42(17):4569-4577
[22] Sun W J,Sierra-Alvarez R,Fernandez N,et al.Molecular characterization and in situ quantification of anoxic arsenite-oxidizing denitrifying enrichment cultures[J].FEMS Microbiology Ecoligy,2009,68(1):72-85
[23] Turpeinen R,Kairesalo T,H¨aggblom M M.Microbial community structure and activity in arsenic-,chromium-and copper-contaminated soils[J].FEMS Microbiology Ecoligy,2004,47(1):39-50
[24] Violante A,Huang P M,Gadd G M.Biophysico-Chemical Processes of Heavy Metals and Metalloids in Soil Environments[M].Hoboken:Wiley,2008:313-338
[25] Islam F S,Gault A G,Boothman C,et al.Role of metal-reducing bacteria in arsenic release from Bengal delta sediments[J].Nature,2004,430:68-71
[26] Chow S S,Taillefert M.Effect of arsenic concentration on microbial iron reduction and arsenic speciation in an iron-rich freshwater sediment[J].Geochimica et Cosmochimica Acta,2009,73(20):6008-6021
