链霉菌的抗砷特性及其对蜈蚣草富集砷的作用
2013-01-03文一廖晓勇阎秀兰
文一,廖晓勇,阎秀兰
1.中国科学院地理科学与资源研究所 场地污染评估与修复中关村开放实验室,北京100101
2.环境保护部环境规划院,北京100012
砷是一种广泛存在于环境中的类金属元素,可导致人体患皮肤癌、肺癌以及糖尿病、皮肤病、神经和心血管类等非癌症疾病[1]。砷污染已影响全世界数百万人的健康,成为全球关注的环境问题[2]。世界上有19 个国家和地区爆发过严重的砷污染危害事件,中国是遭受砷毒害最为严重的国家之一,已发生的砷中毒涉及到全国8 个省和37 个县[3]。砷污染治理是国际上面临的亟待解决的重要环境课题,在我国的《重金属污染综合防治“十二五”规划》中已将砷作为重点防治对象。
传统的砷污染土壤治理方法包括填埋法、固化/稳定化、化学淋滤等方法,近年来基于超富集植物蜈蚣草(Pteris vittata L.)的砷污染土壤植物修复技术被认为是应用前景广阔、修复成本低、且二次风险少的方法[4]。蜈蚣草的砷累积量可占总生物干质量的2.3%[5],能提取土壤中不同形态的砷(非专性吸附态、专性结合态、无定型水合氧化态、结晶水合氧化态以及残渣态砷),其中对无定型水合氧化态砷的提取可占提取总砷的67%~77%[6]。
借用强化手段,进一步提升蜈蚣草富集砷的能力是近期国内外研究的重点。微生物可通过自身或其代谢产物促进植物根系发育、增加生物量,提高植物对不同环境压力的耐受力,改变土壤中重金属的形态,增加重金属的生物可利用性,来强化植物的修复效率[7]。例如,接种细菌后,能增加植物生长促生长素及1-氨基环丙烷-1-羧酸(ACC)脱氨酶的生成,促进油菜对砷、铜、镍的吸收[8];细菌还能通过促进植物根系发育,增加生长素(IAA)、铁运载体的分泌,促进芥菜对铬、锌及铅的吸收[9]。本文以从高砷土壤中生长的的蜈蚣草根际土壤中筛选出菌株——链霉菌(Streptomyces sp.)作为供试微生物,研究其抗砷性能及其对蜈蚣草富集砷的作用,从菌株对根际环境影响的角度探讨其对砷在土壤-超富集植物根际系统中转运的影响。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 供试盆栽土
取自湖南郴州邓家塘砷污染土壤(北纬24°53'~26°50',东经112°50'~114°14',海拔344 m),其基本理化性质为:pH 值为7.34,有机质含量为18.4 g·kg-1,阳离子交换量(CEC)为26 cmol·kg-1,总砷含量为115.74 mg·kg-1,全磷为22.95 g·kg-1,全氮为1.61 g·kg-1。土壤为细砂土,砂粒体积分数为59.9%,粉粒为24.7%,粘粒为15.4%。供试土壤室内自然风干,磨碎,过2 mm 筛,混匀,备用。
1.1.2 供试植物
蜈蚣草为湖南郴州无砷污染土壤的野生植株,选择株高5 ~10 cm、4 ~5 片羽叶、根茎大小一致的植株。每盆移栽1 株蜈蚣草。温室温度控制在22℃~25℃之间,室内相对湿度控制在75%~80%。
1.1.3 供试菌株及菌液制备
供试菌种筛选自砷含量为90 ~300 mg·kg-1污染土壤中的土著链霉菌(Streptomyces sp.),经鉴定其含有参与砷还原转化的arsC 基因。利用胰蛋白胨大豆肉汤培养基(TSB)培养基,在30℃、220 r·min-1下振荡培养36 h,制备发酵液。在4℃、6 000 r·min-1下离心10 min,弃去上清液,沉淀用无菌去离子水清洗2 次。用无菌去离子水配制成菌悬液。将Streptomyces sp.菌液的浓度调整为3×106cfu·mL-1,取800 mL 的发菌液在高压灭菌锅中于121℃、15 min 下处理制成灭活菌液。
1.1.4 试剂
砷酸钠(Na3AsO4·12H2O)等化学试剂为国产分析纯试剂。TSB 培养基购自美国BD 公司。
1.2 实验方法
(1)菌株抗砷性能的测定:取在600 nm 吸光值为0.8 的菌液1 mL,接种于含100 mL TSB 培养基的500 mL 三角锥形瓶中,24 h 后,在菌液中加入不同浓度的砷酸钠(用无菌水配置,并过无菌滤膜,保证无菌),配制成含0、20、40、60、80 和100 mmol·L-1砷酸钠的发酵液。在30℃、220 r·min-1下水浴振荡培养。24 h 后,收获菌液,4℃、7 000 r·min-1下离心,用蒸馏水洗涤2 次,在80℃烘至恒重,称取菌丝质量。每个处理3 个重复。
(2)菌株砷还原能力的测定:取在600 nm 吸光值为0.8 的菌液1 mL,接种于含100 mL TSB 培养基的500 mL 三角锥形瓶中,培养24 h 后加入砷酸钠(用无菌水配置,并过无菌滤膜,保证无菌),配制成75 mg·L-1的砷酸钠发酵液,用含相同砷酸盐浓度的灭活菌液作为对照。每隔6 h,从活性菌液和对照组菌液中各取出4 mL,7 000 r·min-1下离心,测定上清液中As(Ⅲ)和As(Ⅴ)的含量。每个处理3 个重复。
(3)盆栽实验共设4 个处理,分别是不添加菌的空白对照处理组(CK)、不添加菌但种植蜈蚣草的植物对照处理组(CK+P)、Streptomyces sp.菌液处理组(S)、施加Streptomyces sp.菌液并种植蜈蚣草处理(S+P),每个处理设4 个重复。蜈蚣草移栽7 d 确保成活后,在CK、CK+P 处理组中施入100 mL 灭活菌液,在S 和S+P 处理组中施入100 mL 活性菌液,菌液采用针头,通过根际灌注和表层喷洒的方式施加,添加后适当翻动表层土壤,使菌液在表层土壤(0 ~10 cm)混合均匀。60 d 时收获植物和土壤,利用晃动根部,获得非粘附的土壤,作为非根际土。用软毛刷刷下粘附在根际的土壤作为根际土。土壤样品分成3 份,一份在室内自然风干,用于测定总砷、砷结合态;一份保存在4℃,用于测定可溶性有机碳(DOC);一份保存在-80℃,用于测定砷形态。植物先用自来水冲洗干净,然后用去离子水洗涤3 遍。植株上的水珠用滤纸吸干,称取植物生物质量,将植物分为地上部、地下部在烘箱烘干,用于总砷测定。
1.3 检测方法
采用硝酸-双氧水消煮土壤样品,硝酸-高氯酸消煮植物样品,用原子荧光分光光度计测定总砷含量[10]。用的磷酸抗坏血酸提取土壤中砷[11],用1∶1 甲醇水提取植物样品中的砷[12],用液相色谱-原子荧光光谱联用(LC-AFS)测定砷形态。土壤砷结合态分析采用武斌等分级方法连续提取[13]。定量称取10 g 土壤,置于150 mL 三角瓶中,加入50 mL 超纯水;连续振荡2 h,3 500×g 下离心15 min,过0.45 μm水系滤膜;取10 mL 水样,利用TOC 分析仪测定[14]。选用水土比1∶2,混匀后放置15 min,利用pH 计测定。
1.4 数据处理
所获数据利用Excel 和SPSS13.0 软件进行统计分析及差异显著性检验。
2 结果(Results)
2.1 Streptomyces sp.的抗砷及还原砷能力
由图1 可见,当砷酸盐浓度从0 增加到40 mmol·L-1时,Streptomyces sp.的菌丝干质量随砷酸盐浓度的增加大幅度下降,但随着砷酸盐浓度的进一步升高(40 ~100 mmol·L-1),菌丝的干质量变化不大,由此可见,虽然砷能抑制Streptomyces sp.的正常生长,但该菌仍表现出极强的耐砷能力。
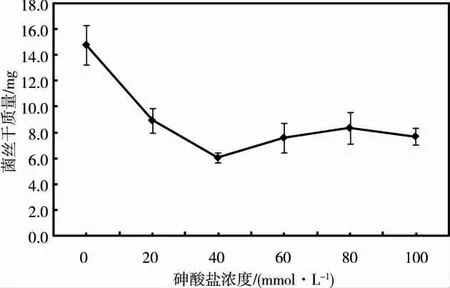
图1 不同浓度砷酸盐中Streptomyces sp.的生长情况Fig.1 Growth of Streptomyces sp.in different concentrations of arsenate
在有氧条件下,Streptomyces sp.能有效地将As(V)还原为As(III),在培养48 h 后,活性菌液处理组中的As(III)浓度达到60.08 mg·L-1,还原率达到96.5%。48 h 后As(III)的浓度变化渐趋平缓。微生物失活的对照组培养液中未检测出As(III),该结果表明As(V)还原主要是菌剂Streptomyces sp.的作用(图2)。
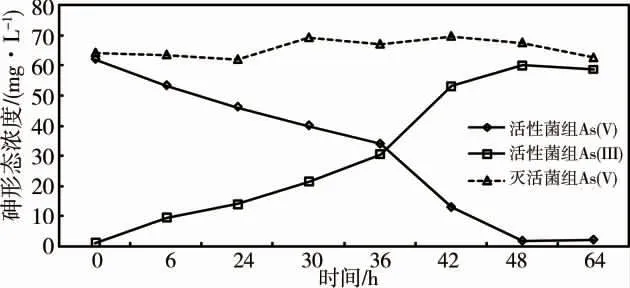
图2 Streptomyces sp.对砷酸盐的还原能力Fig.2 Arsenate reduction ability of Streptomyces sp.
2.2 Streptomyces sp.对蜈蚣草生长的影响
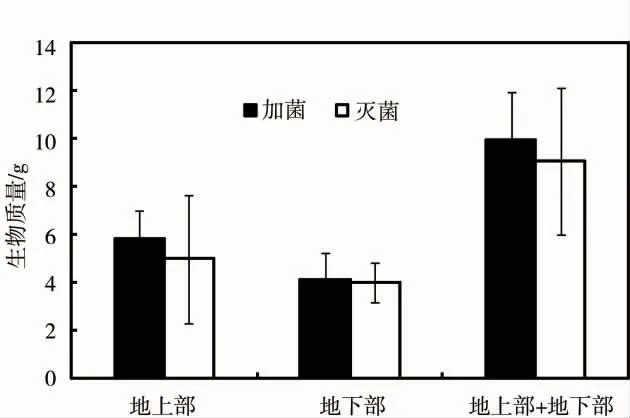
图3 Streptomyces sp.对蜈蚣草生长的影响Fig.3 Effect of Streptomyces sp.on growth of P.vittata
施用Streptomyces sp.对蜈蚣草生长的影响见图3。施加Streptomyces sp.的处理组中蜈蚣草地上、地下部分质量和生物总质量均高于施用灭菌处理的对照组,分别升高了16.91%、2.84%和10.04%。但统计结果无显著性差异。
2.3 添加Streptomyces sp.对蜈蚣草砷富集的影响
施加Streptomyces sp.对蜈蚣草砷吸收的影响见图4A。添加Streptomyces sp.处理组蜈蚣草的地上部砷含量为930 mg·kg-1,显著高于对照组(CK+P)的地上部砷含量(P <0.05),为对照组的1.76 倍。添加Streptomyces sp.的处理组中蜈蚣草的转运系数为2.22,是对照组的2.05 倍,表明添加Streptomyces sp.能显著提高蜈蚣草地上部对砷的吸收,促进蜈蚣草对砷从地下到地上部的转运。施用Streptomyces sp.处理后,蜈蚣草地下部砷浓度比对照组低14.41%,但未达显著性差异。添加Streptomyces sp.后对蜈蚣草砷累积的影响见图4B。与对照组相比,施用菌剂Streptomyces sp.能显著提高蜈蚣草地上部砷累积量(P <0.05),蜈蚣草地上部累积量是对照组的2.09 倍。施菌处理后,由于地下部生物量以及施菌对砷转运的影响,Streptomyces sp.地下部砷累积量较对照组降低了38.19%,差异显著(P <0.05)。以上结果表明,供试微生物Streptomyces sp.能强化蜈蚣草提取土壤砷,促进砷从蜈蚣草地下部向地上部转运,它可以作为强化植物砷修复的微生物材料。

图4 Streptomyces sp.菌对蜈蚣草砷累积的影响注:A,蜈蚣草砷浓度;B,蜈蚣草砷累积量。Fig.4 Effect of Streptomyces sp.on As accumulation of P.vittata
2.4 Streptomyces sp.对土壤总砷含量的影响
添加抗砷菌Streptomyces sp.后,蜈蚣草根际土壤的总砷浓度较其他各组均有显著下降(P <0.05)。与不种植物的对照组(CK)及菌土(S)组相比,分别降低了32.93%和33.99%;与对照组(CK+P)根际土壤相比,下降了22.06%。由于蜈蚣草对砷的超富集作用,CK+P 组的根际土壤砷含量与CK 和S 组比较,表现为显著降低(P <0.05),分别降低了18.93% 和18.06%,其砷含量下降量低于施加Streptomyces sp.菌处理(S+P)的蜈蚣草根际土壤。将蜈蚣草和微生物作为影响土壤总砷含量变化的因素,对根际土壤进行考虑交互作用的双因素方差分析,分析表明:施用Streptomyces sp.和种植蜈蚣草对土壤总砷含量的影响无明显的交互作用(F=1.80,P=0.21)。由表1 可见,Streptomyces sp.能有效增强蜈蚣草对根际土壤砷的去除能力,但在本实验条件下,Streptomyces sp.和蜈蚣草对于根际土壤砷去除能力未出现交互作用,表现为相加作用。
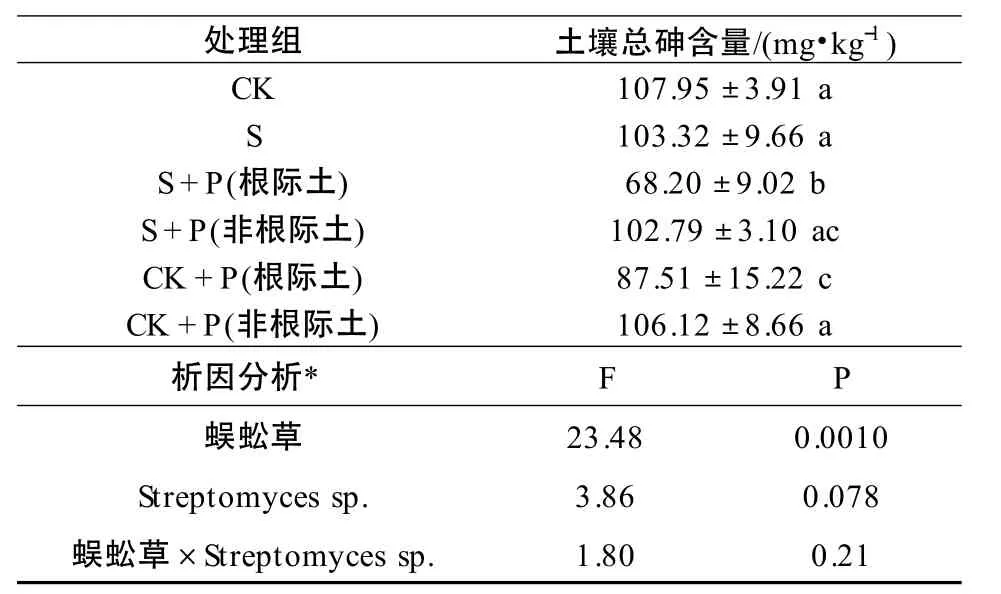
表1 Streptomyces sp.对土壤中砷浓度的影响Table 1 Effect of Streptomyces sp.on As concentration in soil
2.5 Streptomyces sp.对土壤中砷形态及价态的影响
添加Streptomyces sp.各处理组土壤砷形态结果见表2。各处理组中的土壤均能检测到As(Ⅴ)和As(Ⅲ),其中以As(Ⅴ)为主,占土壤总砷的86.30%~99.43%,As(Ⅲ)中占土壤总砷的0.56% ~8.15%,S 组及S+P 组土壤中As(Ⅲ)浓度较高。由表2 可知,Streptomyces sp.菌土组(S 组)中的As(Ⅲ)浓度是CK 组的2.03 倍,具有显著性差异(P <0.05),表明Streptomyces sp.在盆栽条下能促进土壤中As(Ⅴ)的还原。施加Streptomyces sp.后,蜈蚣草根际土壤的As(Ⅲ)浓度显著高于其他处理组(P <0.05),是CK 的7.23 倍,是CK+P 组根际土壤的5.33 倍。将蜈蚣草和微生物作为影响土壤As(Ⅲ)变化的因素,对根际土壤进行考虑交互作用的双因素方差分析,蜈蚣草和Streptomyces sp.对根际土壤中As(Ⅲ)具有显著交互作用(P <0.05),能显著增加根际土壤中的As(Ⅲ)浓度。以上结果表明,加入Streptomyces sp.菌后,能促进根际土壤中As(Ⅴ)还原成As(Ⅲ),Streptomyces sp.和蜈蚣草对于这一过程具有协同作用。
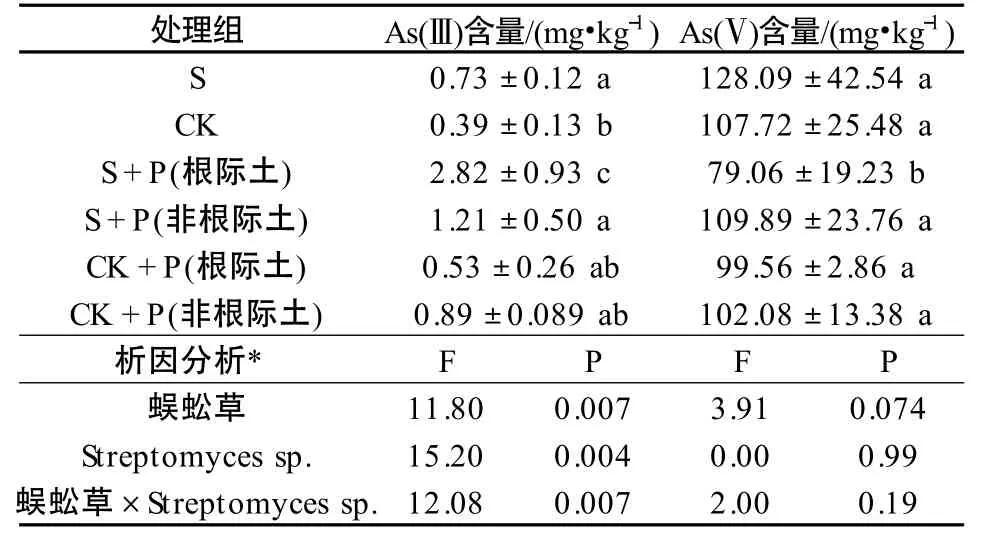
表2 Streptomyces sp.对土壤中砷价态的影响Table 2 Effect of Streptomyces sp.on As speciation in soil
Streptomyces sp.对土壤砷结合形态的影响见表3,添加Streptomyces sp.菌液的土壤的残渣态砷(O-As)显著低于CK,下降了24.49%(P <0.05),表明抗砷菌Streptomyces sp.在土壤中可促进土壤中生物有效性最低的残渣态砷的转化。与CK 比较,S+P 处理组根际土壤松散态结合砷(L-As)、铝结合态砷(Al-As)、铁结合态砷(Fe-As)和残渣态砷(O-As)等4 种砷形态的含量均显著降低(P <0.05),分别下降了86.16%、67.79%、49.48%和40.29%,其中OAs 从48.15 mg·kg-1下降至28.75 mg·kg-1,占S+P处理组根际土壤总砷含量下降的49.74%。与CK+P 相比,S+P 处理组的蜈蚣草根际土壤的Al-As、Fe-As 和O-As 含量均显著降低(P <0.05),分别下降了50.82%、38.39%和45.64%。这说明,抗砷菌Streptomyces sp.能通过增强蜈蚣草对根际土壤的Al-As、Fe-As 以及O-As 等生物有效性低的砷形态的吸收利用,提高蜈蚣草对根际土壤砷的提取作用。
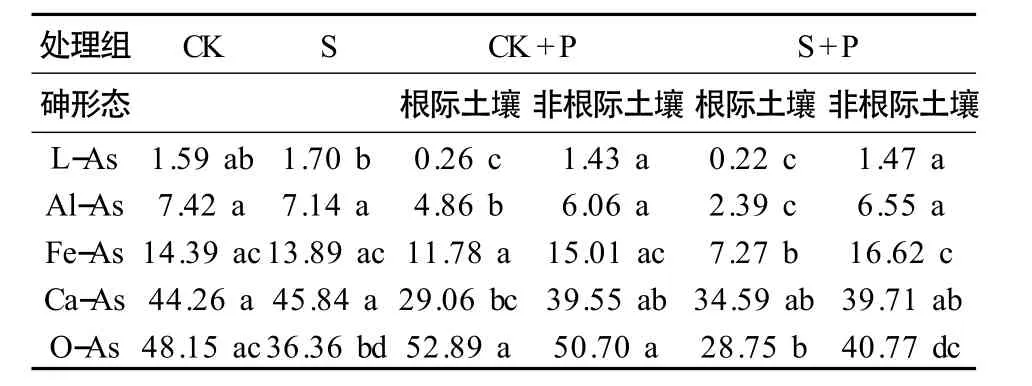
表3 Streptomyces sp.对土壤砷结合形态的影响Table 3 Effect of Streptomyces sp.on As fractions in soil(mg·kg-1)
2.6 Streptomyces sp.对土壤中根际环境的影响
图5 为施加Streptomyces sp.处理后蜈蚣草根际和非根际水溶液中的pH 值。结果表明,非根际土壤溶液的pH 值为7.83 ~7.85,根际土壤溶液pH值为8.30 ~8.32,均呈弱碱性。CK+P 和S+P 处理组的蜈蚣草根际土壤均高于非根际土壤的pH值,可增加至0.47 个单位。施加Streptomyces sp.后根际和非根际土壤均比施加灭活菌液处理组的pH值增加了0.02 个单位。这表明施加Streptomyces sp.可影响土壤pH 值,从而引起根际环境的变化。
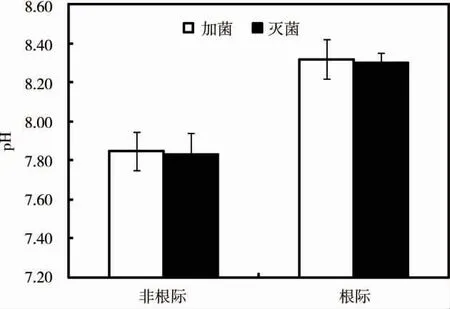
图5 Streptomyces sp.对根际pH 值的影响Fig.5 Effect of Streptomyces sp.on pH in rhizosphere soil
添加Streptomyces sp.对蜈蚣草土壤中DOC 的影响见表4。S+P 处理组的根际土壤中DOC 的含量高于其他各组,与CK+P 根际土壤相比,增加18.10%,但未达显著性差异(P >0.05);较S 和CK 组分别增加27.91%和83.70%,具有显著性差异(P <0.05)。CK+P 组由于植物根际分泌物的作用,其根际DOC 的含量仍然高于S 和CK 处理组,但增加量较S+P 组的根际土壤低,分别增加8.34%和54.46%。对根际土壤DOC 含量进行交互作用分析,结果表明:蜈蚣草和Streptomyces sp.共同作用对根际土壤DOC 浓度不存在交互作用,联合作用呈相加作用。

表4 Streptomyces sp.对土壤中DOC 的影响Table 4 Effect of Streptomyces sp.on DOC in soil(mg·kg-1)
3 讨论(Discussion)
植物修复技术被认为是治理土壤砷污染最经济有效的途径之一[15],然而植物修复砷的效率常受到植物生长速度和生物量、砷含量及砷的生物有效性等因素限制。笔者近年来一直探索利用微生物强化植物修复砷污染土壤,本研究结果表明,在蜈蚣草中添加抗砷微生物Streptomyces sp.后,蜈蚣草地上部砷浓度比同期对照组高75.52%,蜈蚣草总砷累积量比同期对照高45.07%,应用Streptomyces sp.能有效强化蜈蚣草对砷的吸收与富集,从而提高蜈蚣草修复砷污染土壤的效率。Ghosh 等[16]从蜈蚣草根际土壤中分离假单胞菌、丛毛单胞菌和寡养单胞菌等抗砷菌株,水培实验结果表明,菌株能有效促进蜈蚣草的生长,增加蜈蚣草砷含量,可达对照组的1.96 倍。曾东等[17]从湖南某砷污染地区蜈蚣草根系及根系新鲜土中筛选出11 组抗砷菌,盆栽实验结果表明,抗砷菌在一定程度上能够刺激蜈蚣草的生长,提高蜈蚣草的生物量,促进砷由蜈蚣草的地下部向地上部转运。Liu 等[18]发现在蜈蚣草根部中接种丛枝菌根真菌可以增加蜈蚣草生物量,促进蜈蚣草砷吸收。课题组前期研究发现,在蜈蚣草中加入Streptomyces sp.可促进蜈蚣草生物量呈显著增加[10],本实验中施用含有参与砷还原转化的arsC 基因抗砷菌Streptomyces sp.后也能促进蜈蚣草的生长,其较对照组高出10.04%。微生物通过促进植物生长,提高植物生物总量,从而增加植物对砷的积累,这是微生物提高植物修复效率的重要途径之一。
土壤中砷主要以As(Ⅴ)为主,As(Ⅴ)通过化学吸附和(或)表面沉淀作用在土壤及粘土矿物上吸附,其移动性和生物活性都低于As(Ⅲ)[19]。已有研究表明,环境中的异化砷还原微生物可将吸附在矿物或沉积物上的As(Ⅴ)还原为具移动性和毒性更强的As(Ⅲ),将砷从固相释放到液相中[20]。Yamamura 等[21]将异化砷还原菌添加到含砷的土壤中,发现其可将土壤中As(Ⅴ)转化为移动性更强的As(Ⅲ),他认为,该种微生物为促进植物砷吸收提供了可能。本实验研究发现,施加抗砷菌Streptomyces sp.后,蜈蚣草根际土壤中As(III)含量较植物对照组提高了4.3 倍,并且根际土壤中Al-As、Fe-As 以及O-As含量均显著降低,为蜈蚣草提供了更多的可利用态砷。根际环境是植物根系在生理过程下形成的不同于原土的,具有特殊物理、化学和生物学性质的动态微型生态系统,其根际环境中的pH 值、根系分泌物等直接影响重金属的固定和活化状态,从而影响到重金属在土壤-植物过程中的迁移转化行为[22]。土壤pH 值变化受根系分泌物的种类与数量、微生物数量或活性影响,是影响土壤中砷吸附的重要因素。土壤pH 值影响砷的有效性,pH 值越高,土壤中的铁、铝氧化物易带负电荷,有利于土壤砷的溶出,土壤有效态砷含量增加[23]。Fitz 等[24]根据已有的植物根际研究结果,推测了砷在根际中的可能变化,他认为,根际pH 值升高会造成As(Ⅴ)可溶性增加,反之则会降低。本研究结果证实了这一推测,添加抗砷菌Streptomyces sp.使蜈蚣草根际土壤的pH 值有所增加,根际As(III)含量增加,土壤中铁、铝结合态及残渣态含量降低。
可溶性有机质是控制砷的迁移和转换过程中的重要因素[25]。在有氧条件下,有机质含量可以促进微生物代谢,进一步影响砷的氧化还原作用,从而影响砷在土壤中的移动性及生物可利用性[26]。Balasoiu 等[27]报道了在铬化砷酸铜(CCA)污染土壤中,随着有机质含量增加,土壤中As(III)比例增加。本实验结果表明:加入Streptomyces sp.后蜈蚣草根际DOC 含量较植物对照组增加18.10%,蜈蚣草根际As(III)较植物对照组显著性增加。可溶性有机质可以通过竞争吸附作用减少砷在土壤表面的吸附,进而增加难溶态砷的转化和增强砷的移动性[28]。Tu等[29]发现蜈蚣草在砷胁迫下分泌出大量的可溶解有机碳,可促进土壤中砷酸铁(Fe-As)和砷酸铝(Al-As)矿物溶解及砷的释放。本研究中添加Streptomyces sp.后,随着蜈蚣草根际DOC 含量增加,土壤中Al、Fe 结合态和残渣态砷含量显著降低,与Tu的研究结果一致。
综上所述,抗砷微生物Streptomyces sp.可作为强化蜈蚣草砷修复的微生物材料,其表现出了较好的促植物砷吸收作用,Streptomyces sp.通过影响蜈蚣草根际环境,增加蜈蚣草根际土壤pH、DOC 含量促进砷形态变化,增加砷生物可利用性,从而促进蜈蚣草对砷的富集。
[1] Vahter M E.Interactions between arsenic-induced toxicity and nutrition in early life[J].The Journal of Nutrition,2007,137(12):2798-2804
[2] Nordstrom D K.Worldwide occurrences of arsenic in ground water[J].Science,2002,296(5576):2143-2145
[3] Sun G.Arsenic contamination and arsenicosis in China[J].Toxicology and Applied Pharmacology,2004,198(3):268-271
[4] 廖晓勇,陈同斌,谢华,等.磷肥对砷污染土壤的植物修复效率的影响:田间实例研究[J].环境科学学报,2004,24(3):455-462 Liao X Y,Chen T B,Xie H,et al.Effect of application of P fertilizer on efficiency of As removal from Ascontaminated soil using phytoremediation:Field study[J].Acta Scientiae Circumstantiae,2004,24(3):455-462(in Chinese)
[5] Ma L Q,Komar K M,Tu C,et al.A fern that hyperaccumulates arsenic[J].Nature,2001,409(6820):579
[6] Silva Gonzaga M I,Santos J A G,Ma L Q.Arsenic chemistry in the rhizosphere of Pteris vittata L.and Nephrolepis exaltata L.[J].Environmental Pollution,2006,143(2):254 -260
[7] Wu G,Kang H,Zhang X,et al.A critical review on the bio-removal of hazardous heavy metals from contaminated soils:Issues, progress, eco-environmental concerns and opportunities[J].Journal of Hazardous Materials,2010,174(1-3):1-8
[8] Khan M S,Zaidi A,Wani P A,et al.Role of Plant Growth Promoting Rhizobacteria in the Remediation of Metal Contaminated Soils:A Review[M]//Lichtfouse E.Organic Farming,Pest Control and Remediation of Soil Pollutants.New York:Springer,2010:1,319
[9] Glick B R.Using soil bacteria to facilitate phytoremediation[J].Biotechnology Advances,2010,28(3):367-374
[10] 赵根成,廖晓勇,阎秀兰,等.微生物强化蜈蚣草累积土壤砷能力的研究[J].环境科学,2010,31(2):431-436 Zhao C G,Liao X Y,Yan X L,et al.Enhancement of As-accumulation by Pteris vittata L.affected by microorganisms[J].Environmental Science,2010,31(2):431-436(in Chinese)
[11] Garcia-Manyes S,Jiménez G,Padróc A,et al.Arsenic speciation in contaminated soils[J].Talanta,2002,58(1):97-107
[12] Zhang W H,Cai Y,Tu C,et al.Arsenic speciation and distribution in an arsenic hyperaccumulating plant[J].Science of the Total Environment,2002,300(1-3):167-177
[13] 武斌,廖晓勇,阎秀兰,等.石灰性土壤中砷形态分级方法的比较及其最佳方案[J].环境科学学报,2006,26(9):1467-1469 Wu B,Liao X Y,Yan X L,et al.Comparison of five methods for fractionation of calcareous soil contaminated with arsenic [J].Acta Scientiae Circumstantiae,2006,26(9):1467-1469(in Chinese)
[14] Silva Gonzaga M I,Ma L Q,Santos J A G,et al.Rhizosphere characteristics of two arsenic hyperaccumulating Pteris ferns[J].Science of the Total Environment,2009,407(16):4711 -4716
[15] Cunningham S D,Ow D W.Promises and prospects of phytoremediation[J].Plant Physiology,1996,110(3):715-719
[16] Ghosh P,Rathinasabapathi B,Ma L Q.Arsenic-resistant bacteria solubilized arsenic in the growth media and increased growth of arsenic hyperaccumulator Pteris vittata L.[J].Bioresource Technology,2011,102(19):8756-8761
[17] 曾东,许振成.抗砷菌对蜈蚣草生长及其砷吸收能力的影响[J].环境污染与防治,2010(5):43-46 Zeng D,Xu Z C.Effect of arsenite-resistent bacteria on growth and arsenite adsorption capacity of Pteris vittata L[J].Environmental Pollution&Control,2010(5):43-46(in Chinese)
[18] Liu Y,Christie P,Zhang J,et al.Growth and arsenic uptake by Chinese brake fern inoculated with an arbuscular mycorrhizal fungus[J].Environmental and Experimental Botany,2009,66(3):435-441
[19] 罗磊,张淑贞,马义兵.土壤中砷吸附机理及其影响因素研究进展[J].土壤,2008,40(3):351-359 Luo L,Zhang S Z,Ma Y B.Advance in research on arsenic sorption and its affecting factors in soils[J].Soil,2008,40(3):351-359(in Chinese)
[20] 陈倩,苏建强,朱永官.微生物砷还原机制的研究进展[J].生态毒理学报,2011,6(3):225-233 Chen Q,Su J Q,Zhu Y G.Advances in mechanisms of microbial arsenate reduction[J].Asian Journal of Ecotoxicology,2011,6(3):225-233(in Chinese)
[21] Yamamura S,Watanabe M,Yamamoto N,et al.Potential for microbially mediated redox transformations and mobilization of arsenic in uncontaminated soils[J].Chemosphere,2009,77(2):169-174
[22] 徐卫红,黄河,王爱华,等.根系分泌物对土壤重金属活化及其机理研究进展[J].生态环境,2006,15(1):184-189 Xu W H,Huang H,Wang A H,et al.Advance in studies on activation of heavy metal by root exudates and mechanism[J].Ecology and Environment,2006,15(1):184-189(in Chinese)
[23] Masscheleyn P H,Delaune R D,Patrick Jr W H.Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J].Environmental Science&Technology,1991,25(8):1414-1419
[24] Fitz W J,Wenzel W W.Arsenic transformations in the soil-rhizosphere-plant system: Fundamentals and potential application to phytoremediation[J].Journal of Biotechnology,2002,99(3):259-278
[25] 刘广良,蔡勇.环境中砷与溶解有机质的络合作用[J].环境化学,2011,30(1):51-53 Liu G L,Cai Y.Complexation of arsenic with dissolved organic matter in the environment[J].Environmental Chemistry,2011,30(1):51-53(in Chinese)
[26] Dobran S,Zagury G J.Arsenic speciation and mobilization in CCA-contaminated soils:Influence of organic matter content[J].Science of the Total Environment,2006,364(1-3):239-250
[27] Balasoiu C F,Zagury G J,Deschênes L.Partitioning and speciation of chromium,copper,and arsenic in CCAcontaminated soils:Influence of soil composition[J].Science of the Total Environment,2001,280(1-3):239-255
[28] Wang S,Mulligan C N.Effect of natural organic matter on arsenic release from soils and sediments into groundwater[J].Environmental Geochemistry and Health,2006,28(3):197-214
[29] Tu S,Ma L,Luongo T.Root exudates and arsenic accumulation in arsenic hyperaccumulating Pteris vittata and non-hyperaccumulating Nephrolepis exaltata[J].Plant and Soil,2004,258(1):9 -19
