黑莓品种‘Arapaho’离体叶片不定芽诱导影响因素分析及再生体系建立
2012-12-31王鲁北张春红王小敏吴文龙李维林
王鲁北,张春红,王小敏,吴文龙,李维林
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
黑莓(Rubus spp.)隶属于蔷薇科(Rosaceae)悬钩子属(Rubus L.),为半灌木浆果类果树,其果实营养丰富,具有防衰老和提高人体免疫力等功效[1-2],是近年来国内外新兴起的第三代果树之一,具有很高的经济价值,因而,开展优良黑莓品种的培育和推广具有重要的应用和经济价值。目前,黑莓育种多以实生选优、杂交育种、辐射育种等手段为主[3],但是这些方法具有一定的局限性,进程也比较慢,严重制约了黑莓优良品种的选育。随着分子生物技术的发展,基因工程技术为黑莓育种开辟了一条新途径,通过基因工程方法,可以有针对性地引入特定基因,从而获得具有优良性状的转基因黑莓植株。
‘Arapaho’是由美国阿肯色州大学于1992年推出的一个黑莓品种[4]。该品种于2004年被引入南京,表现出直立、无刺、早熟的优良特性,但适应性较差[5]。因此,可利用转基因技术导入相关抗逆基因,以提高‘Arapaho’的抗逆性,使其更适宜在南京地区种植。
目前常用的遗传转化方法为叶盘法,其成功的关键在于拥有一个高效而稳定的不定芽离体再生系统,因此,离体叶片再生体系的建立是开展果树生物技术育种的重要基础。然而,目前有关黑莓组织培养的研究均以茎尖和腋芽培养为主,关于叶片再生培养的研究报道较少[6-9],而有关黑莓品种‘Arapaho’离体叶片再生体系的研究尚未见报道。
鉴于此,作者以黑莓品种‘Arapaho’叶片为外植体,对影响叶片不定芽植株再生的培养条件(包括基本培养基类型、6-BA和IBA质量浓度、暗培养时间及外植体的叶位和接种方式)以及不定芽生根的适宜IBA质量浓度进行比较研究,筛选出适合黑莓品种‘Arapaho’叶片不定芽植株再生的培养体系,以期为其品质改良和遗传转化奠定研究基础。
1 材料和方法
1.1 材料及基本培养条件
黑莓品种‘Arapaho’无菌苗叶片取自江苏省·中国科学院植物研究所黑莓组织培养实验室。该无菌苗诱导自大田植株当年生新梢上带腋芽的茎段,并在含0.5 mg·L-16-BA和0.3 mg·L-1NAA的MS培养基上继代培养30~40 d。取无菌苗中上部完全展开的叶片,剪去叶尖及叶缘并保留2~3 mm叶柄,作为外植体。
除特殊说明外,均取无菌苗形态学第1位至第5位的叶片,叶面朝上接种在培养基上,接种后均先暗培养3周后再进行光照培养。参照文献[10]设置培养基的pH和琼脂浓度及基本培养条件(如光照强度、培养温度和时间等)。
1.2 方法
1.2.1 基本培养基类型和外源激素质量浓度的比较 采用4因素3水平正交实验设计方法〔L9(3)4〕,4个因素包括基本培养基类型(MS、WPM和N6)、6-BA质量浓度(1.0、2.0和4.0 mg·L-1)、IBA质量浓度(0.1、0.5和1.0 mg·L-1)和空列,培养40 d后观察并统计叶片不定芽诱导率及平均不定芽数。每处理4瓶,每瓶接种5片叶,并重复3次。
1.2.2 暗培养时间的比较 将外植体叶片接种于含有2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基上,分别经过0(CK)、7、14、21和28 d的暗培养后再进行光照培养,40 d后统计叶片不定芽诱导率及平均不定芽数。每处理接种4瓶,每瓶接种5片叶,并重复3次。
1.2.3 叶位的比较 分别取无菌苗形态学的1和2位、3和4位、5和6位、7和8位、9和10位叶片,接种于含有2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基上,培养40 d后统计叶片不定芽诱导率及平均不定芽数。每处理4瓶,每瓶接种5片叶,并重复3次。
1.2.4 接种方式的比较 按照叶面朝上和叶面朝下2种方式将叶片接种于含有2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基上,培养40 d后统计叶片不定芽诱导率及平均不定芽数。每处理4瓶,每瓶接种5片叶,并重复3次。
1.2.5 生根培养基中IBA添加量的比较 诱导培养30 d后将不定芽从外植体上切下,接种于含有0.5 mg·L-16-BA和0.3 mg·L-1NAA的MS培养基上继代培养,不定芽高约2 cm时,将其从基部切下,分别接种于含有0.05、0.10、0.20和0.50 mg·L-1IBA的MS培养基上诱导生根;20 d后测量和统计不定芽的生根率及单株的平均根干质量、根数和根长。每处理3瓶,每瓶3~4个不定芽,并重复3次。
1.3 数据处理
参照以下公式分别计算不定芽诱导率、平均不定芽数、生根率和平均根数:不定芽诱导率=(形成不定芽的叶片数/接种的叶片总数)×100%;平均不定芽数=不定芽总数/形成不定芽的叶片数;生根率=(生根的不定芽数/接种的不定芽总数)×100%;平均根数=根总数/生根不定芽总数。
采用Excel 2007软件对实验数据进行统计和差异显著性分析。
2 结果和分析
2.1 叶片不定芽诱导过程中影响因素的分析
2.1.1 基本培养基类型和外源激素质量浓度的比较 接种2周左右,叶片边缘贴近培养基的地方开始出现少量绿色或黄绿色愈伤组织;培养20 d后,在叶片部分伤口及愈伤组织处可以看到明显的绿色芽点,尤以叶片和叶柄相连接处伤口的芽点数居多;随后,芽点迅速生长,发育为不定芽。
正交实验结果(表1)表明:在基本培养基类型和外源激素质量浓度不同的培养基中叶片的不定芽诱导率存在差异,在9个处理组中,含有2.0 mg·L-16-BA和0.5 mg·L-1IBA的MS培养基的不定芽诱导效果最佳,不定芽诱导率达64.52%,平均不定芽数为3.85。3个因素按不定芽诱导率由大到小依次排序为基本培养基类型、6-BA质量浓度、IBA质量浓度,最佳诱导培养基应为含有2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基;3个因素按平均不定芽数由大到小依次排序为基本培养基类型、IBA质量浓度、6-BA质量浓度,最佳诱导培养基应为含有2.0 mg·L-16-BA和0.5 mg·L-1IBA的MS培养基。对于离体叶片再生体系而言,叶片不定芽诱导率是首要的考察指标,因而,含有2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基为黑莓品种‘Arapaho’离体叶片不定芽诱导的最佳培养基。

表1 黑莓品种‘Arapaho’离体叶片不定芽诱导体系中基本培养基类型和外源激素质量浓度的正交实验结果1)Table 1 Orthogonal experiment result of basic medium type and exogenous hormone concentration in induction system of adventitious bud from in vitro leaves of blackberry cultivar‘Arapaho’1)
2.1.2 暗培养时间的比较 暗培养时间对黑莓品种‘Arapaho’叶片不定芽诱导的影响见表2。结果表明:与对照相比,经过不同时间的暗培养,不定芽诱导率和平均不定芽数有一定差异;经过21 d的暗培养,不定芽诱导率极显著高于对照(P<0.01),但平均不定芽数与对照差异不显著。随暗培养时间的延长,叶片不定芽诱导率和平均不定芽数均呈先升高后降低的变化趋势,其中暗培养时间达到21 d,不定芽诱导率最高(67.08%);但暗培养时间延长至28 d,叶片不定芽诱导率下降至51.63%。说明暗培养时间对黑莓品种‘Arapaho’叶片不定芽形成有重要影响,适宜的暗培养时间可提高叶片的不定芽诱导率,但暗培养时间过长则会导致不定芽诱导率降低。综合分析结果显示:在黑莓品种‘Arapaho’叶片不定芽诱导过程中,最适宜的暗培养时间为21 d。

表2 暗培养时间对黑莓品种‘Arapaho’叶片不定芽诱导率和平均不定芽数的影响1)Table 2 Effects of dark culture time on induction rate and average number of adventitious bud from in vitro leaves of blackberry cultivar‘Arapaho’1)
2.1.3 外植体叶位的比较 外植体叶位对黑莓品种‘Arapaho’叶片不定芽诱导的影响见表3。结果表明:采用不同叶位的叶片作为外植体,不定芽诱导率存在一定差异,其中,第3至第6位叶的不定芽诱导率极显著高于第9和第10位叶,但平均不定芽数差异不显著。第3和第4位叶的不定芽诱导率最高,达到71.74%,平均不定芽数也最多,为2.46;第5和第6位叶的不定芽诱导率为66.47%,平均不定芽数为2.31。综合分析结果显示:黑莓品种‘Arapaho’植株中、上部叶片的不定芽诱导能力优于下部叶片,其中第3和第4叶位为适宜的外植体取样叶位。

表3 外植体叶位对黑莓品种‘Arapaho’叶片不定芽诱导率和平均不定芽数的影响1)Table 3 Effects of leaf position of exp lants on induction rate and average number of adventitious bud from in vitro leaves of blackberry cultivar‘Arapaho’1)
2.1.4 接种方式的比较 采用叶片正放和反放2种方式进行接种,黑莓品种‘Arapaho’叶片不定芽诱导率和平均不定芽数有明显差异。采用正放方式(即叶面朝上)接种的叶片不定芽诱导率达64.29%,平均不定芽数为2.87;采用反放方式(即叶面朝下)接种的叶片不定芽诱导率为32.87%,平均不定芽数为1.44。差异显著性分析结果表明:2种接种方式的叶片不定芽诱导率和平均不定芽数差异极显著(P<0.01)。综合分析结果表明:在黑莓品种‘Arapaho’叶片不定芽诱导过程中,适宜的外植体接种方式是叶片正放。
2.2 IBA质量浓度对不定芽生根的影响
观察结果表明:接种在生根培养基上10 d后,黑莓品种‘Arapaho’的不定芽开始萌根,随后根开始进行伸长生长,20 d后形成完整植株。表4结果表明:接种在含有0.00~0.50 mg·L-1IBA的MS培养基上,不定芽的生根率均达到100.0%;但部分培养基的平均生根数、平均根长和平均单株根干质量存在显著或极显著差异。在不添加IBA的MS培养基(对照)上,不定芽的平均根长最长(4.4 cm),但平均根数少,根细长且侧根很少;在添加0.20 mg·L-1IBA的MS培养基上,平均根长较长(3.20 cm),平均根数最多(6.90条),平均单株根干质量最大(8.10 mg),且平均根数和平均单株根干质量极显著高于对照(P<0.01)。综合分析结果显示:含有0.2 mg·L-1IBA的MS培养基是最适宜于黑莓品种‘Arapaho’叶片不定芽生根的培养基,生根率可达100.0%,且侧根较多、根长势良好。
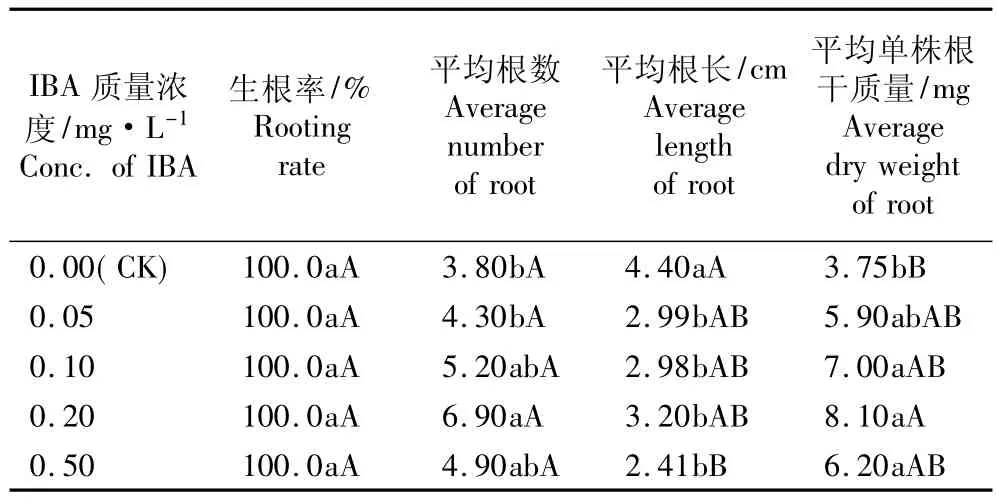
表4 生根培养基中IBA质量浓度对黑莓品种‘Arapaho’叶片不定芽生根的影响1)Table 4 Effect of IBA concentration in rootingmedium on rooting of adventitious bud from in vitro leaves of blackberry cultivar‘Arapaho’1)
3 讨论和结论
通常,外源激素种类和浓度以及基本培养基类型是影响植株再生的关键因素。不同基因型黑莓离体叶片的再生能力迥异,其适宜的外源激素的种类、浓度和配比等条件差异较大。正交实验结果表明:基本培养基类型对黑莓品种‘Arapaho’叶片不定芽诱导的影响最大,在供试的3种基本培养基(MS、WPM和N6)中,MS培养基最适于黑莓‘Arapaho’叶片不定芽诱导;而基本培养基中需要添加的最佳激素组合为2.0 mg·L-16-BA和1.0 mg·L-1IBA,这与他人的相关研究结果有一定差异。由文献[9,11]可见:MS是适合黑莓叶片再生的基本培养基,但培养基中添加的外源激素以TDZ居多。其原因可能与不同基因型黑莓的内源激素水平和生理状态等相关。由于作者仅研究了6-BA和IBA组合对黑莓品种‘Arapaho’叶片不定芽诱导的影响,而TDZ是否可以使其不定芽诱导率达到更高,则有待进一步研究。
目前,在许多植物的离体叶片培养中均证实暗培养可以促进不定芽的诱导[12-14],本研究也得出了类似的结果。虽然暗培养不是黑莓品种‘Arapaho’离体叶片不定芽诱导的必需条件,但可显著提高不定芽诱导率,而对不定芽数的影响却不明显。
以黑莓品种‘Arapaho’第3和第4位叶为外植体,不定芽诱导率最高;其次是第5和第6位叶;第1和第2位叶的不定芽诱导率也较高;而第7至第10位叶的不定芽诱导率最低,均在40%以下。说明黑莓品种‘Arapaho’无菌苗植株的中、上部叶片比下部叶片的再生能力强,有利于不定芽分化,这与周瑞金等[15]的研究结果相似,其原因可能与不同叶位叶片的内源激素水平分布差异有关。
离体叶片的接种方式对叶片再生效应的影响有差异。在黑莓品种‘Arapaho’叶片不定芽诱导过程中,正放(叶面朝上)叶片的不定芽诱导率及平均不定芽数均极显著高于反放(叶面朝下)叶片。可见,叶面朝上接种更有利于黑莓品种‘Arapaho’不定芽的诱导,这与Nehra等[16]和安伟[17]的研究结果有一定差异,其原因可能与黑莓叶片背面气孔多、结构疏松,更有利于营养的吸收有关。
根据上述实验结果,初步建立了适宜于黑莓品种‘Arapaho’离体叶片的再生体系:取无菌苗第3和第4位叶片,适当修剪后,叶面朝上接到含2.0 mg·L-16-BA和1.0 mg·L-1IBA的MS培养基上,暗培养21 d后进行光照培养;30 d后将不定芽接种到含有0.5mg·L-16-BA和0.3mg·L-1NAA的MS培养基上进行继代培养;待不定芽高约2 cm时接种到含有0.2 mg·L-1IBA的MS培养基上进行生根培养。
[1]张胜利.树莓和黑莓[J].新疆林业,2002(5):40.
[2]吴文龙,李维林,闾连飞,等.不同品种黑莓鲜果营养成分的比较[J].植物资源与环境学报,2007,16(1):58-61.
[3]吴文龙,李维林,闾连飞,等.黑莓引种栽培与利用[M].南京:江苏科学技术出版社,2010:1-3.
[4]MOORE JN,Clark JR.‘Arapaho’erect,thornless blackberry[J].HortScience,1993,28(8):861-862.
[5]任冰如,吴文龙,闾连飞,等.不同黑莓品种的抗冻性分析[J].植物资源与环境学报,2008,17(1):54-56.
[6]李海燕,王小敏,李维林,等.黑莓品种‘Chester’离体培养过程中适宜激素种类和浓度以及光照度的筛选[J].植物资源与环境学报,2010,19(2):68-74.
[7]TURK B A,SWARTZH J,ZIMMERMAN R H.Adventitious shoot regeneration from in vitro:cultured leaves of Rubus genotypes[J].Plant Cell,Tissue and Organ Culture,1994,38(1):11-17.
[8]MENG R G,CHEN T H H,FINN C E,et al.Improving in vitro plant regeneration from leaf and petiole explants of‘Marion’blackberry[J].HortScience,2004,39(2):316-320.
[9]吴延军,谢 鸣,蒋桂华,等.黑莓试管苗叶片植株的再生[J].果树学报,2006,23(3):468-470,F0004.
[10]王小敏,吴文龙,李海燕,等.黑莓外植体褐化影响因素分析及适宜培养条件筛选[J].植物资源与环境学报,2009,18 (3):63-68.
[11]GUPTA S,MAHALAXMIV.In vitro high frequency direct plant regeneration from whole leaves of blackberry[J].Scientia Horticulturae,2009,120(1):22-26.
[12]徐凌飞,马锋旺,王喆之,等.梨叶片离体培养和植株再生[J].园艺学报,2002,29(4):367-368.
[13]王 翡,高志红,章 镇,等.草莓高效离体叶片再生体系的建立[J].西北植物学报,2010,30(5):1045-1049.
[14]师校欣,杜国强,高 仪,等.黑暗培养对苹果组培快繁及叶片再生的影响[J].河北农业大学学报,2004,27(4):18-21.
[15]周瑞金,刘孟军.枣离体叶片高效再生植株的研究[J].园艺学报,2006,33(3):625-628.
[16]NEHRA N S,STUSHNOFF C,KARTHA K K.Direct shoot regeneration from strawberry leaf disks[J].Journal of the American Society for Horticultural Science,1989,114(6): 1014-1018.
[17]安 伟.树莓叶片离体再生及植酸酶基因转化的研究[D].长春:吉林农业大学园艺学院,2002:14.
