碳羟磷灰石(CHAP)吸附废水中锰离子的动力学研究
2012-12-31廖德祥蔡宏辉
廖德祥,蔡宏辉,钟 琼
(1.上海海事大学海洋环境与工程学院,上海 201306;2.长沙环境保护职业技术学院环境工程系,湖南长沙 410082)
锰是一种重要的金属元素,在工业上用途很广,需求量很大,是冶金工业中一种重要的原料,生产1 t钢大约需13~14 kg锰,此外,锰还用于有色金属、化工、医药、食品、分析和科研等方面[1]。2009年我国电解金属锰生总产能力达到211.42万t/a,占世界电解锰生产能力的98%[2]。在电解锰工业生产过程中,需要排放大量的工业废水,每生产1 t电解锰,大约需要排放工业废水约350 t左右[3]。电解废水中主要是锰离子和六价铬等重金属离子,重金属废水给环境带来了严重危害,水体中重金属可沿食物链被生物吸附和富集,在人体积累并造成慢性中毒。重金属废水处理的方法很多,常用的有化学沉淀法、氧化还原法、离子交换法等,但是这些方法在处理低浓度重金属废水时,存在处理成本高、容易产生二次污染等缺点[4]。近年来,新型廉价的吸附材料的开发应用是重金属离子废水处理研究重点。含有CO32-的碳羟磷灰石(CHAP)作为一种新型吸附剂,制作方法简单,并且实现了“以废治废”的目的,具有较高的开发应用价值[5]。目前许多研究者利用CHAP吸附处理废水中的 Hg2+、Cd2+、Pb2+等重金属离子,并取得很好的效果[6-8]。但是关于CHAP对M n2+的吸附性能及其吸附过程的动力学研究不多。因此本文采用自制的碳羟磷灰石(CHAP)作为吸附剂,对M n2+进行吸附研究。
1 材料及方法
1.1 试验试剂及仪器
试验用的含锰废水采用人工模拟废水,由分析纯M nSO4·7H2O和去离子水配制。
CHAP制备所用材料:废弃的蛋壳和磷酸为主要材料,尿素((NH2)2CO)为添加剂,其余材料包括Ca(OH)2、质量分数为 1%的 NH4Cl、KOH,具体制备方法见郑伟等人[5]和唐文清等人[9]的研究。
主要仪器:Agilent 3510原子吸收分光光度计,JB22电磁搅拌器,PHS-3TC精密酸度计,M Y300026B普通型混凝电动搅拌仪,DHG29076A型电热恒温鼓风干燥箱,自动电子天平。
1.2 吸附实验
准确称取一定量的CHAP,分别加入100 mL含Mn2+的模拟废水,调节溶液p H值(用 0.1mol/LHCl、0.1mol/LNaOH溶液),在室温条件下按照225 r/min搅拌一定时间,最后静置沉降1 h,取上清液通过0.45μm微孔滤膜。用原子吸收分光光度计分析残余Mn2+的浓度,并计算吸附量(q)。
2 结果与讨论
2.1 pH值对CHAP吸附作用的影响
在常温常压下,分别取pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0,M n2+的质量浓度为 50 mg/L 的溶液各100 m L,置于7个250 m L烧杯里,分别加入0.2 g CHAP吸附剂,225 r/m in搅拌2 h,静置1 h,试验结果如图1所示。当pH小于6.0时,吸附量随pH值增加而增加,并在pH值为6.0时达到最大值22.44 mg/g。当p H继续从6.0增加到8.0时,吸附量又降低到12.4 mg/g。
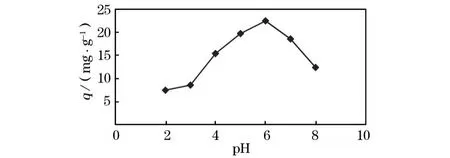
图1 废水初始pH值对吸附的影响
pH值对CHAP吸附作用影响主要是pH值影响CHAP表面的荷电性,影响CHAP表面荷电性的主要反应如反应式(1)、(2)[10]:
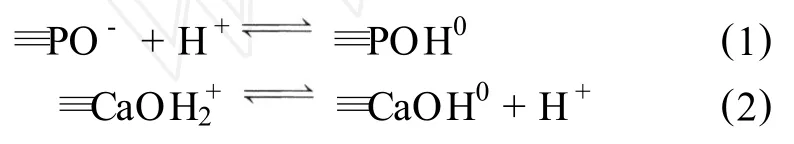
当溶液中初始pH较低时,大量的 H+与M n2+争夺 CHAP上的吸附位点,使得基团≡PO-和≡CaOH0质子化,从而pH较低时 M n2+的吸附量较低;随着p H增加 CHAP的吸附位点增加,从而CHAP吸附M n2+的能力增加,并在pH为6.0时达到最大值。
2.2 CHAP吸附M n2+的动力学
在常温常压下,取9份M n2+为50 mg/L的溶液各100 mL分别置于9个250 mL烧杯中,均加入0.2 g CHAP吸附剂,调节p H值都为6.0,225 r/m in搅拌 5,10,20,30,60,90,120,150,180 min,静置1 h,试验结果如图2所示。
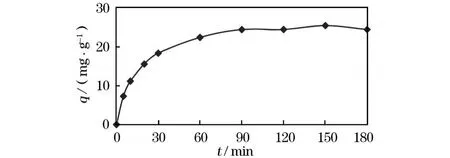
图2 搅拌时间对吸附的影响
从图2可以看出,吸附可以分为两个时期:初始快速吸附和后期慢速吸附。初始快速吸附期(吸附的前20 min),吸附量大,占到整个吸附平衡的70%左右。在接触时间达到 60 min时,吸附量达到25.48 mg/g,反应超过60 min,再延长搅拌时间,去除率都基本不变。由此可知,用CHAP吸附M n2+作用时间为60 m in比较合适,吸附反应基本能达到平衡状态。
在本研究中运用准一级和准二级动力学方程研究CHAP吸附M n2+的动力学。
准一级反应动力学方程表达式如下[11]:

式中qt——t时的吸附量(mg/g);
qe——平衡吸附量(mg/g);
K1——准一级吸附反应速率常数(1/min)。
准二级反应动力学方程表达式如下[11-12]:

式中 qe——平衡吸附量(mg/g);
K2——准2二级吸附反应速率常数〔g/(mg·min)〕。
分别以log(qe-qt)对t,t/qt对 t和qt对 t1/2作图,对数据进行回归分析,得到相关系数见表1。从准一级动力学模型估算的qe为25.73 mg/g,相关系数(R2)只有0.678 6,而准二级动力学模型估算的理论值为27.1 mg/g,相关系数达到0.998,所以准二级动力学模型比准一级动力学模型更适合描述CHAP吸附M n2+过程。这表明CHAP对M n2+的吸附是以化学吸附为控制步骤的反应过程[10]。
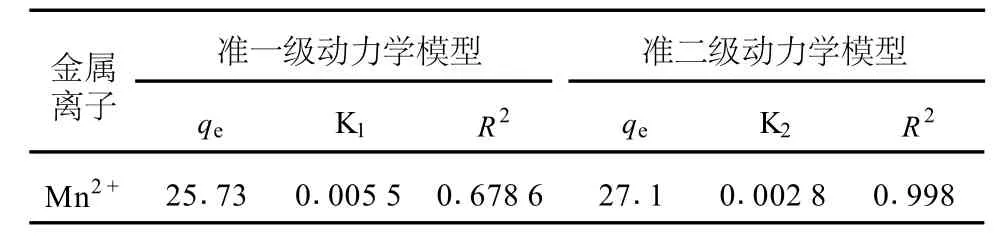
表1 准一级和准二级反应模型的动力学参数
2.3 CHAP吸附M n2+的吸附等温线
在常温常压下,取浓度为10,20,30,50,70,100,150 mg/L的 M n2+溶液各100 mL置于7个250 m L烧杯中,分别加入0.2 g CHAP吸附剂,225 r下搅拌 1 h,静置 1 h,实验结果如图 3所示。随着M n2+浓度的增加,CHAP吸附M n2+的能力也随之增加。主要是因为,初始浓度增加使 M n2+与CHAP接触机会增加,在CHAP吸附未达到饱和时能够继续吸附多余的M n2+,当M n2+浓度增大到100 mg/L时,CHAP吸附达到饱和(此时最大的吸附量达24.29 mg/g),继续增大M n2+浓度吸附量没有变化。
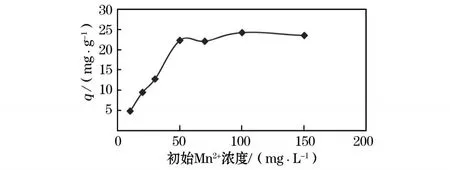
图3 初始M n2+浓度对吸附的影响
用Langmuir(见方程式5)和Freundlich(见方程式6)等温吸附模型对图3中的数据进行拟合,研究CHAP对M n2+的吸附行为,结果列于表2。

式中qe——平衡吸附量(mg/g);
qmax——饱和吸附量(mg/g);
Ce——吸附平衡浓度(mg/L);
b——Langmuir吸附系数;
Kf——Freundlich吸附系数,n为常数。

表2 Langmuir和Freundlich模型吸附常数和相关系数
从表2可以看出,用Langmuir模型得到的相关系数值(R2=0.998 6)比Freundlich模型得到的相关系数值(R2=0.805 4)大,CHAP对M n2+的吸附能较好地符合Langmuir吸附等温式。
3 结论
1)通过批式实验证明,常温常压条件下,CHAP吸附 M n2+的最佳pH值为 6.0,此时的吸附量22.44 mg/g。
2)在常温常压、pH值为6.0的条件下,CHAP吸附M n2+的最佳接触时间为60 min。准一级动力学方程、准二级动力学方程的数学模型检验了吸附过程的动力学性质,表明CHAP对M n2+的吸附过程符合准二级反应动力学模型。表明 CHAP对M n2+的吸附是以化学吸附为控制步骤的反应过程。
3)CHAP吸附M n2+的能力随着废水中M n2+浓度增加而增加,当M n2+浓度为50 mg/L时,吸附量达最大值24.29 mg/g。CHAP对M n2+的吸附符合Langmuir吸附等温式。
[1]姚俊,周方钦,麻明友,等.电解锰生产过程中的环境污染问题及对策的研究[J].吉首大学学报(自然科学版),1997,18(4):60-62.
[2]周柳霞.中国电解金属锰工业50多年发展回顾与展望[J].中国锰业,2010,28(1):1-6.
[3]曾赳雄.打造绿色锰业的新途径[J].中国锰业,2005,23(1):41-43.
[4]B Volesky.Detoxification of metal bearing effluents:biosorption for next century[J].Hydrometallurgy,2001,59(2/3):203-216.
[5]郑伟,李小明,曾光明,等.碳羟磷灰石(CHAP)对废水中Cd2+的吸附研究[J].环境科学学报,2006,26(11):1851-1854.
[6]M Elena,M R Alexandre,M C Andea,et al.studieson the mechanisms of lead immobilization by hydroxyapatite[J].Environmental Science&Technology,2002,36(7):1625-1629.
[7]C C Nillce,D A Rocha,C Reinaldo,et al.Cadmium up take by hydroxyapatite synthesized in different conditions and submitted to thermal treatment[J].Environ Sci Techonl,2002,36(7):1630-1635.
[8]刘羽,胥焕岩.磷块岩对二价镉离子的吸附性能研究[J].矿物学报,2001,21(3):496-508.
[9]唐文清,曾荣英,冯泳兰,等.合成碳羟基磷灰石对废水中锰离子的吸附研究[J].中国给水排水,2009,25(15):92-95.
[10]I Smiciklas,S Dimovic,I Plecas,et al.Removal of CO2+from aqueous solutions by hydroxyapatite[J].Water research,2006,40(12):2267-2274.
[11]C Nathalie,G Richard,D Eric.Adsorption of Cu(II)and Pb(II)onto a grafted silica:isotherms and kinetic models[J].Water Research,2003,37(13):3079-3086.
[12]Y S Ho,G McKay.Pseudo-second order model for sorption processes[J].Process Biochemistry,1999,34(5):451-465.
