低品位软锰矿加压浸出过程中铝的行为分析
2012-12-31谢红艳王吉坤
路 辉,谢红艳,蒙 钧,王吉坤
(1.中铝国际工程有限责任公司贵阳分公司,贵州贵阳 550081;2.昆明理工大学冶金与能源工程学院,云南昆明 650093;3.云南冶金集团总公司,云南昆明 650031)
0 前言
锰是冶炼合金钢的重要合金元素之一,自然界中锰的主要矿物是软锰矿[1-2]。工业生产中通过对锰矿进行不同的处理,得到富含锰的硫酸锰溶液,再通过净化除杂、电解得到锰[3-4]。其中电解锰的电解液主要是由硫酸锰、硫酸铵、二氧化硒组成,并且电解过程对电解液的成分要求特别严格,所以软锰矿经氧压浸出后得到的浸出液需要进行深度除杂,否则电解过程无法顺利进行。那么为合理高效地除去浸出液中的杂质,深入研究各种杂质元素在氧压浸出过程中的行为就显得十分必要。其中铝是锰矿中广泛存在的杂质元素,当硅、铝含量较高的情况下,在氧压浸出的过程中将会生成大量的氢氧化铝与硅酸胶体,这些物质可能具有相互保护作用或能够生产新的胶体体系,如水铝英石[Al2Si2O5(OH)4]、似水铝英石(mAl2O3nSiO2pH2O)和矽铁(m RxOynFe2O3pSiO2zH2O)[5-7]。所以铝在其浸出过程中的化学行为对浸出液的净化除杂(除杂试剂的投入量、投入方式)、净化絮凝剂的选取、固液分离效果、过滤性能等都具有重要影响;另外从二次资源回收利用的角度考虑,其对浸出渣中铝的回收利用也有重要指导作用。综合考虑,深入研究铝元素在软锰矿氧压浸出过程中的化学行为就具有重要意义。
1 实验部分
1.1 实验原理
采用“加压还原酸浸法”,实验原料软锰矿中的锰主要是以四价锰的形式存在,其不能被硫酸直接浸出,所以用还原剂硫铁矿将Mn4+还原为Mn2+,Mn2+再与硫酸反应生成硫酸锰溶液[8]。目前对于该反应体系做了很多的探讨,认为该体系存在的化学反应较为复杂,主要的化学反应为[9]:

以空气(或富氧空气)作为补充氧化剂,其化学反应为[10]:

由于原矿中的铝元素大部分以氧化物(如:Al2O3)、复杂的硅酸盐 (如:Al2O3·SiO2,3MnO·Al2O3·3SiO2和 2MnO·2Al2O3·5SiO2)或锰尖晶石(Mn·Al2O3)形态存在,所以可能发生的化学反应为:


铝溶出过多,将在酸浸液中形成凝胶体导致硫酸锰的后续净化困难。因此在上述反应中应抑制反应(6)、(7)、(8)的发生,或者说抑制 H3AlO3的生成。由于A l的氢氧化物的溶度积为32.9,比相应的硫化物的溶度积大。因此选择将铝以氢氧化物沉淀除去。要控制好pH值,使铝水解生成沉淀又不使锰生成沉淀损失,pH值应选定在5~6之间。
为考察反应体系中的离子平衡问题与杂质元素铝的浸出条件,特绘制不同体系的电位-pH图,如图1~3所示。

图1 Al-M n-S-H2O体系电位-pH
从图1中可以看出,在氧电极电位线与氢电极电位线中间的水的热力学稳定区域内,有硫酸铝的生成,且在保证氧化还原电势较高的条件下,不论酸液pH大小,均有硫酸铝溶液的生成。在氢电极电位线以下,有锰的铝酸盐生成。由图2~3可知,在水的热力学稳定区域,存在四氧化三锰、二硫化锰、铝酸锰盐等物质形态,在氢电极电位线以下有硫化锰存在。
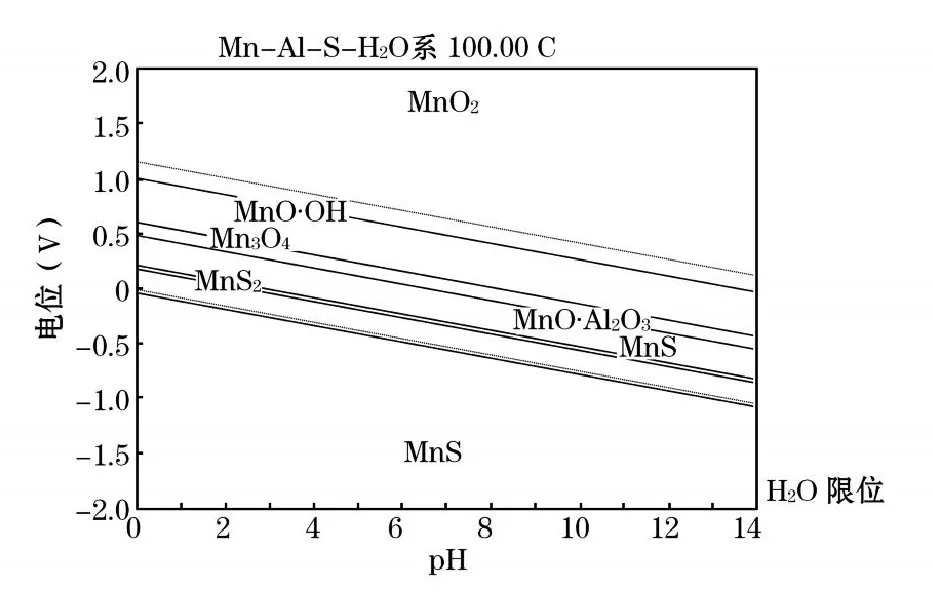
图2 Mn-Al-S-H2O体系电位-pH
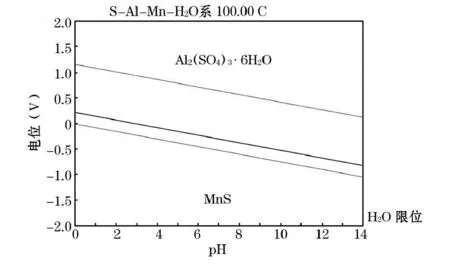
图3 S-Al-M n-H2O体系电位-pH
1.2 实验原料分析
实验原料主要为软锰矿与硫铁矿,其化学组成见表1。

表1 软锰矿与硫铁矿主要化学组成
由表1实验原料的化学成分分析可以看出,该软锰矿中氧化铝含量相对而言不高,为3.05%;但钙、硅含量明显偏高,氧化钙的含量高达24.46%。而硫铁矿中的铝含量也不是很高,为3.29%。这些杂质元素都会在加压浸出过程中不同程度地溶解,给锰的浸取与净化带来不同程度的困难。其中原料的微观形貌如图4所示。
从图4软锰矿的微观形貌可以看出,原矿物粒度分布不均,有较多大颗粒块状或团状矿物形态存在,且大部分固体颗粒外表面结构致密,呈现平整光滑的表观形貌,另外少部分大颗粒矿物外表面凸凹不平,有沟壑状和乳滴状条纹存在。通过对1、2、3、4颗粒进行微区能谱分析,可以看出,每个颗粒微区中都有铝的存在,从能谱分析结果中可以看出,铝元素在颗粒2、3、4微区中的含量相对较高,其中质量分数与原子分数都在3%以上。另外可以看出,各种元素在矿物中的结合形态较为复杂,有相当一部分矿物是结构较为复杂的复合盐。为考察原料软锰矿与硫化铁中的物相存在形态,特进行XRD衍射分析,分析结果如图5~6所示。
由图5可以看出,软锰矿中的钙主要以碳酸钙的形态存在,硅则主要以游离态的二氧化硅存在,因为铝的含量较低,在 XRD衍射图谱中没有明显显示。
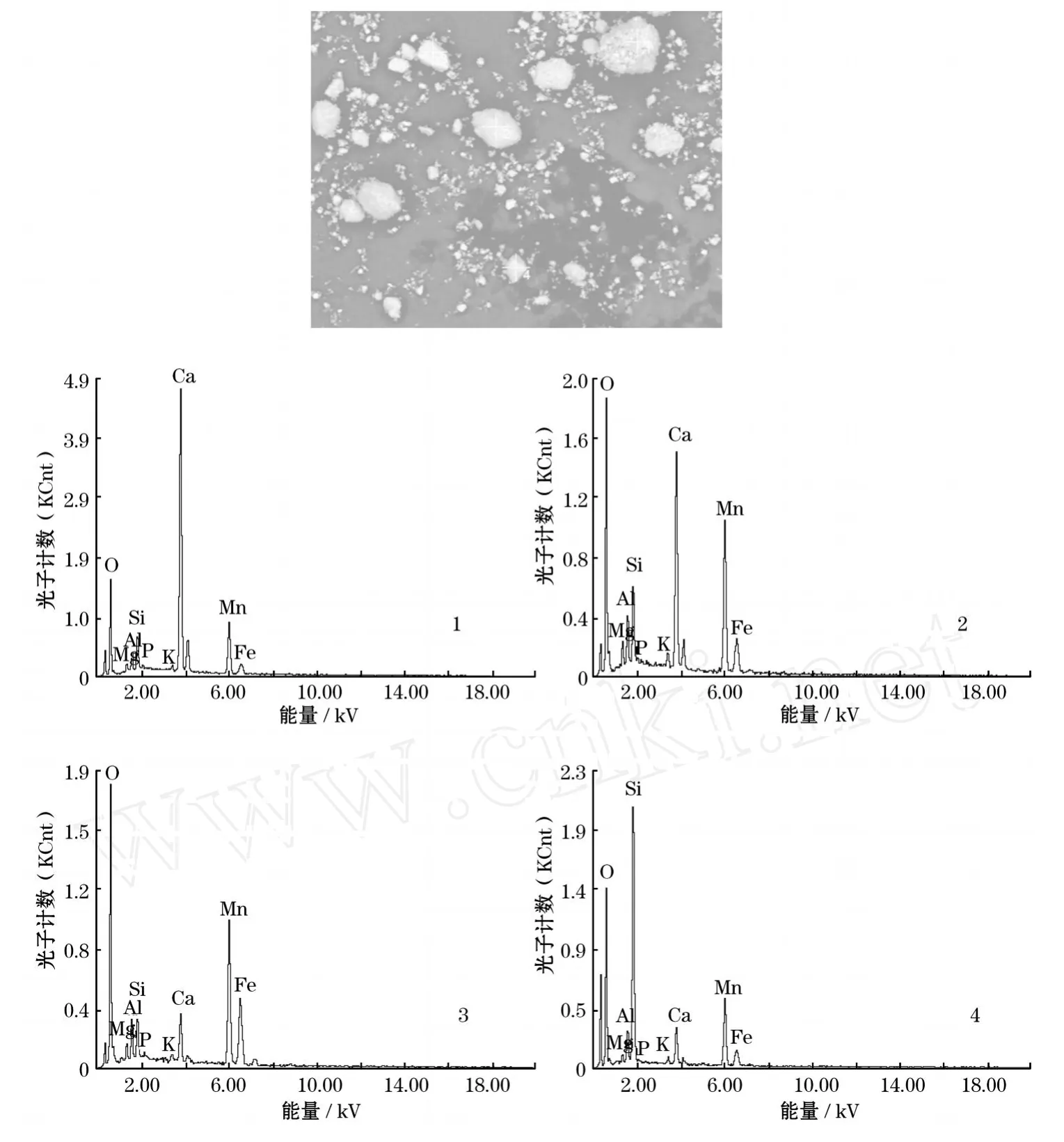
图4 软锰矿微区能谱分析
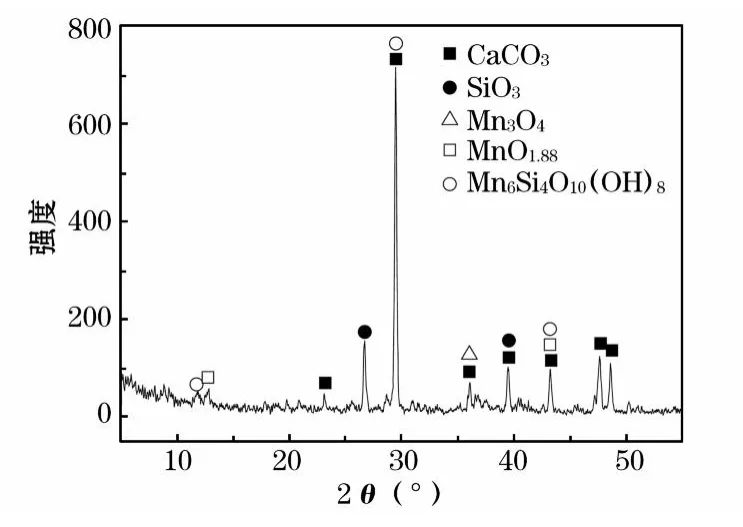
图5 软锰矿XRD衍射分析

图6 硫化铁XRD衍射分析
由硫化铁XRD衍射图谱(图6)可知,铝元素则主要以复合Al2Si4O10(OH)2形态存在,氧化物形态相对较少。
1.3 实验仪器与方法
实验过程采用的仪器装置图如图7所示。
称取一定量的软锰矿与硫铁矿,分别磨制,使其
粒度<0.075 mm(200目),然后将磨制后的两种矿分别放置在鼓风干燥箱中在90℃条件下干燥8 h,再按照两矿比为 1∶0.3~1∶0.6(软锰矿质量 :硫铁矿质量)称取干燥后的软锰矿和硫铁矿,将称好的矿放入高压釜,然后按一定的液固比与酸浓度加入一定量的硫酸溶液,将高压釜温度、压力设定在一定值,开启搅拌系统,反应一定时间后,将矿浆洗涤过滤,并分析滤渣与滤液的化学组成,以计算不同元素的浸出率,考察铝元素在加压浸出过程中的化学行为。

图7 实验仪器装置
2 试验结果与讨论
2.1 压力对实验结果的影响
在固定实验条件两矿比=1∶0.5、温度120℃、液固比=5∶1、浸出时间 =80 min、始酸浓度=120 g/L、搅拌转速=600 r/min下进行加压浸出实验,锰、铝的浸出结果如图8所示。

图8 铝、锰浸出率随压力变化关系
从图8可以得知,压力对锰的浸出率影响不大,在上述压力条件下,锰的浸出率维持在95%左右。而铝的浸出率随压力增大却呈下降趋势,随着压力的增大,铝的浸出率从50%以上下降到40%以下,很大程度上是体系中铝溶解的平衡体系遭到破坏,随着压力的增加,Al2(SO4)3溶液和 H3AlO3胶体将脱水而生成氧化物,从而进入渣中。可见压力对铝的浸出有较大影响.可以看出在实验中选取压力为0.9 M Pa时较为合适,一方面保证锰的较高浸出率,另一方面也最大程度减少铝杂质进入浸出液。
2.2 温度对实验结果的影响
在固定实验条件两矿比=1∶0.5、始酸=120 g/L、液固比 =5∶1、浸出时间 =80 min、压力 =0.5 M Pa、搅拌转速=600 r/min下进行试验,考察温度对铝浸出行为的研究,实验结果如图9所示。

图9 铝、锰浸出率随温度变化关系
由图9可知,在温度为120℃的情况下,出现了一个较为理想的实验结果,锰的浸出率高达99%,而铝的浸出率仅为14%左右。出现此现象的原因是,随着浸出温度升高至120℃以上,各种杂质元素(如铝等)也相应的被溶出,从而影响了锰的浸出率。可见反应温度为120℃是较为理想的单因素温度条件。
2.3 时间对实验结果的影响
固定实验条件两矿比=1∶0.5、始酸浓度=120 g/L、液固比 =5∶1、反应温度 120℃、压力 =0.5 M Pa、搅拌转速=600 r/min,考察时间对实验结果的影响,如图10所示。
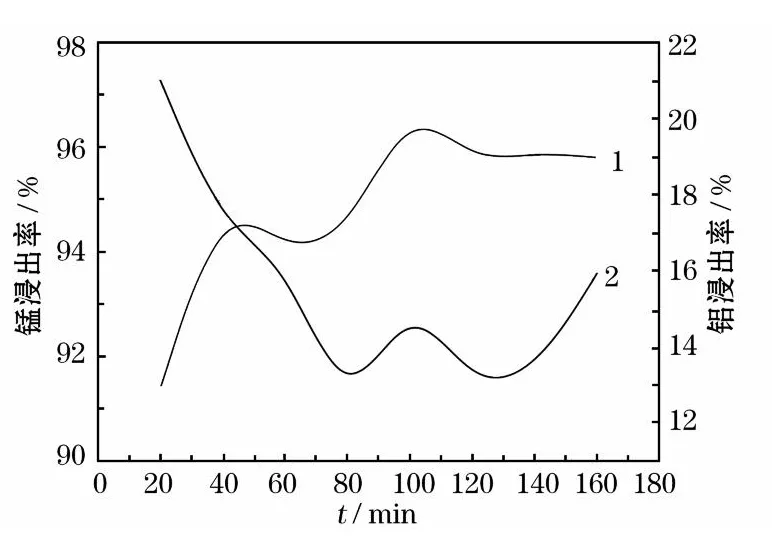
图10 铝、锰浸出率随反应时间的变化关系
如图10所示,随着反应时间的延长,锰的浸出率逐渐提高,但当时间超过100 min后,锰的浸出率变化不大,趋于稳定态势。而铝的浸出率在前80 min内随着时间延长,铝的浸出率急剧下降,但超过80 min后,铝的浸出率也趋于稳定,在14%左右轻微波动。所以反应时间在80~120 min区间内较为合适。
2.4 浸出渣微观形貌分析与XRD衍射图谱分析
固定实验条件两矿比=1∶0.5、温度120℃、液固比 =5∶1、浸出时间 =80 min、始酸浓度 =120 g/L、搅拌转速=600 r/min、压力=0.9 M Pa下进行实验得到的浸出渣分析鉴定,SEM图与XRD衍射图谱如图11~12所示。

图11 浸出渣的SEM
从图11的4幅图中可以看出,经过氧压浸出得到的浸出渣,表面支离破碎,出现较多空洞与疏松状沟痕,表明有较大一部分矿物溶入到酸性溶液中,但是也能看到部分难溶的团状或块状物料,由于这部分料块自身结构的复杂性,很难溶入到酸性溶液中。且很大一部分铝就嵌布在这种表面致密的复合盐中,所以铝的浸出率比较低,且对锰的溶出也有不同程度地影响。为分析浸出渣中各物相成分与残存铝的存在形态,特进行 XRD-衍射图谱分析,如图12所示。

图12 浸出渣的XRD-衍射
由图12可以看出浸出渣中主要存在CaSO4、FeS2、SiO2几种物相,并且浸出渣中含有大量的水合CaSO4与CaSO4,还有部分没有完全反应的硫铁矿存在,锰与铝的含量大大较少,表明锰绝大部分被溶出,而少量的铝也被溶出。
3 结论
1)通过对软锰矿加压浸出过程中铝的行为研究,可以看出温度、压力、时间对锰、铝的浸出率都有较大影响。
2)在保证锰的最大浸出率条件下,能寻求到铝被浸出的的最佳实验条件为:压力为0.9 M Pa、温度为120℃、时间为80~120 min是较为理想的单因素实验条件。
3)从浸出渣的结果分析来看,浸出渣中含有大量的水合CaSO4与CaSO4,还有部分没有完全反应的硫铁矿存在,锰与铝的含量大大较少,表明锰绝大部分被溶出,而少量的铝也不同程度地被溶出。
[1]张昭,刘立泉,彭少方.二氧化硫浸出软锰矿[J].化工冶金,2000,21(1):103-107.
[2]Miller J D,Wan R Y.Reaction Kinetics for the Leaching of MnO2by Sulfur Dioxide[J].Hydrometallurgy,1983,10(2):219-242.
[3]朱建平.电解锰生产过程中各因素对电耗的影响[J].中国锰业 ,1999,17(3) :33-35.
[4]陈南雄,廖赞伟.电解成分对电解金属锰生产过程的影响[J].中国锰业,2008,26(4):5-8.
[5]遵义化工厂.遵义地区高铁菱锰矿运用于电解二氧化锰生产试验报告[R].遵义:遵义化工厂,1997:2.
[6]滕英才,马集成.两矿加浓硫酸熟化法生产硫酸锰[J].化工技术与开发,2006,35(2):1-2.
[7]周元敏,梅光贵.由Ag-Mn矿浸锰液制取碳酸锰或硫酸锰的研究[J].中国锰业,2003,21(1):10-13.
[8]贺周初,彭爱国,郑贤福,等.两矿法浸出低品位软锰矿的工艺研究[J].中国锰业,2004,22(2):35-37.
[9]丁楷如,余逊贤,等.锰矿开发与加工技术[M].长沙:湖南科学技术出版社,1991.
[10]谢红艳,王吉坤,李天杰,等.含锰冶炼粉尘的加压硫酸浸出[J].过程工程学报,2011,11(4):86-91.
