大承气汤对MODS大鼠小肠肌层的保护作用
2012-12-31谢明征胡志祥齐清会
谢明征,胡志祥,齐清会
多器官功能障碍(multiple organ dysfunction syndrome,MODS)是一种病因繁多、发病机制复杂、病死率极高的临床综合征,亦是腹部外科患者死亡的重要原因。胃肠道是MODS的始动器官和靶部位,有效地促进胃肠动力的恢复可以阻断MODS的发生或进一步发展。大承气汤是中医通里攻下的代表方剂,在MODS的防治中已取得了确定且显著的疗效,但其机理尚不完全清楚。本实验以细菌性腹膜炎致MODS大鼠模型为研究对象,观察MODS大鼠模型和大承气汤(Da Cheng Qi Decoction,DCQD)治疗后小肠平滑肌环氧化酶-2(cyclooxygenase,COX-2)、核因子-κ B(nuclear factor-kappa B,NF-κ B)和热休克蛋白70(heat shock protein,HSP70)蛋白的表达,并探讨MODS致胃肠运动障碍和DCQD的防治机制。
1 材料和方法
1.1 材料
1.1.1 动物 健康成年清洁级Wistar大鼠100只,实验动物由大连医科大学动物实验中心提供。雌雄各半,体质量200~250g。随机分为对照组、MODS模型组和DCQD治疗组。
1.1.2 药物和试剂 中药大承气颗粒冲剂由天津南开医院药厂提供。成分为:大黄12g,芒硝6g,厚朴9g,枳实9g。每剂药物加入无菌蒸馏水36mL,溶解制成含生药100%的药业(1g/mL)。药物灌胃前加温至37℃。E.coli由大连医科大学附属第一医院检验科提供。小鼠抗大鼠NF-κB、小鼠抗大鼠HSP70、山羊抗大鼠COX-2抗体购自美国Santa Cruz公司。超敏即用型二步法(非生物素)检测试剂盒购自美国GBI公司,DAB显色试剂盒和中性树胶封片剂购自北京中杉金桥。
1.2 方法
1.2.1 MODS大鼠模型的制造和DCQD治疗 按照李毅等[1]方法,无菌条件下,对照组每只大鼠予腹腔注射1mL生理盐水;MODS组和DCQD组每只大鼠予腹腔注射1mL E.coli混悬液,建立细菌性腹膜炎致MODS模型。DCQD组于造模前2d给予大承气汤灌胃,2次/d,每次1mL/100g。
1.2.2 石蜡组织切片制备 取存活大鼠上端小肠,置于4℃的4%多聚甲醛中固定过夜。梯度酒精脱水、二甲苯透明、浸蜡、石蜡切片机连续切片,每片厚度为5μm,附于多聚赖氨酸包被的载玻片上,60℃过夜。
1.2.3 免疫组织化学染色 按超敏即用型二步法(非生物素)检测试剂盒说明书进行:组织切片常规脱蜡、水化,3%H2O2去离子水孵育10min,抗原修复液沸水浴15min,一抗4℃孵育过夜,滴加试剂1,37℃孵育20min,滴加试剂2,37℃孵育20min,DAB显色,苏木素复染,常规脱水、透明、封片。以PBS代替一抗做阴性对照,已知阳性切片做阳性对照。
1.2.4 积分光密度 采用美国Media Cybernetics公司的Image-Pro Plus 6.0(IPP 6.0)软件分析图像,计算小肠肌层阳性表达区域的积分光密度(integral optical density,IOD)。
1.3 数据处理 采用SPSS 13.0软件对数据进行统计学处理,计数资料采用卡方检验;计量数据用±s)表示,采用Studentt检验。P<0.05表示有显著差异。
2 结果
2.1 动物死亡率 建模24h后,对照组大鼠共20只,均存活;细菌性腹膜炎致MODS组大鼠共40只,死亡23只,死亡率为57.5%,与对照组相比,具有显著差异(P<0.05);DCQD治疗组共40只,死亡11只,死亡率27.5%,与MODS组相比,具有显著差异(P<0.05)。
2.2 大体标本 对照组:胃肠形态、蠕动正常,肠管呈粉红色,无粘连、肿胀。MODS组:胃肠明显扩张,浆膜充血肿胀,腹腔内大量渗出液,部分出现血性腹水,大部分肠管呈暗紫色,出现淤血斑,肠腔内见暗紫色血水样液体潴留,梗阻征象明显。DCQD治疗组:胃肠轻度充盈,肠管为红色,腹腔少量渗出液,无血性渗出,肠腔内少量淡黄色液体潴留,胃肠蠕动基本正常。
2.3 COX-2蛋白在大鼠小肠肌层中的表达 正常组大鼠小肠平滑肌细胞核轮廓清楚,分布均匀,COX-2蛋白散在分布。MODS组中小肠平滑肌细胞核分布不均,数量较正常组明显减少,环层肌中细胞核的长度较正常组缩短,纵层肌中细胞核的直径较正常组减小,COX-2蛋白的表达较正常组明显升高,且分布均匀。治疗组小肠平滑肌细胞核轮廓较MODS组清晰,数量和体积明显增大,COX-2蛋白的表达较MODS组明显减少,在环层肌中尤为明显,而在纵层肌中的表达呈不均匀性,部分区域较MODS组减少,而其他部分则升高(图1)。
2.4 NF-κB蛋白在大鼠小肠肌层中的表达 对照组大鼠小肠平滑肌层中未见或偶见NF-κB蛋白的表达。MODS组中NF-κB蛋白的表达较对照组明显升高,分布均一,胞质和胞核中均见表达。治疗组中大鼠小肠肌层中的NF-κB蛋白表达较MODS组明显减少,仅在部分细胞的胞核周围及胞核中有少量表达(图2)。
2.5 HSP70蛋白在大鼠小肠肌层中的表达 对照组大鼠小肠肌层偶见少量HSP70蛋白的表达。MODS组平滑肌胞浆中可见大量分布均匀的HSP70蛋白表达,较对照组明显升高,部分细胞核中亦见表达。治疗组中HSP70的表达较MODS组明显减少,其中环层肌减少尤为明显,仅在近黏膜面可见少量HSP70蛋白的聚集,偶见胞核中表达(图3)。
2.6 统计分析结果 3组大鼠小肠肌层COX-2、NF-κB和HSP70蛋白表达检测结果(表1)。

图1 免疫组化检测不同组别大鼠小肠肌层COX-2蛋白表达变化(×400)
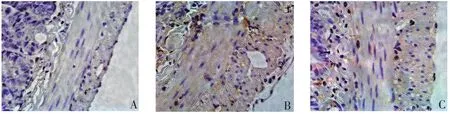
图2 免疫组化检测不同组别大鼠小肠肌层NF-κB蛋白表达变化(×400)

图3 免疫组化检测不同组别大鼠小肠肌层HSP70蛋白表达变化(×400)
表1 小肠肌层COX-2、NF-κB和HSP70蛋白表达的IOD值检测结果比较(±s)

表1 小肠肌层COX-2、NF-κB和HSP70蛋白表达的IOD值检测结果比较(±s)
注:与对照组比较,aP<0.05;与MODS组比较,bP<0.05
组别对照组MODS组DCQD组n 20 17 29 COX-2 6767.86±2165.56 23 759.51±5725.66a 12 825.01±2711.27b NF-κB 1336.34±251.88 2138.95±583.09a 1629.62±321.69b HSP70 849.72±152.46 1781.15±326.85a 1056.72±181.62b
3 讨论
MODS是腹部外科患者死亡的重要病因。目前认为,胃肠道是MODS的始发部位,而胃肠动力障碍则是促发MODS的始动因素。胃肠道是人体内最大的储菌库。当腹腔重度感染,炎症反应刺激胃肠平滑肌,使得消化道蠕动减弱,肠内容物驱动停止、菌群失调、发酵产气,肠内压力增大,黏膜血流减少和破损,肠内细菌及代谢产物透过黏膜屏障进入血液循环,最终诱发MODS。因此,促进胃肠动力的恢复,可以有效地防治MODS的发生发展。
NF-κB是一组转录因子蛋白,对参与炎症反应的基因具有调控作用[2]。NF-κB被认为在炎症反应中发挥中心调控作用,因此已成为抗炎治疗的新热点。生理状态下,NF-κB主要以P50/P65组成的二聚体形式存在于胞质中,并与抑制性蛋白IκB结合,呈无活性状态[3]。应激状态下,LPS、TNF-α、IL-1β等外源性刺激可以经p38MAPK信号通路的激活,诱导促炎因子COX-2的过量表达[4],而NF-κB是COX-2下游的重要靶标[5]。COX-2的过度表达通过激活NIK(NF-κB-inducing kinase),最终导致IκB的磷酸化、降解并脱离NF-κB。NF-κB移位至胞核,与靶基因的NF-κB结合位点相结合,启动基因转录[6]。其中含p65的二聚体具有显著的促炎活性,可以刺激巨噬细胞表达黏附分子,介导炎性细胞的移行及黏附[7]。同时,COX-2还是催化花生四烯酸生成前列腺素E2的限速酶,而后者是重要的炎性介质,可以产生氧自由基和活性氧,诱发炎症级联反应和组织损伤。本研究显示,在MODS状态下,大鼠小肠肌层中的COX-2和NF-κB蛋白表达均较对照组明显升高,而大承气汤则显示出明显的抑制作用。提示大承气汤促进MODS胃肠动力的恢复,可能与其抑制COX-2/NF-κB促炎信号的表达有着密切关系。
HSP是机体在损伤因素作用下所产生的一组高度保守的应激性蛋白质,通过分子伴侣机制发挥细胞保护作用。其中HSP70是含量最多的一种,具有抑制细胞凋亡,减轻炎症损伤的作用。研究发现,HSP70可以通过抑制JNK/Bim通路而抑制紫外线诱导的细胞凋亡[8]。另外,HSP70可以通过稳定Bcl-2蛋白,从而对抗线粒体氧化应激介导的细胞凋亡[9]。HSP70还可以通过激活蛋白激酶C,促进ATP水解和具有清除氧自由基的超氧化物歧化酶的生成,产生抗氧化作用,从而保护细胞。内毒素血症时,HSP70可以抑制NF-κB的活性[10],及iNOS的表达,阻碍炎症反应的进一步发展。有研究发现,缺血再灌注损伤可以诱导HSP70的表达[11]。提示在应激状态下,细胞通过上调HSP-70的表达,抑制应激激酶的激活和细胞炎症反应及凋亡的加剧,从而发挥自身保护性。研究已证实,HSP在保护肠黏膜上皮中具有重要作用[12]。本研究提示,HSP70在小肠肌层中也发挥应激保护作用。MODS状态下,小肠肌层中的HSP70表达明显上调,且部分平滑肌细胞核中也可见表达,提示应激损伤诱导小肠平滑肌大量表达HSP70,在胞浆和胞核中同时发挥保护作用,减轻平滑肌细胞的进一步损伤。而大承气汤可使MODS大鼠小肠平滑肌HSP70表达明显减少,提示大承气汤可以明显减轻小肠平滑肌的应激损伤,促进胃肠动力的恢复。
本研究亦发现,大承气汤对MODS小肠环层肌COX-2蛋白表达的抑制作用强于纵层肌。这可能与COX-2上游激活因子及其受体在纵层肌和环层肌分布的差异性有关,但具体机制目前尚不清楚。另外,COX-2、NF-κB在细胞凋亡通路中亦发挥作用[13],MODS状态下小肠平滑肌是否也发生了凋亡现象,而大承气汤又有无影响作用,还需要进一步的研究。
[1]李毅,齐清会,张栋梁,等.大承气汤对MODS大鼠小肠深部肌间Cajal间质细胞损伤的作用[J].中国中西医结合外科杂志,2008,14(3):230-234.
[2]Schottelius AJ,Baldwin AS Jr.A role for transcription facter NF-kappa B in intestinal inflammation[J].Int J Colorectal Dis,1999,14(1):18-28.
[3]Huxford T,Malek S,Ghosh G.Structure and mechanism in NF-kappa B/I kappa B signaling[J].Cold Spring Harb Symp Quant Biol,1999,64:533-540.
[4]Fagotti A,Ferrandina G,Fanfani F,et al.Analysis of cyclooxygen⁃ase-2(COX-2)expression in different sites of endometriosis and correlation with clinico-pathological parameters[J].Hum Reprod,2004,19(2):393-397.
[5]Wajant H,Scheurich P.Analogies between Drosophila and mamma⁃lian TRAF pathways[J].Prog Mol Subcell Biol,2004,34:47-72.
[6]Kishimoto Y,Yashima K,Morisawa T,et al.Effects of cyclooxygen⁃ase inhibitor NS-398 on apc andcmyc expression on rat colon car⁃cinogenesis induced by a zoxymethane[J].J Gastroenterol,2002,37(3):186-193.
[7]Kelleher ZT,Potts EN,Brahmajothi MV,et al.NOS2 regulation of LPS-induced airway inflammation via S-nitrosylation of NF-{kap⁃pa}B p65[J].Am J Physiol Lung Cell Mol Physiol,2011,301(3):L327-333.
[8]Li H,Liu L,Xing D,et al.Inhibition of the JNK/Bim pathway by Hsp70 prevents Bax activation in UV-induced apoptosis[J].FEBS Lett,2010,584(22):4672-4678.
[9]Jiang B,Liang P,Deng G,et al.Increased stability of Bcl-2 in HSP70-mediated protection against apoptosis induced by oxidative stress[J].Cell Stress Chaperones,2011,16(2):143-152.
[10]Ran R,Lu A,Zhang L,et al.Hsp70 promotes TNF-mediated apop⁃tosis by binding IKKγ and impairing NF-κB survival signaling[J].Genes Dev,2004,18(12):1466-1481.
[11]Kuboki S,Schuster R,Blanchard J,et al.Role of heat shock pro⁃tein 70 in hepatic ischemia-reperfusion injury in mice[J].Am J Physiol Gastrointest Liver Physiol,2007,292(4):G1141-1149.
[12]Ohkawara T,Nishihira J,Takeda H,et al.Protective effect of gera⁃nylgeranylacetone on trlnitrobenzene sulfonic acid-induced colitis in mice[J].Int J Mol Med,2006,17(2):229-234.
[13]Luo W,Li J,Zhang D,et al.Bid Mediates Anti-Apoptotic COX-2 Induction Through the IKKβ/NF κB Pathway Due to 5-MCDE Ex⁃posure[J].Curr Cancer Drug Targets,2010,10(1):96-106.
