不同处理对樟树林土壤微生物数量的影响
2012-12-28张明明闫文德梁小翠多祎帆王志勇
张明明,闫文德,2,梁小翠,2,多祎帆,王志勇,刘 亮
不同处理对樟树林土壤微生物数量的影响
张明明1,闫文德1,2,梁小翠1,2,多祎帆1,王志勇1,刘 亮1
(1.中南林业科技大学,湖南 长沙 410004;2.南方林业生态应用技术国家工程实验室,湖南 长沙 410004)
研究了亚热带樟树林土壤微生物特征及改变碳输入方式(对照、添加凋落物、去除凋落物、去根添加凋落物、去根去除掉落物、去根)对其数量变化的影响。以稀释平板计数法对土壤中主要微生物类群数量变化进行分析。结果表明:不同处理下微生物总数量分别为去根去除凋落物(67.47×103CFU/g)<去除凋落物(120.36×103CFU/g)<去根(163.67×103 CFU/g)<对照(175.27×103CFU/g)<去根添加凋落物(182.91×103CFU/g)<添加凋落物(205.60×103CFU/g);不同处理方式下细菌、真菌、放线菌及其总微生物数量均呈现出添加凋落物会增加土壤微生物数量,去除凋落物会减少微生物数量,根系效应显著。
樟树;凋落物;根;微生物数量
稳定的森林生态系统是涵养水源、保持水土、人类生存环境及经济可持续发展的重要基础,而土壤微生物是生态系统分解环节中重要成员之一。它们分解土壤中的有机物,使其转化为无机成分,从而改善土壤肥力,净化土壤环境,为保持生态系统的健康、稳定提供了良好的基础条件。土壤微生物是土壤有机质和养分转化、循环的动力,微生物在土壤中的数量、分布与活动情况反映了土壤肥力的大小,对林木生长发育起着重要的作用。森林生态系统中,植物光合产物中大部分以凋落物形式积于植被下方,凋落物层在土壤生态系统中独特的作用,对生态系统的环境、土壤和植被都有一定的塑造作用[1]。凋落物的多少、种类直接影响微生物的种类、数量,去除和添加凋落物能够影响土壤微生物群落。凋落物的去除或添加,改变了凋落物层的数量、分解速率和有机物含量以及向土壤中的淋溶输入。有研究表明,加倍凋落物可以增加凋落物层的真菌和细菌的总生物量,去除凋落物可以减少真菌总生物量[2]。
另外,在植物生长过程中,根系从土壤中摄取水分和养分的同时也向周围环境释放无机盐离子和碳水化合物、有机酸、生长素等低分子的有机物及脱落物等残体物质[3-6]。这些物质不仅为根际微生物提供了丰富的碳源和能源,而且极大地改变了根际微区的物理和化学环境,其中微生物的数量、活性和生态分布与根外土壤相比,发生显著改变,一般情况下植物生长越旺盛,根分泌物也就越多,根际中三大类微生物的数量比相应的根外多,根际效应很明显[7]。但不是所有微生物与根际环境都呈明显的正效应,有些却正负皆有[8]。
樟树Cinnamomum camphora是亚热带最常见的森林群落,具有代表性。本研究在湖南省植物园樟树林内,采用6种不同处理方式进行微生物数量的统计、比较,旨在揭示凋落物和根系对樟树林土壤微生物数量的影响,进而为研究人工林土壤肥力变化提供科学根据,从而为维护森林生态系统的健康、保持土地资源的可持续利用提供科学依据,以及对樟树人工林持续经营的研究和生产实践都有一定的意义。
1 实验地概况
试验地位于湖南省森林植物园(113°02′~113°03′E,28°06′~ 28°07′N)。当地属典型的亚热带湿润季风气候,极端最低温度-11.3℃,极端最高气温40.6 ℃;全年无霜期270~300 d,年均日照时数1 677.1 h;雨量充沛,年均降水量1 422 mm。地层主要是第四纪更新世的冲积性网纹红土和砂砾,属典型红壤丘陵区,土壤呈酸性。研究样地海拔50~100 m,坡度为12°~21°,核心区面积约4 356 hm2。樟树为31年生的人工林,群落基本情况见表1。林下植被有喜树Camptotheca acuminate、青桐Firmianasimplex、油茶Camellia oleifera、紫金牛Ardisia japonica、毛叶木姜子Litsea mollis、盐肤木Rhus chinensis、山苍子Litsea cubeba、满树星Ilex aculcolata、杜荆Vitex agnus-castus、 大 青 Clerodendron cyrtophyllum、黄檀Dalbergia balansae、枸骨Ilex cornuta、乌桕Sapium sebiferum、 野 柿 Diospyros lotus、 华山 矾 Symplocos chinensis、 白 栎 Quercus fabri、栀子Gardenia jasminoides、小叶女贞Ligustrum quihoui、 淡 竹 叶 Lophatherum gracile、 芒 萁Dicranopteris ampla、鸡矢藤 Paederia scandens、鳞毛蕨Dryopteris chinensis、狗脊蕨Woodwardia prolifera、铁线蕨Adiantum capillus-veneris、井栏边草Pteris multifida、山麦冬Radix liriopes、苔草Carex tristachya、蛇葡萄Ampelopsis sinica等。

表1 樟树群落的基本情况Table 1 Basic situation of C.camphora communities
2 研究方法
2.1 试验设计
2010年7月初,在森林植物园内选取樟树林群落,分别设置对照(CR)、添加凋落物(LAR)、去除凋落物(LRR)、去根添加凋落物(LANR)、去根去除掉落物(LRNR)、去根(CNR)6种处理,每种处理设置3个小区,共18个小区,每个小区大小为3 m×4 m,小区间距1~5 m。去除凋落物处理是取12 m2的样方,清除样方内的凋落物,并在上方设置3 m×4 m的网用来收集凋落物,为了防止凋落物进入该处理的范围内,网距离地面的高度设为0.5 m。添加凋落物的处理是收集去除凋落物处理的网中的枯落物均匀撒在12 m2的范围内,以后每月将周围凋落物收集网收集的凋落物等面积均匀撒在添加处理的范围内。无根处理是在12 m2的样方挖取0.5 m深的土壤,然后铺上一层塑料膜,将挖出的土壤中的植物根拣出后再次填入土坑,掩埋塑料膜。有根处理即为对照,不做处理。
2.2 取样方法
2011年7月在各小区内分别采集0~15 cm土壤,装入封口袋,迅速带回实验室,贮存于4℃的冰箱中。
2.3 微生物数量测定方法
微生物数量采用稀释涂布平板法计数,细菌培养采用牛肉膏蛋白胨培养基;放线菌培养采用高氏1号培养基;真菌培养采用马丁氏孟加拉红培养基[9-11]。
2.3.1 细菌数的测定
称取10 g土样,放入装有90 mL无菌水的灭菌三角瓶中,放到震荡器上震荡30 min后静止2~3 min,然后用无菌吸管吸取1 mL,按每级稀释10倍的顺序制备一系列土壤稀释液。以稀释梯度为10-4、10-5、10-6土壤稀释液接种培养基,每一处理3个重复,接种后的平板倒置于25~28℃培养箱中培养1~2 d。然后用平板计数法计数。
2.3.2 真菌数的测定
称取10 g土样,放入装有90 mL无菌水的灭菌三角瓶中,放到震荡器上震荡30 min后静止2~3 min,然后用无菌吸管吸取1 mL,按每级稀释10倍的顺序制备一系列土壤稀释液。以稀释梯度为10-2、10-3、10-4土壤稀释液接种培养基,每一处理3个重复,接种后的平板倒置于28~30℃培养箱中培养2~3 d。然后用平板计数法计数。
2.3.3 放线菌的测定
称取10 g土样,放入装有90 mL无菌水的灭菌三角瓶中,放到震荡器上震荡巧静止2~3 min,然后用无菌吸管吸取1 mL,按每级稀释10倍的顺序制备一系列土壤稀释液。以稀释梯度为10-2、10-3、10-4土壤稀释液接种培养基,每一处理3个重复,接种后的平板倒置于25~28℃培养箱中培养4~5 d。然后用平板计数法计数。
2.4 数据处理及分析方法
原始数据的整理用 Excel2003 软件完成,方差分析、相关性分析用 SPSS软件完成。
3 结果与分析
3.1 未作处理土壤微生物的数量
从图1可看出,不作任何处理时,土壤中不同类型微生物的数量为:细菌(135.33×103CFU/g)>放线菌(20.64×103CFU/g)>真菌(19.29×103CFU/g)。这与鼎湖山南亚热带季雨林土壤中以细菌为多的研究结果相符[12]。本样地中真菌数量小于放线菌,但差异不大。可能是由于土壤为酸性,而真菌喜适酸性环境,不易受环境干扰。同时,放线菌对环境有较高要求,由于竞争使放线菌所需营养不足,致使生长繁殖受到真菌抑制而减少,故使真菌比例显著增大[13]。

图1 未作处理时土壤中微生物的数量Fig.1 Quantitative in microorganism population under CR
3.2 不同处理方式下微生物的数量
3.2.1 不同处理方式下细菌的数量
土壤细菌占土壤微生物总数的70%~90%,个体小,繁殖快,代谢强,主要作用是分解有机质、合成腐殖质和氧化无机质。
从图2可看出,细菌在数量呈现为:去根去除凋落物(46.44×103CFU/g)<去除凋落物(99.56×103CFU/g)<对照(135.33×103CFU/g)<去根(136.67×103CFU/g)<去根添加凋落物(153.78×103CFU/g)<添加凋落物(161.56×103CFU/g)。有机质的多少直接影响细菌的数量,由于凋落物的处理改变了土壤中有机质的来源,所以添加凋落物后细菌数量增多,去除凋落物后细菌明显减少;同时,去根处理后细菌数量明显减少,这主要是因为去除根系极大地改变了根际微区的物理和化学环境,根系的去除使细菌无法得到生长所需的营养物质,从而使细菌数量显著减少。和对照比较,去根后细菌菌落数明显减少,说明细菌数量的增减并不是由单一原因所决定的,细菌微生物数量可能同时受到凋落物、根系效应等多种因素的影响。
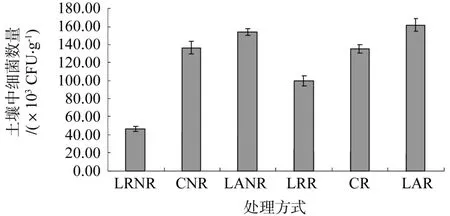
图2 不同处理方式下的细菌数量Fig.2 Bacteria number under different treatments
3.2.2 不同处理方式下的真菌数量
土壤真菌数量少,但生物量大,在森林土壤中真菌是分解土壤有机质的主要微生物类群,在土壤物质转化过程中占有重要地位。土壤真菌的多少与土壤有机质含量密切相关[14]。
从图3可看出,不同处理方式下,真菌的数量为:去除凋落物(10.49×103CFU/g)<去根去除凋落物(12.24×103CFU/g)<去根(16.20×103CFU/g)<去根添加凋落物(16.44×103CFU/g)<对照(19.29×103CFU/g)<添加凋落物(22.00×103CFU/g),添加凋落物增加真菌数量,减少凋落物时真菌数量减少,真菌数量直接受凋落物多少影响,这与不同处理下细菌的数量趋势一致;添加凋落物大于去根添加凋落物,这说明在对凋落物不做处理和对凋落物做加倍处理的同时去根可明显减少真菌数量,真菌数量明显受根系有无的影响。然而,去除凋落物小于去根去除凋落物,在去除调落物后根系对真菌数量呈负效应。

图3 不同处理方式下的真菌数量Fig.3 Fungi number under different treatments
3.2.3 不同处理方式下的放线菌数量
放线菌极易受土壤中其他微生物的影响,对环境适应性强,在偏碱性的土壤中生长较好。数量受土壤有机质含量的影响。在有机质和腐殖质丰富的土壤中,放线菌的数量一般大于有机质贫乏的土壤。土壤中细菌和真菌增殖后,放线菌才能明显增殖,在有机物被分解利用的后期,残留物主要为难分解的木质素和腐殖质时,放线菌能缓慢而稳定的发展。放线菌不仅在物质转化方面起着很大的作用,而且放线菌是土壤中的重要的抗生素产生菌[15]。
从图4可看出,放线菌在数量上呈去根去除凋落物(8.78×103CFU/g)<去除凋落物(10.31×103CFU/g)<去根(10.80×103CFU/g)<去根添加凋落物(12.69×103CFU/g)<对照(20.64×103CFU/g)<添加凋落物(22.04×103CFU/g),添加凋落物增加放线菌数量,减少凋落物时放线菌数量减少,放线菌数量受凋落物多少的影响而增减;添加凋落物后,放线菌数量明显大于去根添加凋落物和去根去除凋落物2种处理方式,说明在减少凋落物、对凋落物不做处理和对凋落物做加倍处理时去根可明显减少放线菌数量,去根后放线菌数量减少,根系对放线菌数量为明显的正效应。
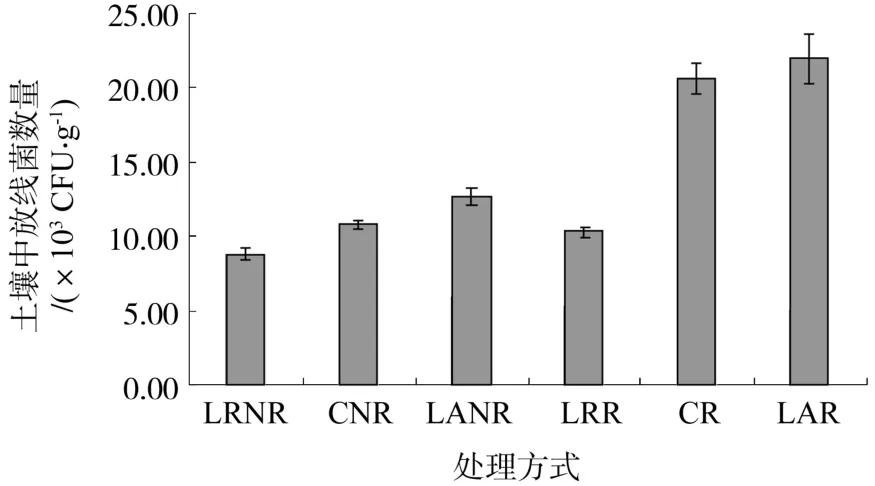
图4 不同处理方式下的放线菌数量Fig.4 Actinomycetes number under different treatments
3.2.4 不同处理方式下微生物总数量
从图5可看出,不同处理对土壤中微生物总数量的影响,在数量上呈去根去除凋落物(67.47×103CFU/g)<去除凋落物(120.36×103CFU/g)<去根(163.67×103CFU/g)< 对照(175.27×103CFU/g) <去根添加凋落物(182.91×103CFU/g) <添加凋落物(205.60×103CFU/g),差异显著(P<0.05)。这说明在樟树林中,凋落物增多能提高微生物总数量,凋落物减少能减少微生物总数量,有机质含量的增减直接影响微生物数量的多少,凋落叶有利于土壤异养微生物的生长、繁殖,使其数量明显增多[12]。由于根系可从土壤中摄取水分和养分的同时也向周围环境释放无机盐离子和碳水化合物、有机酸、生长素等低分子的有机物及脱落物等残体物质,为土壤微生物的生长提高营养物质,从而在去除根系后,微生物数量会明显减少。
4 结 论
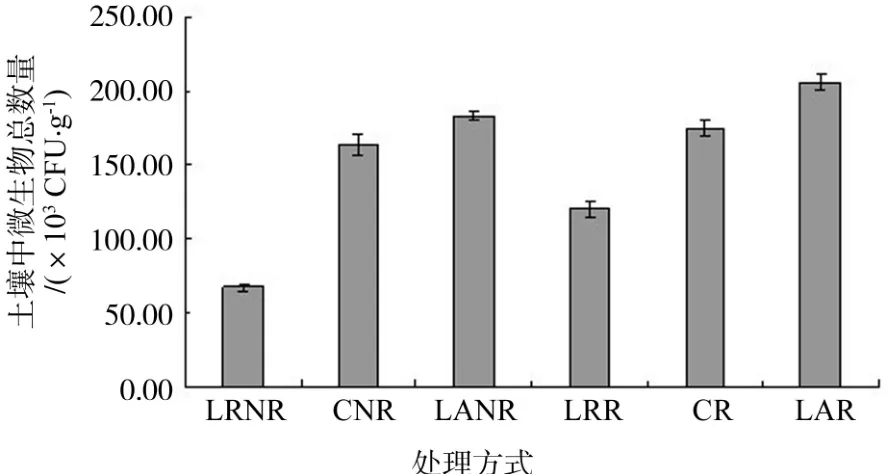
图5 不同处理下微生物总数量与对照的比较Fig.5 Microorganism population under different treatments
在樟树林中对照土壤中微生物在数量上是细菌(135.33×103CFU/g)>放 线 菌(20.64×103CFU/g)>真菌(19.29×103CFU/g),通过对比不同处理下微生物数量,添加凋落物能够增加细菌、真菌、放线菌及其总微生物数量,而去除凋落物能够减少各菌及总微生物数量;不同微生物种群对去除根系有不同的反应,但总体趋势还是表现为去除根系减少其数量。这表明增加有机质可增加樟树林中微生物数量,根系对总的微生物数量有明显的正效应。根系和凋落物对土壤微生物数量的同时作用比凋落物、根系的单独作用影响更显著。
[1] 刘尚华,吕世海,冯朝阳,等.京西百花山区六种植物群落凋落物及土壤呼吸特性研究[J].中国草地学报,2008,30(1):78-86.
[2] Knute J Nadelhoffer, Richard D Boone, Richard D Bowden, et al.The DIRT experiment: Litter and root influences on forest soil organic matter stocks and function[C]//FOSTER D R,ABER J D.Forests in Time: The Environmental Consequences of 1000 Years of Change in New England.New Haven, CT: Yale University Press, 2004:300-315.
[3] Yang Yusheng, He Zongming, Zou Shuangquan, et al.A study on the soil microbes and biochemistry of rhizospheric and tota soil in natural forest and plantation of Castanopsis kauakamii[J].Acta Ecologica Sinica,1998,18(2):198-202.
[4] Smith J L,PaulE A.The Significance of soilmicrobial biomass estimunderion[C]//Bollag J M, Stotzky G.Soil Biochemistry.New York: MarcelDerkker Inc.,1991:359-396.
[5] 李振高,潘映华,李良漠.不同基因型小麦根际细菌及酶活性的动态研究[J].土壤学报,1993,30(l):1-8.
[6] 张福锁,曹一平.根际动态过程与植物营养[J].土壤学报,1992,29(3):239-250.
[7] 熊明彪,何建平,宋光煜.根分泌物对根际微生物生态分布的影响[J].土壤通报,2002, 33(2):145-147.
[8] 章家恩.刘文高.王伟胜.南亚热带不同植被根际微生物敦量与根际土壤养分状况[J].土壤与环境,2002,11(3):279-282.
[9] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[10] 胡 俊.微生物学实验技术[M].呼和浩特:内蒙古文化出版社,2000.
[11] 陈声明,张立钦.微生物学研究技术[M].北京:科学出版社,2006.
[12] 王锐萍,刘 强,彭少麟,等.鼎湖山森林凋落物和土壤微生物数量动态[J].武夷科学,2006, 22: 82-87.
[13] 庄铁诚,林 峭.九龙江口秋茄红树林凋落叶自然分解与落叶腐解微生物的关系[J].植物生态学与地植物学报,1992,16(1):17-25.
[14] 巨天珍,陈 源,常成虎,等.天水小陇山红豆杉( Taxus chinensis)林土壤真菌多样性及其与生态因子的相关性[J].环境科学研究,2008,1:21.
[15] 冯 健.巨桉人工林地土壤微生物多样性研究[D].成都:四川农业大学,2005:21-23.
Effects of different treatments on soil microbe quantity in Cinnamomum camphora plantation
ZHANG Ming-ming1, YAN Wen-de1,2, LIANG Xiao-cui1,2, DOU Yi-fan1, WANG Zhi-yong1, LIU Liang1
(1.Central South University of Forestry & Technology, Changsha 410004, Hunan, China; 2.National Engineering Laboratory for Applied Technology of Forestry & Ecology in South China, Changsha 410004, Hunan, China)
Quantitative changes of microorganism population was determined with standard dilution plate count method in Cinnamomum camphora forest plantation treated with six treatments,including control with root (CR), extra litter addition with root (LAR), litter removal with root (LRR), extra litter addition without root (LANR), litter removal without root (LRNR), control without root (CNR).The results show that the soil microbe quantity in the plantation sequenced by magnitude:LRNR (67.47×103CFU/g) < LRR(120.36×103CFU/g) Cinnamomum camphora plantation;litter;root;soil microbe quantity S718.52+1.3;S792.23 A 1673-923X(2012)03-0114-05 2011-12-15 国家林业公益性行业科研专项(200804030);国家林业局“948”项目(2007-4-19,2008-4-36);国家自然科学基金项目(31070410);教育部新世纪优秀人才支持计划项目(NCET-10-0151);湖南省科技厅项目(2010TP4011-3);湖南省教育厅项目(湘财教字[2010]70号);长沙市科技局项目(K1003009-61);中南林业科技大学青年科学研究基金重点项目(QJ2010008A) 张明明(1984—),女,河南漯河人,硕士研究生,主要从事城市生态学研究 闫文德(1969—),男,甘肃武威人,教授,博士,主要从事森林生态、城市生态学研究;E-mail: csfuywd@hotmail.com [本文编校:谢荣秀]
