柚木愈伤组织诱导培养的研究
2012-12-28郭彦彤梁坤南黄桂华曾炳山裘珍飞周再知
郭彦彤,梁坤南,黄桂华,曾炳山,裘珍飞,周再知
柚木愈伤组织诱导培养的研究
郭彦彤,梁坤南,黄桂华,曾炳山,裘珍飞,周再知
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
以MS、1/2 MS和WPM为基本培养基分别添加0.5 mg·L-1NAA+1 mg·L-16-BA,以柚木无菌组培瓶苗的茎尖,带节间的茎段,不带节间茎段、叶片为外植体,分析不同类型培养基、外植体对柚木愈伤组织生长的影响;并以MS为基本培养基、茎段(不带节间)为外植体进行生长调节剂水平、固液培养方式、光照条件及培养时间试验,探讨柚木愈伤组织生长的最佳培养条件。结果表明:MS培养基适合愈伤组织生长,外植体茎段(不带节间)为较适外植体,较适生长调节剂浓度组合为0.5 mg·L-1NAA+1 mg·L-16-BA及2 mg·L-1NAA +2 mg·L-16-BA,暗培养28 d后转到光下培养的愈伤诱导率最高,滤纸桥液体培养方式有利于愈伤的诱导,愈伤组织最适继代时间为30~35 d。
柚木;茎段;组织培养;愈伤组织诱导
柚木Tectona grandis为热带高大阔叶乔木,结构致密、材质坚韧、不翘不裂,纹理通直美观,色泽温和,耐腐,抗虫等特点,广泛应用于家具、雕刻等生产用材,为世界名贵的用材树种[1-5]。
目前,国内外的柚木的组培快繁技术已经非常成熟,而且我国的柚木快繁技术现已完全达到了工厂化育苗的要求,但我国引种的柚木在栽培上还面临着树木最初开花期过早(影响主干高度生长)[6],土壤酸性、低温冻害、病虫害等问题的困扰[7],利用植物基因工程对延迟其最初开花时间、改良柚木材性、增强抗逆性等优良性状是一个行之有效的途径,而愈伤组织诱导是实现这一途径的基础。
有关柚木愈伤组织诱导及再生的研究报道较少,而且基本为国外的研究报道,我国在此方面的研究较迟,尤其是针对性地进行柚木愈伤组织诱导的相关研究尚未有报道。作者借鉴前人的研究成果[8-12],通过对基本培养基的筛选和对培养条件的优化试验,旨在筛选出柚木愈伤组织生长较好的培养基及培养条件,为柚木的再生体系建立、遗传转化等生物技术的研究奠定初步的基础。
1 材料与方法
1.1 试验材料
供试材料为中国林科院热带林业研究所选育的柚木优良无性系7114无菌苗,该无性系选自海南尖峰岭柚木种源试验的优良单株,是经初代及继代培养后的组培瓶苗。
1.2 试验设计与方法
培养基及外植体筛选试验采用MS,1/2MS,WPM培养基,以叶片、带节间的茎段、不带节间的茎段、茎尖(即无菌苗顶芽)为外植体。不同光照条件(暗培养7、14、21、28 d,并以一直暗培养为对照,共5个处理)、培养方式(滤纸桥液体培养和固体培养)以及培养时间(5、10、15、20、25、30、35 d)对茎段(不带节间)愈伤组织生长影响的试验采用MS培养基。以上试验均加入1.0 mg·L-16-BA和0.5 mg·L-1NAA。在MS基本培养基上进行生长调节剂 NAA(0.5、1、2 mg·L-1)和 6-BA(0、0.5、1、1.5、2、3、4 mg·L-1)组合的双因素完全随机试验设计,研究NAA与6-BA两种激素对茎段(不带节间)愈伤组织生长的影响试验。培养基中均加入蔗糖30 g·L-1,用琼脂7 g·L-1固化,pH在高压灭菌前调至5.8。上述实验每个处理接种外植体30个,重复3次。
1.3 培养条件及统计分析
培养室温度(25±2) ℃,每日光照时数10 h,光照强度1 800~2 000 lx(暗培养除外),观察4~6周后,统计愈伤组织发生情况。所有百分率数据在进行方差分析前经反正弦变换,采用SPSS14.0软件对数据进行方差分析和最小显著差异性检验(LSD法,P < 0.05)。
2 结果与分析
2.1 不同培养基及不同外植体对愈伤组织生长的影响
方差分析结果(见表1)表明,外植体间柚木愈伤诱导率差异极显著(P<0.01),其中不带节间的茎段、叶片最好,诱导率均达到70%以上,它们与带节间茎段和茎尖的诱导率相比差异显著和极显著。3种基本培养基以及培养基与外植体的交互作用对愈伤组织诱导影响达到显著水平,多重比较表明MS基本培养基要好于1/2MS、WPM基本培养基。
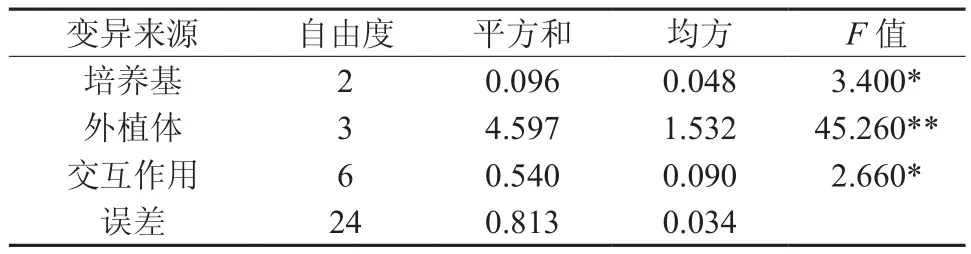
表1 培养基和与外植体对诱导率影响的方差分析†Table 1 Variance analysis of effects of basic mediums and explants on callus induction
外植体接入培养基后10 d左右首先在切口处开始萌动,产生愈伤的质地、状态以MS培养基最好。MS培养基产生的愈伤基本呈黄色到乳黄色、为致密的,颗粒状的愈伤组织。1/2 MS培养基诱导的愈伤为乳黄色,呈水渍状,不适宜进一步的继代培养。WPM培养基上诱导的愈伤茎段(不带节间)为乳白色到灰白色,质地疏松,易碎,无光泽,带节间茎段及叶片的愈伤长的较慢呈黄色致密状。茎尖在此处理条件下只有在MS培养基中才会诱导产生愈伤(见图1),说明了MS培养基适宜不同外植体的愈伤组织诱导。观察还发现,在MS培养基中一般带节间的茎段产生的愈伤基本是在腋芽萌发后产生较大的愈伤(平均直径9 mm),若腋芽未萌发则或者不产生愈伤或者愈伤很小(平均直径2 mm)。WPM培养基中培养的带节间的茎段的腋芽长的很小,这也是在进行柚木快繁时采用MS为基本培养基的原因。
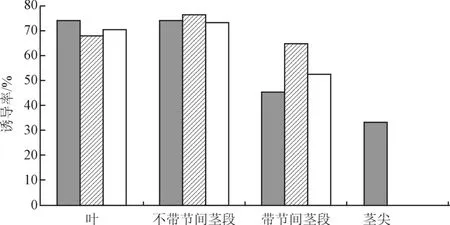
图1 不同培养基及不同外植体对愈伤诱导的影响Fig.1 Effects of different basic medium and different explants on callus induction
由图1可知MS培养基中外植体不带节间的茎段的诱导率最高,达到74.47%,其次是叶片、带节间的茎段和茎尖,诱导率分别为74.24%、45.45%和33.33%。叶片诱导的愈伤在后期的继代培养中发现其较易褐化,茎段(不带节间)愈伤的生活力相对较旺盛,适合用来进行继代培养。权衡愈伤组织的诱导率及其生长情况,使用MS培养基较合适,外植体采用不带节间的茎段较好。
2.2 不同光照条件对茎段(不带节间)愈伤组织诱导的影响
分别暗培养7、14、21、28 d后,再进行光培养,以暗培养为对照,共5种不同的光照处理模式,30 d后愈伤组织的出愈率结果表明,暗培养28 d后转为光培养的处理愈伤组织的诱导率显著高于其它4种处理(P < 0.05)(见表2),说明暗培养对柚木茎段(不带节间)愈伤组织诱导有很大的影响。适宜的暗处理有利于茎段(不带节间)愈伤的生长,同时实验也发现暗培养1~2周后将外植体放于光下培养产生的愈伤虽然颜色、质地差异不大,但产生的愈伤大小要远远小于暗培养3~4周后的愈伤,且生长状况也不如后者。始终暗培养的愈伤组织诱导率低于暗培养28 d后再光照的处理,说明适当的光培养对柚木茎段(不带节间)愈伤的诱导也有一定的促进作用,光暗交替培养可以有效提高愈伤的诱导率。
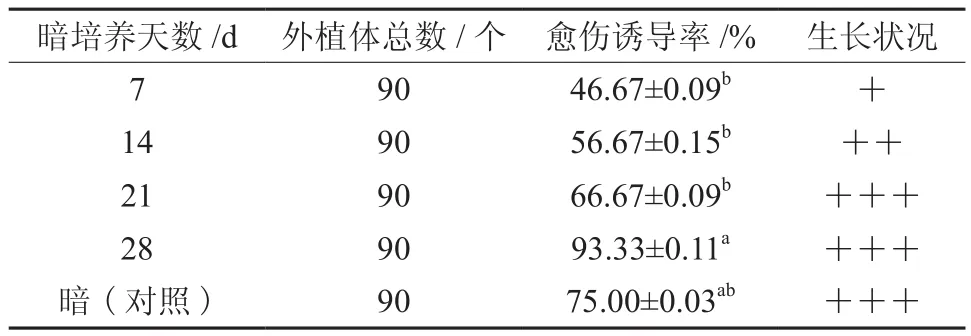
表2 不同光照条件对愈伤组织诱导的影响†Table 2 Effects of different light conditions on callus induction
2.3 不同培养方式对茎段(不带节间)愈伤组织诱导的影响
在MS培养基上分别设置滤纸桥液体培养和固体培养两种方式诱导茎段(不带节间)愈伤。由表3可看出采用滤纸桥液体诱导的方式愈伤诱导率要好于固体培养基,愈伤为绿色,有光泽,致密;固体培养基产生浅黄色或黄绿色、致密的愈伤组织,但前者愈伤需要15 d左右时间才有愈伤产生,固体培养基7 d左右便可见,总体认为滤纸桥液体培养方式好于固体培养方式,有利于愈伤的诱导。
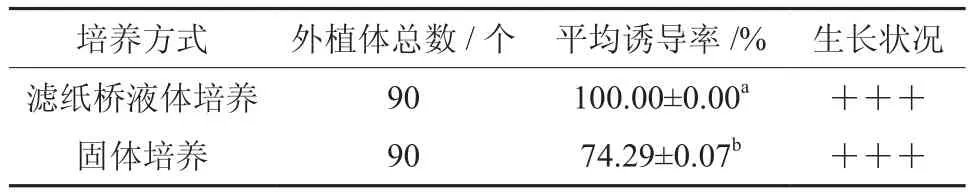
表3 不同培养方式对愈伤组织诱导的影响†Table 3 Effects of culture modes on callus induction
2.4 不同激素水平对茎段(不带节间)愈伤组织诱导的影响
试验选择NAA和6-BA的组合为激素配比,以MS为基本培养基,添加30 g·L-1蔗糖、7g·L-1琼脂,接入7 mm长的无菌幼苗茎段(不带节间)。35 d后统计外植体诱导出的愈伤组织的平均直径及其诱导率。
从表4中可以发现单独添加生长素NAA(浓度0.5~2 mg·L-1)不能诱导茎段(不带节间)产生愈伤组织,外植体只是肿胀,有些会长出白色透明的须根。当6-BA与NAA共同作用后会诱导愈伤组织产生。试验中还发现会产生两种类型愈伤,一种为致密型的;一种为疏松易碎型。当6-BA质量浓度低于2 mg·L-1时诱导产生颜色为浅黄到黄色的致密的愈伤,高于或等于2 mg·L-1时产生黄色到黄绿色的疏松易碎的愈伤组织,并且前种愈伤诱导率较低,在本试验的浓度范围内产生致密的愈伤以1 mg·L-16-BA+0.5 mg·L-1NAA组合诱导率最高,平均直径大小随着NAA浓度的增大呈逐渐减小的趋势。
对于第二种疏松型的愈伤组织诱导率基本都能够达到50%以上,这种愈伤适用于进行液体悬浮继代培养,6-BA与NAA浓度比在1~1.5 mg·L-1有利于愈伤组织的生长,此类愈伤以2 mg·L-16-BA+2 mg·L-1NAA为最好的激素组合。方差分析结果显示(见表5),两种激素以及其交互作用对柚木幼苗茎段(不带节间)愈伤组织诱导率及愈伤直径大小均达到了显著差异(p< 0.05)。综合考虑认为NAA浓度选择0.5 mg·L-1,1 mg·L-1较好,6-BA浓度选择1~3 mg·L-1较适宜,浓度过高过低均不利于愈伤的诱导及生长。
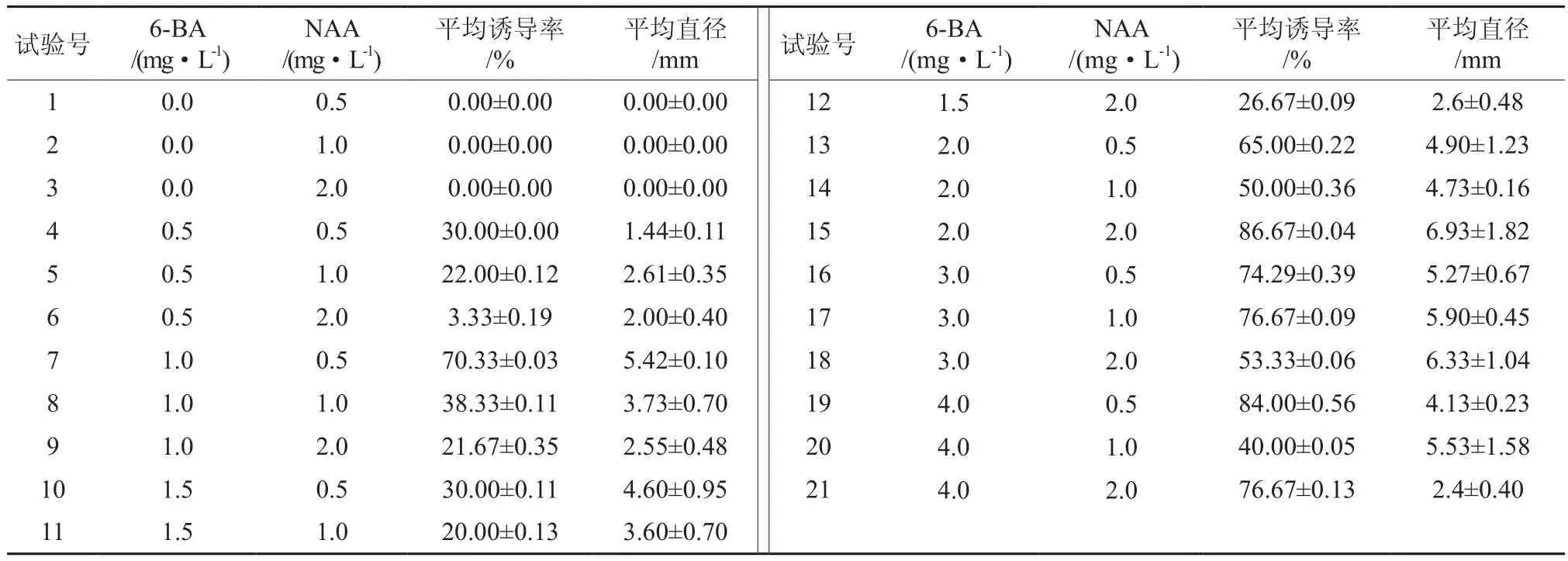
表4 不同生长调节剂水平对愈伤组织诱导的影响Table 4 Effects of different growth regulator levels on callus induction

表5 NAA和6-BA对愈伤大小和诱导率影响的方差分析†Table 5 Variance analysis of effects of NAA and 6-BA on callus growth and callus induction
2.5 培养时间对茎段(不带节间)愈伤组织生长的影响
对不同培养天数的柚木愈伤组织鲜重建立了柚木愈伤组织生长曲线,从图2可以看出柚木愈伤组织的生长曲线大致呈S形。愈伤生长萌动期较长,接种后的前20 d生长曲线较为平滑,这段期间可以看到切口处产生很少浅黄色透明的愈伤组织,20 d后进入对数生长期,在20~30 d期间,愈伤组织生长速度明显加快,可以看到愈伤组织长满整个外植体,且28 d后将培养基转移到光下培养,愈伤组织生长快速加快与此期间的光照培养应该也有很大关系。30~35 d愈伤生长变缓,处于生长平稳期。所以可以认为柚木愈伤组织最适继代时间为30~35 d,这一研究与陈荣[13]、李琰[14]等人对愈伤组织生长的研究相似。
3 结论与讨论
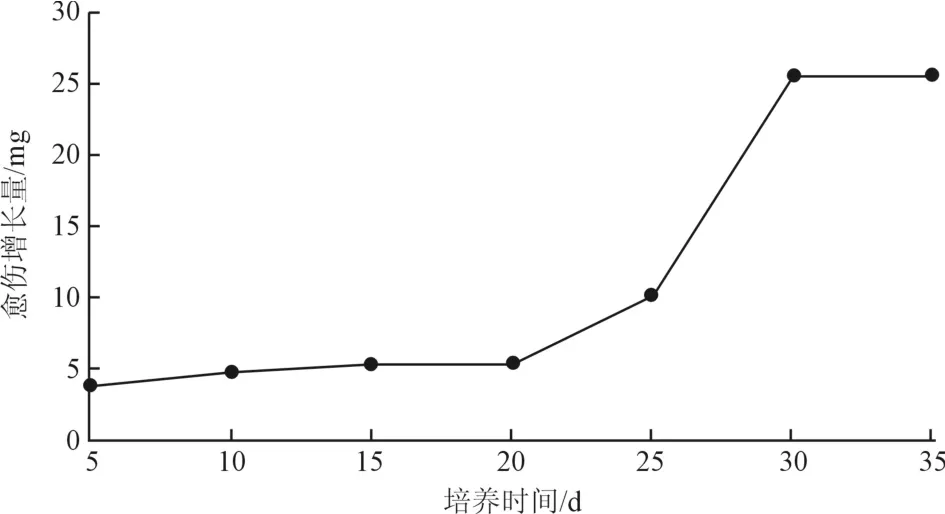
图2 不同培养时间对柚木愈伤组织生长的影响Fig.2 Effect of culture time on callus growth
植物愈伤组织的诱导主要受外植体本身、培养基和培养环境三大因素的调控[15]。一般认为,高盐的基本培养基较适合愈伤组织的生长,在本试验中高盐的MS培养基适合柚木愈伤组织生长,中盐的1/2MS和WPM虽也可以诱导产生愈伤,但愈伤或水渍化或无光泽,生活力不强,不适宜茎段(不带节间)愈伤组织的诱导。Baghel等[10]在对不同基本培养基的选择试验中也采用MS培养基用于愈伤诱导以及再生全过程,他们在试验中发现外植体在MS培养基中愈伤生长的综合反应好于其它培养基。Kushalkar等[9]也采用MS培养基应用于柚木体细胞胚胎发生的研究。当然也有学者认为1/2MS[9],WPM[11-12]培养基为柚木愈伤诱导较适的培养基,这有可能是因为外植体不同,或者使用的激素种类不同导致对不同基本培养基的反应不同,所产生的愈伤质地不同。本试验中以6-BA和NAA两种激素共同处理的情况下,MS培养基诱导的愈伤质地,颜色均好于另外两种基本培养基,因此,认为MS培养基为最适的基本培养基。
由于植物组织或细胞在离体培养条件下往往缺乏合成生长素和细胞分裂素的能力,为了使细胞生长、分化和分裂,在多数情况下需要生长素和细胞分裂素两种生长调节剂的作用[16],而且很多研究表明生长素和细胞分裂素配合使用时效果更好。Rosilah[6]在对柚木愈伤组织诱导的试验中研究也证明6-BA与NAA这两种激素共同作用有利于愈伤的诱导。Baghel等[9]采用子叶、上胚轴等部位做为外植体时发现单独添加生长素NAA、2,4-D都可以诱导愈伤的产生。笔者在前期预试验过程中曾采用叶片为外植体,单独添加生长素NAA(0.5 mg·L-1)进行诱导,也可以产生愈伤,而本试验采用茎段(不带节间)为外植体,在只含有NAA(0.5~2 mg·L-1)的培养基上,愈伤组织的诱导率为零,当和一定浓度的6-BA配合使用时,愈伤组织的诱导率大大提高,产生的愈伤组织较多且质量好,而且有利于愈伤组织的增殖,这种现象说明柚木的不同外植体内部的激素含量水平不同,促使激素对外植体的愈伤诱导效果存在差异,即由于外植体或基因型不同,导致各自的生理状态和所处的生育时期不同,其内源激素浓度和比例不同,以至于出现不同植物的器官和组织,其形态发生能力大不相同,或者即使同种植物不同部分做外植体时,所需要的营养和植物激素的用量也不相同[17]。
本试验中产生两种类型的愈伤组织(图3),方差分析表明与6-BA的浓度有关,当6-BA处于低浓度状态下(小于2 mg·L-1)产生致密的愈伤组织,高浓度下(大于或等于2 mg·L-1)产生疏松的愈伤。细胞分裂素的主要生理作用是促进细胞的分裂和扩大,诱导芽的分化,促进侧芽的萌发生长,抑制衰老;而生长素主要是促进细胞伸长生长和细胞分裂,诱导受伤的组织表面一至数层细胞恢复分裂能力,形成愈伤组织,诱导生根[18]。本试验中单独添加生长素NAA(浓度为1~2 mg·L-1时),茎段(不带节间)外植体有须根产生就是由于生长素有促进生根这一作用的原因。Baghel等[10]采用不同的激素处理产生了不同状态、质地、颜色的愈伤,有致密的,疏松的易碎的;表面干燥的,水渍状的;颜色有白色的、深绿或浅绿、黄色的。许耀祖等[19]在研究薰衣草愈伤诱导情况也发现采用同样两种激素处理会产生两种不同类型的愈伤组织,这些都证明了不同外植体、不同的激素类型以及激素比例产生的愈伤类型也会存在很大差异。本试验中两种愈伤组织都不易褐化,有生活力,适于进行再生分化诱导的愈伤组织因植物种类、外植体等因素不同既有较致密型的又有疏松易碎型的,其中前者适合用于固体培养,后者为进行液体悬浮培养较适愈伤组织。Widiyanto等[12]将产生的浅黄色致密的愈伤组织进行分化培养,最终诱导产生了再生植株。Rosilah等[9]将产生的白色易碎的愈伤进行液体悬浮培养,愈伤产生了胚状体的初期结构(近心型胚)。根据愈伤质地、诱导率及平均直径大小三项指标认为本试验中激素浓度组合MS+0.5 mg·L-1NAA+1 mg·L-16-BA及MS+2 mg·L-1NAA+2 mg·L-16-BA为于愈伤组织的诱导及生长最适培养基。

图3 滤纸桥液体培养基(左);固体培养基及致密型愈伤(中);疏松易碎型愈伤(右)Fig.3 Filter paper bridge with MS liquid medium(left); MS solid culture medium and compact callus(middle);Discrete and friable callus(light)
在愈伤组织诱导阶段,一般采用全暗、周期性光照、散射性光照三种形式。愈伤组织的诱导一般需弱光或不需光,而愈伤组织生长往往需要光照。根据愈伤组织生长曲线也可知培养到第3周后愈伤开始大量生长,而不同暗培养处理中,暗培养两周后将外植体转移到光下培养愈伤诱导率不高,而且长势也不如之后的处理,说明愈伤诱导前期需要3周左右的暗培养时间,然后愈伤进入分裂期,开始迅速生长,这时候进行光培养可以促进愈伤的生长。如果仅进行光培养或暗培养诱导率均为75%左右,但本试验先暗培养28 d然后进行光培养诱导率可达到90%以上,说明光暗交替培养有利于愈伤的诱导及生长。
滤纸桥液体培养较常用于植物组培快繁及生根诱导试验[20-21]。本试验发现液体培养基的诱导率及其愈伤颜色质地要好于固体培养基,诱导率可达到100%,而在固体培养基为75%,有些外植体由绿色变为黄色,最终死亡,可以推测外植体愈伤萌动诱导期间应需要大量的营养元素,液体培养基恰好可以满足外植体短期内选择吸收所需的营养成分的需要,而外植体在固体培养基中对营养元素的吸收效果应没有液体培养基好,此外两种培养方式产生愈伤的颜色不同应该跟此因素也有关系(图3),因此认为滤纸桥液体培养方式更加适合愈伤的诱导。
[1] 中国树木志编委会.中国主要树种造林技术(下册)[M].北京:中国林业出版社,1981:846-851.
[2] 刘 鹏,杨家驹,卢鸿俊.东南亚热带木材[M].第2版.北京:中国林业出版社,2008:282-283.
[3] 马华明,梁坤南,周再知.我国柚木的研究与发展[J].林业科学研究 ,2003,16(6):768-773.
[4] 黄桂华,梁坤南,周再知,等.柚木花粉离体萌发试验[J].林业科学研究,2011,24(4):527-530.
[5] 周再知,徐大平,梁坤南,等.钙离子及pH值对柚木组培苗生长和矿质营养、吸收的影响[J].中南林业科技大学学报,2009, 29(3):1-5.
[6] Rosilah A A, Kandasamy K I.Induction of pro-embryogenic structures or embryo-like-bodies (ELBs) in teak (Tectona grandis)[J].Identifying Potential Commercial Collaborations,2005:202-205.
[7] 邝炳朝.柚木基因资源的特点和我国柚木遗传改良途径[J].热带林业科技,1982(1):40-46.
[8] 王宝生,曹月华,黄良胜.柚木茎尖的培养[J].植物学报,1980, 22(2): 200-201.
[9] Kushalkar R,Sharon M.Direct and indirect somatic embryogenesis in teak (T.grandis L.)[J].Current Science,1996,71:712-715.
[10] Baghel R S,Tiwari S,Tripathi M K.Comparison of morphogenic and plant regeneration ability of some explants of teak (Tectona grandis Linn.F) [J].Journal of Agricultural Technology,2008,4(2):125-136.
[11] Yunaini L,Widiyanto S.N.Somatic embryogenesis from callus cultures of teak derived from leaf explants[C]//Congress on In Vitro Biology.Portland,2003:2066.
[12] Widiyanto S.N.,Erytrina D.,Rahmania H.Adventitious shoot formation on teak (T.grandis) callus cultures derived from internodal segments[J].Acta Horticulturae,2005,692:153-158.
[13] 陈 荣,冯立新,刘 颖,等.西南桦愈伤组织培养试验[J].北方园艺, 2011, 16:158-160.
[14] 李 琰,冯俊涛,王永宏,等.培养基及培养条件对雷公藤愈伤组织生长和次生代谢产物含量的影响[J].林业科学, 2010,46 (5):64-69.
[15] 谷瑞升,蒋湘宁,郭仲琛.植物离体培养中器官发生调控机制的研究进展[J].植物学通报,1999,16(3): 1-4.
[16] 崔凯荣,刑更生,周攻克,等.植物激素对体细胞胚胎发生的诱导与调节[J].遗传, 2000, 22(5): 349-354.
[17] 周维燕.植物细胞工程原理与技术[M].北京:中国农业大学出版社, 2001,76-77.
[18] 潘 宇,胡宗利,陈国平,等.中华芦苔愈伤组织的诱导[J].重庆大学学报, 2007, 5(30):113-118.
[19] 许耀祖,韦彦余,王晓军.薰衣草叶片高频再生体系的建立[J].园艺学报 , 2006, 33 (1) :182-185.
[20] 孙仲序,王玉军,刘 静,等.植物组培快繁滤纸桥生根新技术[J].山东农业大学学报, 2002, 33(3):257-263.
[21] 韩仰海,赵海红,陈德祥.不同支持物对马铃薯脱毒试管苗快繁的影响[J].黑龙江农业科学,2008(5): 22-24.
Research on induction and culture of callus of teak (Tectona grandis)
GUO Yan-tong, LIANG Kun-nan, HUANG Gui-hua, ZENG Bing-shan, QIU Zhen-fei, ZHOU Zai-zhi
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, Guangdong,China)
Adopting the Ms, 1/2 Ms, and WPM as different basic mediums supplemented with 0.5mg·L-1NAA+1mg·L-16-BA respectively, the various explants of node stem, top buds, stem (without internode) and leaves of tissue-culture container seedlings of teak (Tectona grandis L.f.), were used to study the effects of different mediums on callus growth of teak.Growth regulators, solid and liquid cultivation mode, light conditions and culture time were studied using MS as basic medium and stem (without internode) as explants to explore the best culture conditions of the callus growth.The results show that MS medium was best for callus growth.The growth regulator combinations of 0.5 mg·L-1NAA+1 mg·L-16-BA and 2 mg·L-1NAA+2 mg·L-16-BA were suitable for callus growth of teak.The explants cultured 28 days in dark condition then turned to light condition had higher rate of the callus induction.Filter paper bridge with MS liquid medium was better than solid culture medium.The optimal duration for callus subculture was around 30~35 days.
teak; stem; tissue culture; callus induction
S796;S722.3+7
A
1673-923X(2012)03-0053-06
2012-01-15
国家林业公益性行业科研专项重大项目(201104001)
郭彦彤(1985—),女,辽宁营口人,硕士研究生,主要从事林木遗传育种研究
梁坤南(1962—),男, 研究员,硕士生导师,主要从事林木遗传育种研究; E-mail: lkn@ritf.ac.cn
[本文编校:欧阳钦]
