甲醛滴定法测定牛血清白蛋白的酶解度
2012-12-27王剑锋盖明昊刘宝全范圣第
王剑锋,孙 爽,李 瑶,盖明昊,肖 龙,张 坤,刘宝全,范圣第
(大连民族学院生物化学工程国家民委-教育部重点实验室,辽宁大连 116605)
甲醛滴定法测定牛血清白蛋白的酶解度
王剑锋,孙 爽,李 瑶,盖明昊,肖 龙,张 坤,刘宝全,范圣第
(大连民族学院生物化学工程国家民委-教育部重点实验室,辽宁大连 116605)
针对作者前期提出的蛋白质酶解度定义,发展了一种利用甲醛滴定实验测定蛋白质酶解度的方法。分别利用甘氨酸与赖氨酸研究了α位游离氨基和ε位游离氨基在甲醛滴定实验中的测量状况,结果表明,甲醛滴定法测量结果比实际值偏低,进而利用修正系数对测定结果进行校正,确定甘氨酸、赖氨酸与牛血清白蛋白的修正系数分别为0.797,1.292和52.47,利用甲醛滴定法测定并计算出胰蛋白酶对底物牛血清白蛋白在本实验特定酶解条件下的酶解度为22.7。
酶解度;甲醛滴定法;蛋白质;酶;水解
蛋白质酶解技术已经广泛应用于食品、药品、美容等领域,一系列功能多肽相继被发现、分离纯化和广泛应用,如降压肽、美容肽等。利用蛋白质酶解技术生产功能多肽,其核心工作是优化酶解条件和控制蛋白质的酶解程度。由于蛋白质酶解的实质就是多肽链中的肽键在蛋白酶的作用下发生水解并不断形成新的多肽链的过程,因此可以基于多肽链数目变化定义蛋白质的酶解过程。本文作者从多肽链数目变化的角度考察了蛋白质的酶解过程,提出了蛋白质酶解度(Degree of enzymatic hydrolysis,DEH)的概念[1],即将蛋白质酶解体系中新增肽链总数与酶解前肽链总数的比值定义为酶解度;并发展了一种利用游离氨基测定蛋白质酶解度的方法。
测定游离氨基的方法有很多种[2-6],如三硝基苯磺酸法、邻苯二甲醛法、水合茚三酮法、甲醛滴定法等。其中甲醛滴定法是测定游离氨基的最常用方法之一。针对甲醛滴定法测量结果受多肽链中氨基酸侧链氨基干扰和测量中存在的结果偏低问题,本文作者利用修正系数进行校正,将甲醛滴定法测定的游离氨基的物质的量与体系中蛋白质(多肽或氨基酸)物质的量的比值定义为修正系数,用以对甲醛滴定法测定蛋白质酶解度的方法进行补充与完善。
1 材料与方法
1.1 材料
牛血清白蛋白(Bovine Serum Albumin V,下称BSA),纯度 >98%(Sanland Chemical公司);胰蛋白酶(Trypsin)(1∶250)(Amresco公司产品);酚酞、邻苯二甲酸氢钾、氢氧化钠及其他试剂均为国产分析纯;实验用水为自制双蒸水。
1.2 甲醛滴定与游离氨基的计算
准确称取5.000 0 g BSA,用酶解缓冲液(10 mmol·L-1磷酸盐缓冲液(pH7.0))溶解后,定容到1 L。
分别取10 mL BSA溶液与10 mL酶解缓冲液、5 mL双蒸水、0.75 mL酚酞指示剂充分混合,用标定的碱液小心滴定至终点,记录滴定到终点所耗用的标定碱液的体积VCK-BSA。重复3次,取平均值。用0.01 mol·L-1的甘氨酸溶液替代双蒸水,用酶解缓冲液代替BSA溶液,测得VCK-Gly;用同样方法获得赖氨酸滴定消耗的碱液体积VCK-Lys。
甲醛滴定:按5 mL甲醛、0.75 mL酚酞指示剂的比例,将二者混合均匀后,用碱液滴定到终点,获得中和甲醛。向其中分别加入10 mL BSA溶液与10 mL酶解缓冲液、5 mL双蒸水,充分混合后,用标定的碱液小心滴定至终点,记录滴定到终点所耗用的标定碱液的体积VFormol-BSA。重复3次,取平均值用于计算。用0.01 mol·L-1的甘氨酸溶液替代双蒸水,用酶解缓冲液替代BSA溶液,测得VFormol-Gly;用同样方法获得赖氨酸滴定消耗的碱液体积VFormol- Lys。
根据甲醛滴定法的基本原理,即滴定所消
耗的标定碱的物质的量就是体系中游离氨基的物质的量,利用 VFormol-BSA、VCK-BSA和标定的碱液的浓度NNaOH,可以计算出体系中 BSA的游离氨基的总物质的量。
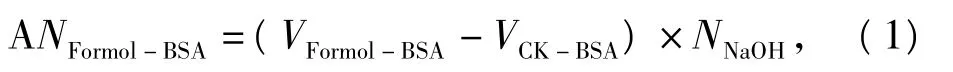
式中,ANFormol-BSA为10 mL BSA溶液体系中的游离氨基总物质的量,NNaOH为标定的NaOH溶液的浓度。
根据操作1.2的测定结果,利用式(1)分别计算出特定体积的BSA溶液、甘氨酸溶液、赖氨酸溶液 中 的 游 离 氨 基 数 ANFormol-BSA、ANFormol-Gly、ANFormol-Lys。本文中将 BSA 溶液、甘氨酸溶液、赖氨酸溶液的修正系数分别用KBSA、KGly、KLys表示,以BSA为例,其修正系数KBSA的计算式为
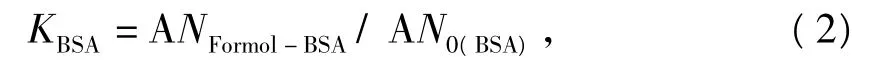
式中,ANFormol-BSA为BSA溶液中甲醛滴定法测定的游离氨基物质的量(测量值),AN0(BSA)为实验体系中BSA的初始物质的量(理论值)。
1.3 酶解度的测定
准确称取0.020 0 g胰蛋白酶(Trypsin),用酶解缓冲液(同1.2)溶解后,定容到0.1 L。取5 mL甲醛溶液,加入0.75 mL酚酞指示剂,加入10 mL胰蛋白酶溶液,充分摇匀并使酶变性;加入10 mL BSA溶液,充分摇匀;用标定碱液小心滴定至终点,记录滴定所用的标定碱液的体积VBSA+E。
将固定体积(10 mL)的BSA溶液与固定体积(10 mL)的胰蛋白酶溶液混合后开始计时,置于限定条件下进行酶解。酶解后,迅速转移到已经加入0.75 mL酚酞指示剂的5 mL甲醛溶液中,充分摇匀。用标定碱液小心滴定至终点,记录滴定所消耗的标定碱液的体积V1。此处的限定条件为10 mmol·L-1磷酸盐缓冲液(pH7.0)、酶解温度为37℃、酶解时间为180 min;酶解条件按参考文献[7]的方法进行。计算酶解体系的游离氨基增量(ΔAN1)。

注意:将10 mL BSA溶液预热后,加入10 mL胰蛋白酶溶液后迅速混合,并置于限定酶解条件下反应180 min;反应结束后,要迅速取出并进行甲醛滴定,以保证实验体系的准确性。
1.4 蛋白质酶解度的计算
将ΔAN1和AN0代入到酶解度(DEH)的计算式[1]即可完成酶解度的计算。

式中,DEH1为第一次测量状态下体系的酶解度,AN0为酶解反应中初始底物的肽链数。
2 结果与讨论
2.1 游离氨基总数的甲醛滴定法测定
按1.2的操作方法分别对BSA与甘氨酸及赖氨酸溶液进行甲醛滴定,测定结果见表1。其中,氢氧化钠溶液的标定浓度为0.009 268 mol·L-1,BSA溶液加入甲醛溶液后滴定所消耗碱液的体积标记为VFormol-BSA,BSA溶液不加甲醛溶液而直接滴定所消耗标定碱液的体积标记为VCK-BSA,相应地将甘氨酸溶液的相关结果分别标记为VFormol-Gly和VCK-Gly,赖氨酸溶液的相关结果分别标记为
VFormol-Lys和 VCK -Lys。

表1 BSA与甘氨酸及赖氨酸溶液的甲醛滴定实验结果
2.2 甘氨酸与赖氨酸溶液修正系数的计算
根据式(1),利用滴定结果及氢氧化钠溶液的标定浓度(0.009 268 mol·L-1),分别计算测定体系中的甘氨酸、赖氨酸的游离氨基总数

甘氨酸的浓度为0.01 mol·L-1,实验中取用量为5 mL,测量体系中的甘氨酸物质的量为0.05 mmol。每个甘氨酸分子有一个游离氨基,体系中氨基的总物质的量为0.05 mmol(理论值)。而根据表1数据,实际计算出的甘氨酸溶液的游离氨基仅为0.039 85 mmol(测量值),只占全部的79.7%。此实验结果表明,利用甲醛滴定法测定游离氨基总数,其测定结果偏低,与文献报导结论一致[2-4]。
根据修正系数的定义,甘氨酸溶液的游离氨基测定中的修正系数(KGly)为
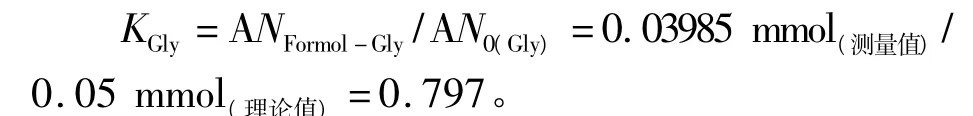
在赖氨酸溶液游离氨基测定实验中,赖氨酸的浓度为 0.01mol·L-1,取用量为 5 mL,测量体系中的赖氨酸物质的量为0.05 mmol(理论值)。根据表1数据,计算赖氨酸溶液的游离氨基测定中的修正系数(KLys)为

在上述赖氨酸溶液中,每个赖氨酸分子有一个α位游离氨基和一个ε位游离氨基,氨基总物质的量为0.1 mmol,但实际测定值仅为0.0646 mmol,只占全部的64.6%;小于甘氨酸溶液中的79.7%。这一结果表明,ε位游离氨基在甲醛作用下释放质子的能力比α位游离氨基还要低。由于α位游离氨基和ε位游离氨基都不能在甲醛作用下完全释放质子,所以利用甲醛滴定法测定游离氨基时,测定结果偏低,这应该是甲醛滴定法测定值偏低的主要原因。通过修正系数的引入,可以在一定程度上弥补甲醛滴定法测定结果偏低的不足。
2.3 BSA溶液中肽链总数的相关计算
根据 NCBI网站(http://www.ncbi.nlm.nih.gov/protein/CAA76847.1)信息,成熟的 BSA共583个氨基酸,利用生物信息学相关软件可获得BSA的计算分子量为66 451.5。根据BSA的分子量,实验体系中将5.000 0 g溶解后定容到1 L,其最终浓度为 0.075 24 mmol·L-1;即 10 mL BSA溶液体系中肽链数(AN0(BSA))为 0.0 007 524 mmol(理论值)。
根据式(1),利用表1中甲醛滴定实验结果及氢氧化钠溶液的标定浓度(0.009 268 mol·L-1),计算测定体系中的BSA的游离氨基总数(ANFormol-BSA)为

从实验结果可知,测定所用的10 mL BSA溶液中的游离氨基物质的量为0.039 48 mmol(测量值)。
根据修正系数计算式(2),BSA溶液的修正系数(KBSA)为

对BSA的实验测定结果和氨基酸序列进行对比分析可知,10 mL BSA溶液体系中的游离氨基测定的物质的量(0.03 948 mmol)远大于BSA的理论物质的量(0.000 752 4 mmol),这主要与BSA序列中存在有大量的侧链游离氨基有关。由于BSA组成氨基酸中的侧链氨基、胍基、酚羟基上的质子均可发生解离,都会使甲醛滴定法测定的游离氨基的数目升高。BSA序列中有59个赖氨酸、23个精氨酸、27个苯丙氨酸、17个组氨酸,这些氨基酸的侧链基团都会影响到BSA的甲醛测定实验结果;由于BSA有大量的侧链解离基团,其修正系数也相应较高(KBSA为52.47)。
2.4 10 mLBSA溶液酶解后碱液消耗量的测定
按1.3 的操作方法,分别测定 V1、VBSA+E,实验结果见表2。

表2 甲醛滴定中的碱液消耗量
2.5 利用甲醛滴定法测定BSA的酶解度
根据文献[1]的酶解度计算式以及相关的计算式,将酶解度计算式进行整理:

从以上的计算式整理过程可以看出,只要知道了修正系数,酶解度测定只需要4个体积值,分别是:V1、VBSA+E、VFormol-BSA,VCK-BSA(见表 1)。
根据相应操作方法分别测定VBSA+E和V1,测定3次求平均值。利用ANFormol-BSA的计算结果,将10 mL BSA溶液与10 mL胰蛋白酶溶液混合后,混合液在限定酶解条件下反应180 min的酶解度DEH1,可依据式(5)进行计算:


由计算结果可知,测定体系中的BSA经过胰蛋白酶水解180 min,体系中的多肽链数目增加了22.7倍,即每条多肽链平均被切割了22.7次。如果调整酶解过程的作用温度、作用时间、缓冲液组成,则酶解效果还可以通过酶解度进行比较,进而获取最优化的反应条件[8]。酶解度的测定与计算结果可以与文献[7]相配合,用于研究胰蛋白酶水解牛血清白蛋白的动力学特征;也可以参考文献[9]的方法,研究牛血清白蛋白胰蛋白酶酶解条件与酶解产物的关系。
3 结论
(1)利用甲醛滴定实验可以确定酶解体系中蛋白质的酶解度。
(2)利用修正系数对甲醛滴定实验测定结果进行校正,可以提高测定结果的准确性。
(3)本文所建立的利用甲醛滴定法进行牛血清白蛋白的酶解度测定方法,不需要复杂仪器设备,便于推广使用。在已知修正系数条件下,酶解度只与碱液消耗的4个体积有关,不需要精确标定碱液的浓度,简化了实验操作。
[1]刘宝全,王剑锋,李春斌,等.蛋白质酶解度的定义[J].大连民族学院学报,2012,14(1):9-11.
[2]郭兴凤.蛋白质水解度的测定[J].中国油脂,2000,25(6):175-177.
[3]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,179(11):65 -67.
[4]徐英操,刘春红.蛋白质水解度的测定方法综述[J].食品研究与开发,2007,28(7):173 -176.
[5]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:高等教育出版社,1997.
[6]徐勤,葛向阳,刘建峰.甲醛法测大豆蛋白水解度的改进[J].饲料工业,2008,29(5):46-47.
[7]史德青,齐崴,何志敏,等.胰蛋白酶水解牛血清白蛋白过程集总动力学研究[J].石油大学学报:自然科学版,2003,27(3):84 -87.
[8]齐崴,何志敏.基于分子机制的蛋白质酶解反应经验修饰动力学模型[J].分子催化,2006,20(6):585-590.
[9]王贤纯,范春明,唐新科,等.牛血清白蛋白胰蛋白酶酶解产物的色谱-质谱联用分析及其三种数据库搜寻鉴定方法的比较[J].中国生物化学与分子生物学报,2004,20(3):393 -398.
Determination of Degree of Enzymatic Hydrolysis of BSA by Formol Titration Method
WANG Jian-feng,SUN Shuang,LI Yao,GAI Ming-hao,XIAO Long,ZHANG Kun,LIU Bao-quan,FAN Sheng-di
(Key Laboratory of Biochemistry Engineering of the State Ethnic Affairs Commission-Ministry of Education,Dalian Nationalities University,Dalian Liaoning 116605,China)
In this paper,the DEH(degree of enzymatic hydrolysis)of Bovine Serum Albumin(BSA)was tested and calculated with formol titration method.The conception of DEH was established and named and a determination method was developed based on formol titration.A correction coefficient was introduced to correct the determination results because of the weakness of formol titration.The values of correction coefficient of glycine and lysine in formol titration were 0.797 and 1.292,but it was 52.47 in BSA because of its abundant lateral chain groups.The α-amino group was different from ε-amino group in formol titration.According to the definition and the calculation formula of DEH,the enzymatic hydrolysis results of the BSA,which digested with trypsin in limited condition,were obtained by the formol titration method and the DEH was 22.7 in this research.
degree of enzymatic hydrolysis;formol titration method;protein;enzyme;hydrolysis
Q519
A
1009-315X(2012)05-0441-04
2011-10-27;最后
2012-04-15
教育部科学技术研究重点项目(2010-263);国家民委项目(09DL08);辽宁省教育厅资助项目(2009A154);大连民族学院人才启动基金资助项目(20096102)。
王剑锋(1968-),男,辽宁锦州人,副教授,主要从事生物化学工程相关研究。
刘宝全(1972-),男,蒙古族,辽宁北票人,副教授,博士,主要从事化学与生物学交叉学科研究,Email:lbq@dlnu.edu.cn。
(责任编辑 邹永红)
