吡啶硝酸盐与醇二元混合体系物化性能研究
2012-12-26王建英梁丽亚昝昊搏胡永琪
王建英,梁丽亚,昝昊搏,胡永琪
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.唐山职业技术学院临床医学部,河北唐山 063000)
吡啶硝酸盐与醇二元混合体系物化性能研究
王建英1,梁丽亚1,昝昊搏2,胡永琪1
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.唐山职业技术学院临床医学部,河北唐山 063000)
采用MDY-2电子密度仪和德国DCAT21全自动表面张力仪,在298.15 K下测定了离子液体N-丁基吡啶硝酸盐(N-butylpyridinium nitrate,[BuPy]NO3)与有机溶剂甲醇、乙醇、正丁醇在全浓度范围内(离子液体在有机溶剂中的摩尔分数为0~1)的密度和表面张力,计算了二元体系{[BuPy]NO3+CH3OH},{[BuPy]NO3+C2H5OH}和{[Bu Py]NO3+C4H9OH}的超额摩尔体积V E和表面张力偏差δγ,分别利用Redlich-Kister方程对二元体系的超额摩尔体积V E和表面张力偏差δγ进行了拟合。结果表明:二元体系{[BuPy]NO3+CH3OH}和{[BuPy]NO3+C2H5OH}的超额摩尔体积V E在全摩尔组成范围内均为负值,而{[BuPy]NO3+C4H9OH}二元体系在低离子液体摩尔分数时为正值,随着离子液体摩尔分数的增大由正值变为负值。在全摩尔组成范围内,{[BuPy]NO3+CH3OH}的表面张力偏差δγ为正值,{[BuPy]NO3+C2H5OH}和{[BuPy]NO3+C4H9OH}的δγ为负值,随着醇碳链的增长,表面张力偏差出现由正到负的变化趋势。
离子液体;密度;表面张力;超额摩尔体积
离子液体的物理性质数据是相关工业设计和开发的重要基础[1]。离子液体的一些独特的性质与它们的结构密切相关。一方面,通过改变阴、阳离子的不同组合来调节它们的物理性质,如密度、表面性能、极性、溶解性能、熔点等;另一方面,有机溶剂的加入也能显著改变离子液体的物理性质,从而影响其性能。离子液体与有机溶剂二元体系在很多方面显示出不同于分子溶剂的特性,因而在有机合成、催化反应等方面表现出了相当的优势[2]。例如:离子液体1-丁基-3-甲基咪唑四氟硼酸盐([BMIM][BF4])和1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6])与醇类混合溶剂体系中进行亲电氟化反应,其反应速率及选择性比传统溶剂有很大的提高[3];离子液体[BMIM][BF4]和二氯甲烷的混合溶液是硝酸铈铵催化1,3-二羰基化合物和取代加成反应的优秀溶剂,反应速率比在乙腈中有大幅提高[4]。因此,开展离子液体与分子溶剂二元体系的物理性能研究对于拓宽与离子液体有关的工业应用具有非常重要的意义。
目前,有大量文献报道了阴离子为[PF6],[BF4],[MeSO4],[SCN],[EtSO4],[MetSO4],[triflate],[NTf2],[dca],[EtOSO3],[CH3SO4],[OcSO4][5-8]的咪唑类离子液体和有机溶剂如乙醇、丁醇、戊醇、己醇、苯甲醛和N,N二甲基甲酰胺等有机溶剂二元混合体系的表面张力、密度、黏度、折光率、比热容及其热力学性质等。但是这些文献大都是基于咪唑类离子液体和有机溶剂二元体系的研究,关于吡啶类离子液体和有机溶剂混合物的研究却少见报道。
笔者系统测定了298.15 K下离子液体[BuPy]NO3和甲醇、乙醇、正丁醇混合的二元体系在全浓度范围内的密度和表面张力,计算了3个二元体系的超额摩尔体积V E和表面张力偏差δγ,并对3个二元混合物的体积性质和表面性质进行了讨论。
1 实验材料与方法
1.1 仪器及试剂
MDY-2电子密度仪(上海方瑞仪器有限公司提供);DCAT21全自动表面张力仪(德国Dataphysics公司提供);FC204型电子天平(上海精科天平仪器厂提供);DC-3005A型低温恒温槽(宁波天恒仪器厂提供)。
N-丁基吡啶硝酸盐离子液体([BuPy]NO3,纯度为99%,购自上海成捷化学有限公司);甲醇、乙醇、正丁醇,均为色谱醇(购自天津市永大化学试剂开发中心)。
1.2 离子液体与醇二元体系密度及表面张力测定
在温度为298.15 K、高纯氮气保护下,采用MDY-2电子密度仪和德国DCAT21全自动表面张力仪,测定了二次蒸馏水的密度和表面张力,测定值与文献值一致。在高纯氮气保护下,用低温恒温槽进行循环水控制温度,测量了离子液体[BuPy]NO3和甲醇、乙醇、正丁醇以不同摩尔比混和的二元体系的密度和表面张力。
2 结果与讨论
2.1 离子液体[BuPy]NO3和甲醇、乙醇、正丁醇二元混合体系的密度及体积性质

从图1可以看出,[BuPy]NO3和醇二元混合体系的密度值随着离子液体醇溶液中离子液体摩尔分数的增大而呈现缓慢增加的趋势。因而可以通过添加一定比例的醇来改变离子液体的物性,进而满足其在不同领域的应用。
超额摩尔体积的研究有助于了解[BuPy]NO3和醇二元混合体系中的分子间相互作用信息[9]。由实验测得[BuPy]NO3和醇二元混合体系的密度值,通过式(1)计算得到超额摩尔体积:

式中:xIL为混合物中[BuPy]NO3的摩尔分数;ρ,ρ1,ρ2分别是二元混合体系的密度、纯离子液体[BuPy]NO3的密度和溶剂醇的密度;M1和M2分别是[BuPy]NO3和溶剂醇的分子质量。超额摩尔体积由 Redlich-Kister[10-12]方程(简称 R-K 方程)进行拟合,即
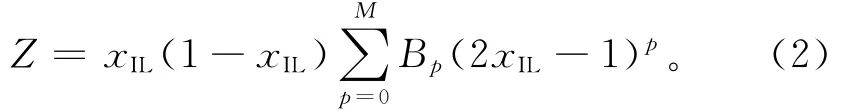
式中:Z代表超额性质;xIL是离子液体[BuPy]NO3的摩尔分数;B p是拟合参数;M是用Marquardt多项式优化的多项式扩张阶数。
由式(2)得到的实验值和理论值的标准偏差σ为

式中:Zexp为实验值;Zcal为计算值;ndat为实验组数。
298.15 K时,[BuPy]NO3和醇二元体系超额摩尔体积V E随离子液体摩尔分数变化曲线见图2。

图1 T=298.15 K,[BuPy]NO3和醇二元体系密度ρ随离子液体摩尔分数变化曲线Fig.1 Curve of densityρof binary mixture of[BuPy]NO3 and alcohol against the molar fraction at T=298.15 K
从图2可以看出,{[BuPy]NO3+ 甲醇}和{[BuPy]NO3+乙醇}二元混合体系的超额摩尔体积V E在全摩尔组成范围内均为负值。这种现象与二元体系{[BuPy]BF4+甲醇},{[BuPy]BF4+ 乙醇}的V E变化趋势相似[4]。对二元体系{[BuPy]NO3+甲醇}来说,在xIL<0.43时,超额摩尔体积随着离子液体摩尔组成的增大而减小,在xIL=0.43时达到最小值;在xIL>0.43时,超额摩尔体积呈现出随离子液体摩尔分数增大而增大的趋势。而对于{[BuPy]NO3+乙醇}体系,在xIL<0.59时,超额摩尔体积随着离子液体摩尔分数的增大而减小,在xIL=0.59处出现最小值,当xIL>0.59时,超额摩尔体积随着摩尔分数的增加而增大。由图2可知二元体系{[BuPy]NO3+乙醇}超额摩尔体积随摩尔分数变化曲线是几乎对称的,而[BuPy]BF4和醇混合的二元体系的V E曲线呈现出不同的形状[4]。
与{[BuPy]NO3+ 甲醇}和{[BuPy]NO3+ 乙醇}2个体系相比,{[BuPy]NO3+正丁醇}二元体系超额摩尔体积在全摩尔组成范围内呈现出不同的变化趋势。由图2可以看出,V E随摩尔分数的变化曲线在全摩尔组成范围内呈倒S型,在xIL为0.2和0.74时分别出现最大值和最小值,在xIL=0.44时,{[BuPy]NO3+正丁醇}的超额摩尔体积由正变负,曲线的变化趋势和吡啶离子液体[Pyrr][C7CO2]与正丁醇二元混合体系的变化趋势相同[13]。
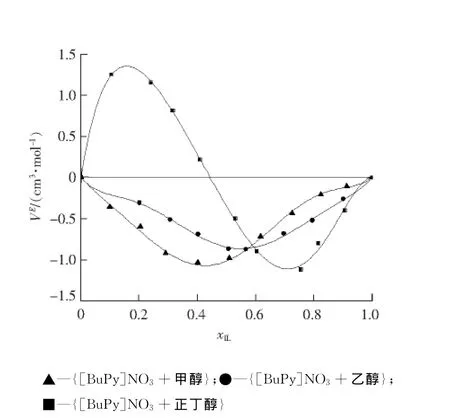
图2 [BuPy]NO3和醇二元体系超额摩尔体积V E随离子液体摩尔分数变化曲线Fig.2 Excess molar volumes V E of binary mixture of[BuPy]NO3 and alcohol against the molar fraction
{[BuPy]NO3+甲醇}和{[BuPy]NO3+乙醇}体系的超额摩尔体积在全摩尔组成范围内呈现负值,说明不同分子间的交叉缔合强于同分子间的自缔合,组分间分子大小的不对称产生填充[18],故超额摩尔体积为负。超额摩尔体积为正值即二元混合体系与理想溶液形成正偏差,这表明在混合过程中,有机溶剂醇降低甚至打破了纯离子液体的阴离子和阳离子之间强烈的静电吸引作用。对于3个二元混合体系来说,{[BuPy]NO3+甲醇}混合物的超额摩尔体积最小,{[BuPy]NO3+正丁醇}的超额摩尔体积最大,说明离子液体[BuPy]NO3与甲醇分子间的作用力最大,与乙醇的次之,与正丁醇的分子间作用力最小。二元体系超额摩尔体积出现最小值的原因是在这个摩尔分数时,二元体系分子间相互作用力最大,从而导致体积最小。
2.2 离子液体[BuPy]NO3和甲醇、乙醇、正丁醇二元混合体系的表面张力
图3为298.15 K下,[BuPy]NO3和甲醇、乙醇、正丁醇3个二元混合体系的表面张力(γ)随离子液体摩尔分数变化的结果,表面张力偏差随离子液体摩尔分数变化的曲线见图4。
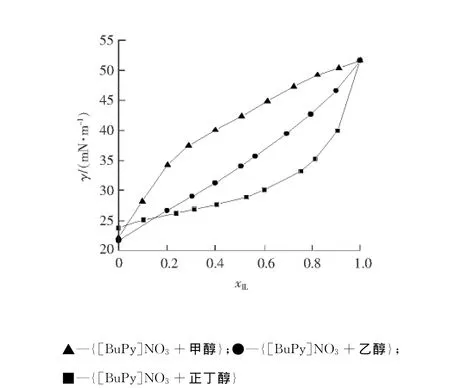
图3 [BuPy]NO3和醇二元混合体系表面张力随离子液体摩尔分数变化曲线Fig.3 Curve of surface tension of binary mixture of[BuPy]NO3 and alcohol against the molar fraction
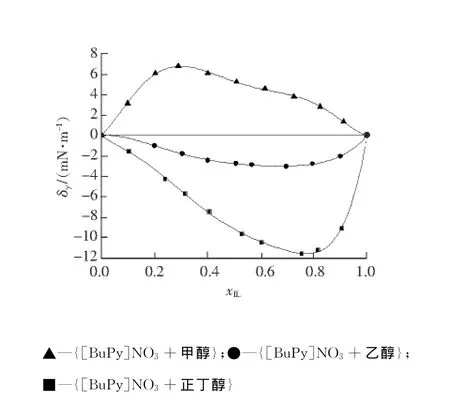
图4 [BuPy]NO3和醇二元混合体系表面张力偏差随离子液体摩尔分数变化曲线Fig.4 Surface tension deviations of binary mixture of[BuPy]NO3 and alcohol against the molar fraction
从图3可以看出,[BuPy]NO3与甲醇、乙醇、正丁醇二元混合体系在全摩尔组成范围内的表面张力值介于纯离子液体与醇之间,且随离子液体摩尔分数的增加而增大。对于{[BuPy]NO3+甲醇},{[Bu Py]NO3+乙醇}和{[BuPy]NO3+正丁醇}这3个二元混合体系来说,随着脂肪醇碳链的增长,表面张力曲线随离子液体摩尔分数的增加趋势变缓,这说明分子间作用力对表面张力起着决定性的作用。
[BuPy]NO3与乙醇混合的表面张力随离子液体摩尔分数的增加几乎呈线性变化,这表明在全摩尔组成范围内,乙醇分子和离子液体在表面相为均匀混合。而[BuPy]NO3和甲醇、正丁醇二元混合体系的表面张力随离子液体摩尔分数变化的趋势与{[BuPy]NO3+乙醇}二元混合体系不同,{[BuPy]NO3+甲醇}二元混合体系的表面张力在xIL<0.3时增加较快,但在xIL>0.3后增长趋势变缓。而{[BuPy]NO3和正丁醇}二元混合体系的表面张力在xIL<0.6时增加较缓,而在xIL>0.6后迅速增长。即{[BuPy]NO3+甲醇}和{[BuPy]NO3+正丁醇}这2个二元混合体系的表面张力随着离子液体摩尔组成变化曲线均出现拐点。这种表面张力随离子液体摩尔组成变化曲线出现拐点的现象与[EMIM][CH3SO4]和甲醇、乙醇及正丁醇混合的二元混合体系是相似的[6]。
表面张力偏差(δγ)通过式(4)计算得出:

式中:γ和γi分别代表混合体系的表面张力和组分i的表面张力;x i代表组分i的摩尔分数。
T=298.15 K,[BuPy]NO3和醇二元混合体系表面张力偏差随离子液体摩尔分数变化曲线见图4。图4是用R-K方程拟合的表面张力偏差,拟合方程如下:

由图4可以看出,二元混合体系{[BuPy]NO3+甲醇}的表面张力偏差在全摩尔组成范围内均为正值,且在xIL=0.3处出现最大值;二元混合体系{[BuPy]NO3+乙醇}和{[BuPy]NO3+正丁醇}的表面张力偏差在全摩尔组成范围内均为负值,且在xIL=0.79处出现最小值。由此可见:随着脂肪醇碳链的增长,离子液体[Bu Py]NO3和脂肪醇混合的二元体系的表面张力偏差呈现由正到负的变化趋势,这种现象与二元混合体系[EMIM][CH3SO4]和甲醇、乙醇、正丁醇的表面张力偏差随摩尔组成的变化趋势相似[6]。
表面张力偏差的拟合参数和标准偏差列于表1。
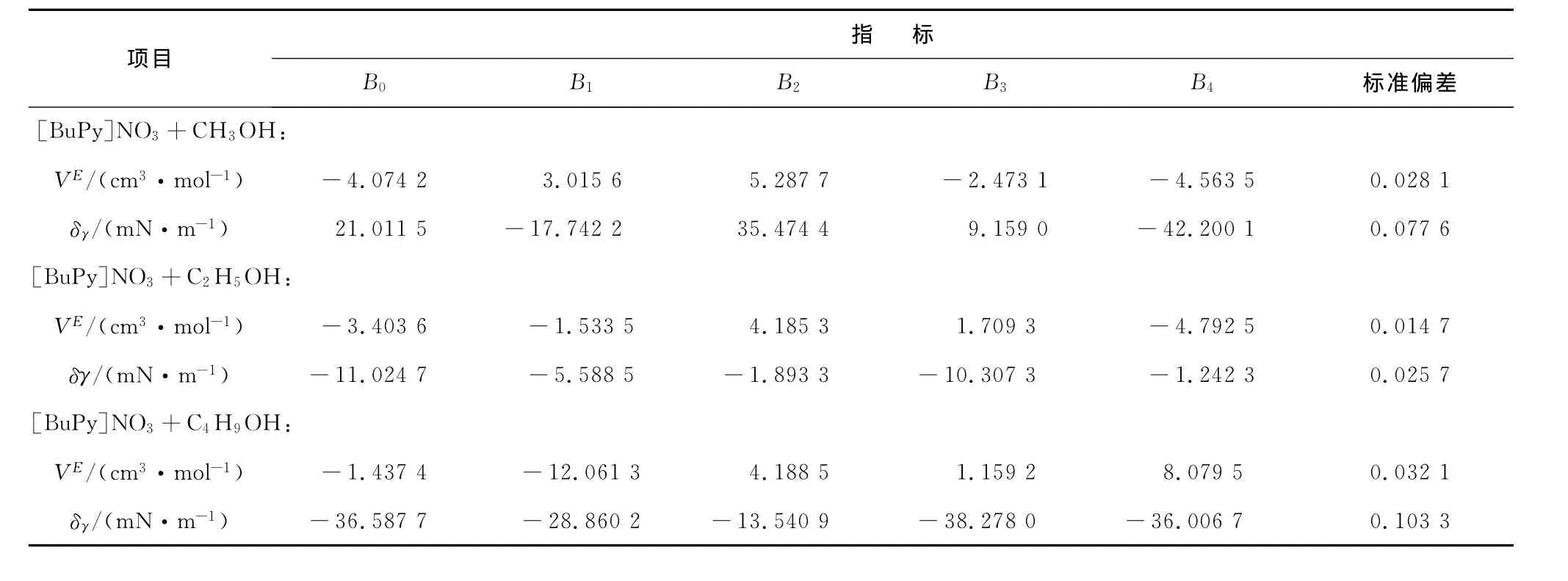
表1 T=298.15 K,[BuPy]NO3和醇二元混合体系的拟合参数和标准偏差Tab.1 Fitting parameters and root mean square deviations for binary mixture of[BuPy]NO3 and alcohol at T =298.15 K
3 结 语
二元体系[BuPy]NO3和甲醇、乙醇、正丁醇混合物的密度和表面张力随着摩尔组成的增加而增大。由密度值计算得到3个二元混合体系的超额摩尔体积V E,并用Redlich-Kister方程进行了拟合。二元混合体系{[BuPy]NO3+甲醇}和{[BuPy]NO3+乙醇}的超额摩尔体积V E在全摩尔组成范围内均为负值,{[BuPy]NO3+正丁醇}在低摩尔分数时为正值,且随着离子液体摩尔分数的增大而由正值变为负值。
二元混合体系{[BuPy]NO3+乙醇}的表面张力随着摩尔组成几乎呈线性变化。{[BuPy]NO3+甲醇}和{[BuPy]NO3+正丁醇}二元混合体系表面张力随离子液体摩尔分数的变化出现拐点。由二元混合体系的表面张力值计算得到表面张力偏差δγ,并用Redlich-Kister方程拟合。在全摩尔组成范围内,{[BuPy]NO3+甲醇}的表面张力偏差δγ为正值,{[BuPy]NO3+乙醇}和{[BuPy]NO3+正丁醇}的表面张力偏差δγ为负值。随着醇碳链的增长,表面张力偏差出现由正到负的变化趋势。
[1]ANOUTI M,VIGEANT A,JACQUEMIN J,et al.Volumetric properties,viscosity and refractive index of the protic ionic liquid,pyrrolidinium octanoate,in molecular solvents[J].J Chem Thermodynamics,2010,42(7):834-845.
[2]GARCIA-MARDONES M,PEREZ-GREGORIO V,GUERRERO H,et al.Thermodynamic study of binary mixtures containing 1-butylpyridinium tetrafluoroborate and methanol,or ethanol[J].J Chem Thermodynamics,2010,42(12):1 500-1 505.
[3]BAUDOUX J,SALIT A F,CAHARD D,et al.Ionic liquids as solvents of choice for electrophilic fluorination:fluorination of Indoles by F-TEDA-BF4[J].Tetra Lett,2002,43(37):6 573-6 574.
[4]BAR G,PARSONS A F,THOMAS C B.Manganese(Ⅲ)acetate mediated radical reactions in the presence of an ionic liquid[J].Chem Commun,2001,15:1 350-1 351.
[5]DOMANSKA U,KROLIKOWSKA M.Effect of temperature and composition on the surface tension and thermodynamic properties of binary mixtures of 1-butyl-3-methylimidazolium thiocyanate with alcohols[J].Journal of Colloid and Interface Science,2010,348(2):661-667.
[6]WANG Jian-ying,ZHAO Feng-yun,LIU Yu-min,et al.Thermophysical properties of pure 1-ethyl-3-methylimida zolium methylsulphate and its binary mixtures with alcohols[J].Fluid Phase Equilibria,2011,305(2):114-120.
[7]de CASTRO C A N,LANGA E,MORAIS A L,et al.Studies on the density,heat capacity,surface tension and infinite dilution diffusion with the ionic liquids[C4mim][NTf2],[C4mim][dca],[C2mim][EtOSO3]and[Aliquat][dca][J].Fluid Phase Equilibria,2010,294(1/2):157-179.
[8]DOMANSKA U,POBUDKOWSKA A,ROGALSKI M.Surface tension of binary mixtures of imidazolium and ammonium based ionic liquids with alcohols,or water:Cation,anion effect[J].Journal of Colloid and Interface Science,2008,322(1):342-350.
[9]ZHANG Suo-jiang,LI Xian,CHEN Hui-ping,et al.Determination of physical properties for the binary system of 1-ethyl-3-methylimidazolium tetrafluoroborate+H2O[J].J Chem Eng Data,2004,49(4):760-764.
[10]GOMEZ E,GONZALEZ B,CALVAR N,et al.Physical properties of pure 1-ethyl-3-methylimidazolium ethylsulfate and its binary mixtures with ethanol and water at several temperatures[J].J Chem Eng Data,2006,51(6):2 096-2 102.
[11]PEREIRO A B,RODRÍGUEZ A.Thermodynamic properties of ionic liquids in organic solvents from(293.15 to 303.15)K[J].J Chem Eng Data,2007,52(2):600-608.
[12]GONZALEZ E J,GONZALEZ B,CALVAR N,et al.Physical properties of binary mixtures of the ionic liquid 1-ethyl-3-methylimidazolium ethyl sulfate with several alcohols atT=(298.15,313.15,and 328.15)K and atmospheric pressure[J].J Chem Eng Data,2007,52(5):1 641-1 648.
[13]ANOUTI M,VIGEANT A,JACQUEMIN J,et al.Volumetric properties,viscosity and refractive index of the protic ionic liquid,pyrrolidinium octanoate,in molecular solvents[J].Journal of Chemical Thermodynamics,2010,42(7):834-845.
[14]ZAFARANI-MOATTAR M T,SHEKAARI H.Application of prigogine-flory-patterson theory to excess molar volume and speed of sound of 1-n-butyl-3-methylimidazolium hexafluorophosphate or 1-n-butyl-3-methylimidazolium tetrafluoroborate in methanol andacetonitrile[J].J Chem Thermodynamics,2006,38(11):1 377-1 384.
[15]魏珺芳,王延吉,励 娟,等.单分散亚微HZSM-5分子筛的制备及其环已烯水合性能[J].河北工业大学学报(Journal of Hebei University of Technology),2011,40(4):20-25.
[16]郭 斌,高 亮,段二红,等.[bmim][BF4]、[bmim][PF6]离子液体及其与DMF二元体系在293.15~353.15 K的密度和体积性质[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2012,33(2):135-141.
[17]刘宝友,王园园,魏福祥.离子液体走向工业化应用的两个重要理论问题研究[J]河北工业科技(Hebei Journal of Industrial Science and Technology),2009,26(2):124-126.
Physical and chemical properties of binary mixture ofN-butylpyridinium nitrate and alcohol
WANG Jian-ying1,LIANG Li-ya1,ZAN Hao-bo2,HU Yong-qi1
(1.College of Chemical and Pharmaceutical Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China;2.Clinical Medicine Department,Tangshan Vocational and Technical College,Tangshan Hebei 063000,China)
ionic liquid;density;surface tension;excess molar volume
O645.13
A
In this paper,MDY-2 electronic densitometer and Germany DCAT21 automatic surface tension meter are used to measure the density and surface tension over the whole concentration range(the molar fraction of ionic liquids in oganic solvents is 0~1)for the binary mixtures of ionic liquidsN-butylpyridinium nitrate([BuPy]NO3)and organic solvents such as methanol,ethanol and butanol at the temperature of 298.15 K.The excess molar volumesV Eand the surface tension deviationsδγof binary mixtures{[BuPy]NO3+CH3OH},{[BuPy]NO3+C2H5OH}and{[BuPy]NO3+C4H9OH}are determined.VEandδγare fitted by using the Redlich-Kister equation.The results show that the excess molar volumes of binary mixtures of{[BuPy]NO3+CH3OH}and{[BuPy]NO3+C2H5OH}are negative over the whole composition range,while theV Eof binary mixture{[BuPy]NO3+C4H9OH}has positive values at low molar fraction of ionic liquid,passing through a maximum and then decreases and becomes negative,showing minimum at higher ionic liquid molar fraction.The surface tension deviationsδγof{[BuPy]NO3+CH3OH}systems are positive,but those of{[BuPy]NO3+C2H5OH}and{[BuPy]NO3+C4H9OH}systemsare negative over the entire molar fraction range.It seems that surface tension deviationsδγvarys from positive to negative with the increase of alkyl chain length of alcohols.
1008-1542(2012)05-0400-06
2012-05-04;
2012-09-05;责任编辑:张士莹
国家自然科学基金资助项目(20776037);河北省自然科学基金资助项目(B2012208084)
王建英(1973-),女,河北灵寿人,副教授,博士,主要从事离子液体方面的研究。
胡永琪教授。E-mail:huyq@hebust.edu.cn
