脉络膜新生血管动物模型的研究进展
2012-12-25巴俊于靖
巴俊,于靖
(同济大学附属上海市第十人民医院眼科,上海 200072)
脉络膜新生血管(choroidal neovascularition,CNV)又名视网膜下新生血管,是来自正常脉络膜组织的增殖血管,可通过Bruch膜破损处进入Bruch膜与视网膜色素上皮层(retinal pigment epithelium,RPE)之间、视网膜神经上皮层与RPE之间、RPE与脉络膜之间。CNV是许多脉络膜视网膜疾病,如年龄相关性黄斑变性渗出期、高度近视黄斑变性等发生发展中的重要病理机制。为了进一步发现这些疾病确切的发病机理,制作接近临床特征的CNV动物模型是必要的前提。现对近年来的CNV动物模型的制作进展综述如下。
1 激光诱导CNV模型
1.1 激光诱导CNV模型的机制
血管生成是正常组织生长和修复的一种生理过程,整个过程受到维持动态平衡状态的血管生成因子和抑制因子的严密调控。当平衡遭到破坏,新生血管形成。人类CNV疾病的确切发病机制尚不明确,但是已确定与一些血管生成因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)[1]、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[2]、血小板衍生生长因子(platelet derived growth factor,PDGF)等有密切联系。脉络膜毛细血管内皮细胞、周细胞、成纤维细胞等可以释放这些细胞因子[3-4]。激光诱导CNV模型和人类CNV疾病产生的病理基础,都基于破坏RPE-Bruch膜-脉络膜毛细血管复合体,打破血管生成因子和抑制因子的平衡,产生新生血管。新生血管中包含炎症细胞、血管成分和细胞外基质,CNV的产生均来源于脉络膜血管。
与人类CNV疾病的发生机制不同的是,激光是通过对视网膜产生机械损伤、热效应和光化学等生物效应造成Bruch膜破坏,使视网膜在炎症修复过程中产生新生血管[5]。人类CNV疾病的发生包括炎症反应、血管生成和蛋白酶水解3个阶段,它们之间相互作用共同促进CNV的发生发展。在视网膜微环境发生改变的早期起始阶段,RPE和光感受器产生VEGF[6],趋化巨噬细胞集中至Bruch膜生成血管的部位[7],产生蛋白水解酶作用破坏Bruch膜,诱发形成新生血管。
1.2 制作CNV模型的常用激光
目前用于制作CNV模型的激光主要有氪激光、氩激光、二极管激光、Q-开关掺钕钇石榴石(neodymiumdoped yttrium aluminium garnet,Nd:YAG)激光等。激光波长不同,穿透深度亦不同,这对视网膜损伤的作用部位有着重要影响。蓝绿氩激光穿透力较弱,主要作用于视网膜内层和RPE层。氪激光主要作用于RPE和脉络膜内层。1979年Ryan等[8]首次采用激光制作出CNV动物模型,1998年Tobe等[9]将氪激光光凝术应用于制作小鼠CNV模型,此后激光诱导CNV模型被普遍应用于基础实验和治疗方法的研究中。激光诱导CNV模型的优点在于与人类CNV疾病发生自然过程相似,但不同研究CNV模型成功率不同,与不同实验采用动物类型、激光种类及对观察诊断CNV的标准不一有关(表1)。
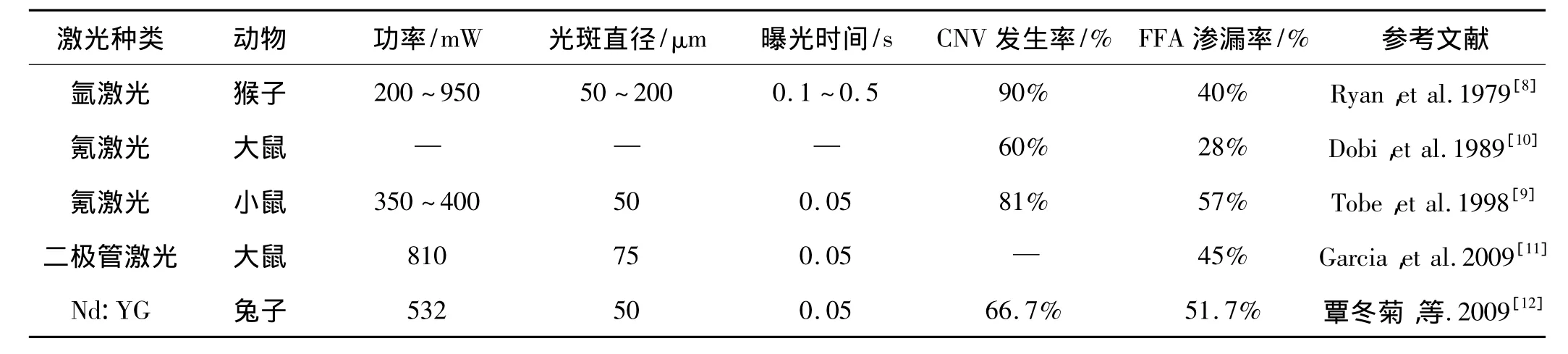
表1 激光诱导CNV实验动物模型的相关文献
1.3 实验动物
1.3.1 大鼠和小鼠 理想的动物模型应该有以下重要特征:(1)模型制作成功率高;(2)模型持续时间长且稳定;(3)病理学特征与人类CNV疾病病理改变相似;(4)模型制作成本低;(5)模型眼与人眼大小相似,便于模型实验操作与检查。激光诱导CNV的模型动物有很多种类,其中鼠类模型的应用最为广泛。鼠类模型优点在于模型制作成功率较高,价格便宜,短时间(一般2~3周)即可观察到结果。
与人类的视网膜结构相比,刚出生的幼鼠视网膜上即可见未发育成熟的透明血管,出生后的小鼠分支状透明血管排列有序[13],是研究生理性和病理性血管发生发展机制较理想的研究对象。大多数研究参与及影响CNV发生发展机制因素的实验是采用鼠类模型[14-15]。Garcia等[11]用二极管激光光凝大鼠视网膜,并在激光光凝前后分别静脉注射碘酸钠破坏视网膜形态,结果证实RPE层完整性是CNV发生的决定性因素。Nakai等[16]通过研究激光诱导小鼠基因数量性状位点,证实不同个体对细胞因子刺激生成新生血管的易感性不同。
1.3.2 兔 兔眼激光诱导模型在国内应用较为广泛,优点在于兔眼较之鼠眼在大小上更接近人类,易于模型实验操作与检查;家兔来源广泛,费用较低,CNV出现时间早且稳定(3~4周)。然而,兔眼视网膜解剖结构与人类不同,视网膜后极部相当于人类黄斑区,血管供应少,荧光素渗漏特点不典型,但可以用组织学观察结果作为CNV的判定标准。国内一项研究[12]用倍频Nd:YAG 532 nm绿激光(功率800 mW,光斑直径50 μm,曝光时间0.05 s)光凝色素兔视网膜,第3~4周见稳定的渗漏光斑,CNV发生率66.7%,渗漏率51.7%。
1.3.3 猴 猴的视网膜及黄斑结构与人类相似,眼球大小便于操作,具有荧光渗漏的特点,是用于临床药物筛选的首选模型[17]。Ryan 等[8]利用氩激光(功率200~950 mW,光斑直径50~200 μm,曝光时间0.1~0.5 s)光凝猴视网膜成功建立了CNV动物模型,但相比鼠类和家兔,CNV渗漏率较低(仅40%),且猴来源少,费用高,饲养较困难,模型制作需4周以上,因此应用受限。
2 手术诱导CNV模型
2.1 视网膜下注射VEGF基因的腺相关病毒(adeno-associated virus,AAV)载体
载有VEGF的基因转导诱导是较为理想的模型。由于炎症反应可能参与CNV的形成,需用类固醇抑制激光光凝过程中产生的炎症反应,但用注射针头经玻璃体腔破坏Bruch膜进行视网膜下AAV注射可避免实验操作中产生的炎症反应[18]。其次,人腺病毒血清5型由于其致病性低,无论是在体内或是体外的基因转导都是理想的载体。近年来,该方法多用于研究通过过表达VEGF诱导的 CNV模型制作。Wang等[18]将2 μl编码人VEGF-A165腺病毒注射到大鼠视网膜下,CNV发生率为95%。Julien等[19]在兔眼视网膜下注射5×106IU载有过表达VEGF-A165腺病毒载体诱导CNV模型,CNV发生率为83%。此外,VEGF-B是VEGF另一种分泌肽,对它在眼内的作用知之甚少。Zhong等[20]将携带VEGF-B AAV载体注射到玻璃体腔,发现VEGF-B过表达可促进病理性视网膜和脉络膜新生血管,且没有因对Bruch膜-视网膜血管屏障的破坏造成炎症。VEGF-B与糖尿病视网膜病变和年龄相关性黄斑变性的发展密切相关,提示这些疾病的并发症不依赖于炎症反应。
2.2 视网膜下注射基质胶(Matrigel)
Matrigel是一种从 EHS肿瘤(engelbreth holm swarm tumor)中提取出可溶性基底膜基质,其主要成分是层粘连蛋白、Ⅰ型胶原、肝素硫酸化黏蛋白以及一些在EHS肿瘤中自然表达的生长因子,如bFGF、胰岛素样生长因子(insulin-like growth factor,IGF)、表皮生长因子(epidermal growth factor,EGF)。Matrigel在4℃是液体,37℃时呈凝胶状态。利用此种特性在视网膜下注射Matrigel,能有效控制生长因子的缓慢释放,制作持续时间较长的CNV动物模型。Qiu等[21]在兔眼视网膜下注射Matrigel和VEGF,注射后1周眼底荧光血管造影即可在视网膜局部观察到渗漏点,渗漏量在2~4周增加,大部分可持续9周。但Julien等[19]质疑将凝胶状Matrigel注射到视网膜下,会在视网膜神经上皮层与脉络膜组织之间形成物理屏障,有悖于渗出性年龄相关性黄斑变性新生血管的发生机制。
2.3 脂质过氧化氢物
脂质过氧化氢物可以诱导血管生成因子产生CNV。随着年龄增长,人类眼后极部容易受到氧化损伤产生脂质过氧化氢物。Tamai等[22]将不同剂量(5~200 μg)亚油酸过氧化氢物(linoleic acid hydroperoxide,LHP)注射在兔眼视网膜下,发现LHP剂量不同会对视网膜会造成不同程度的损害。当注射较小剂量(12.5~25 μg)时,CNV发生率为46%。而大剂量LHP(≥100 μg)会破坏视网膜和RPE细胞,但是不产生CNV。证实高浓度LHP有显著毒性,可抑制RPE细胞吞噬LHP,并抑制其增殖产生血管生成因子。Framme 等[23]使用不同浓度 LPH(25 ng/50 ml和100 ng/50 ml)进行兔眼视网膜下注射,结果显示低浓度组没有CNV形成,高浓度组CNV发生率低,仅为27%。组织学发现视网膜外层破坏显著,但脉络膜毛细血管层结构完整。这提示高浓度的LPH对CNV的发生并没有优势,与Tamai等[22]研究结果一致。Baba等[24]在大鼠视网膜下注射小剂量(30 ng·ml-1)LHP,获得85.7%的成功率。同时,研究表明大剂量LHP对神经元、RPE和内皮细胞具有毒性,而小剂量可以促进增殖血管形成。小剂量视网膜下注射LHP在体内无毒性,且能保持视网膜组织完整性,新生血管发生过程接近人类CNV疾病的发生发展,是研究AMD发生发展机制,后续评估光动力学疗法或抗VEGF治疗的理想模型。
3 小 结
目前,CNV的动物模型建立主要是通过破坏Bruch膜或产生过量生长因子,各有优缺点,尚没有能够完全模拟人CNV发生发展的最为理想的模型。由于不同模型建立的基础和特点不同,CNV成功率和持续时间也不同,可将不同制作方法应用于不同方面的研究。
[1]侯玮玮,蒋犁,乔立兴.色素内皮生长因子、色素上皮衍生因子在酸中毒诱导的早产儿视网膜病大鼠动物模型中的表达[J].现代医学,2009,37(1):1-7.
[2]艾静,刘瑶,栾洁,等.糖基化终产物对视网膜Muller细胞表达碱性成纤维细胞生长因子的影响[J].现代医学,2008,36(2):107-110.
[3]KAMISASANUKI T,TOKUSHIQE S,TERASAKI H,et al.TargetingCD9 producesstimulus-independentantiangiogenic effects predominantly in activated endothelial cells during angiogenesis:a novel antiangiogenic therapy[J].Biochem Biophys Res Commun,2011,413(1):128-135.
[4]LOPEZ P F,SIPPY B D,LAMBERT H M,et al.Transdifferentiated retinal pigment epithelial cells are immunoreactive for vascular endothelial growth factor in surgically excised age-related macular degeneration-related choroidal neovascular membranes[J].Invest Ophthalmol Vis Sci,1996,37(5):855-868.
[5]CHAPPELOW A V,TAN K,WAHEED N K,et al.Panretinal photocoagulation for proliferative diabetic retinopathy:pattern scan laser versus argon laser[J].Am J Opthalmol,2012,153(1):137-142.
[6]NAGINENI C N,KOMMINENI V K,WILLIAM A,et al.Regulation of VEGF expression in human retinal cells by cytokines:implications for the role of inflammation in age-related macular degeneration[J].J Cell Physiol,2012,227(1):116-126.
[7]GROSSNIKLAUS H E,LING J X,WALLACE T M,et al.Macrophage and retinal pigment epithelium expression of angiogenic cytokines in choroidal neovascularization[J].Mol Vis,2002,8:119-126.
[8]RYAN S J.The development of an experimental model of subretinal neovascularization in disciform macular degeneration[J].Trans Am Ophthalmol Soc,1979,77:707-745.
[9]TOBE T,ORTEGA S,LUNA J D,et al.Targeted disruption of the FGF2 gene does not prevent choroidal neovascularization in a murine model[J].Am J Pathol,1998,153(5):1641-1646.
[10]DOBI E T,PULIAFITO C A,DESTRO M.A new model of experimental choroidal neovascularization in the rat[J].Arch Ophthalmol,1989,107:264-269.
[11] GARCIA-LAYANA A,VASQUEZ G,SALINAS-ALAMAN A,et al.Development of laser-induced choroidal neovascularization in rats after retinal damage by sodium iodate injection[J].Ophthalmic Res,2009,42(4):205-212.
[12]覃冬菊,唐罗生,刘湘平,等.激光诱导色素兔脉络膜新生血管模型[J].眼视光学杂志,2009,11(1):39-41.
[13]STAHL A,CONNOR K M,SAPIEHA P,et al.The mouse ret-ina as an angiogenesis model[J].Invest Ophthalmol Vis Sci,2010,51(6):2813-2826.
[14]KWAK N,OKAMOTO N,WOOD J M,et al.VEGF is major stimulator in model of choroidal neovascularization[J].Invest Ophthalmol Vis Sci,2000,41(10):3158-3164.
[15] SAISHIN Y,SAISHIN Y,TAKAHASHI K,et al.VEGFTRAP(R1R2)suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier[J].J Cell Physiol,2003,195(2):241-248.
[16]NAKAI K,ROGERS M S,BABA T,et al.Genetic loci that control the size of laser-induced choroidal neovascularization[J].FASEB J,2009,23(7):2235-2243.
[17]CRISWELL M H,CIULLA T A,HILL T E,et al.The squirrel monkey:characterization of a new-world primate model of experimental choroidal neovascularization and comparison with the macaque[J].Invest Ophthalmol Vis Sci 2004,45(2):625-634.
[18]WANG F,RENDAHL K G,MANNING W C,et al.AAV-medited expression of vascular endothelial growth factor induces choroidal neovascularization in rat[J].Invest Ophthalmol Vis Sci,2003,44(2):781-790.
[19]JULIEN S,KREPPEL F,BECK S,et al.A reproducible and quantifiable model of CNV induced by VEGF A165after subretinal adenoviral gene transfer in the rabbit[J].Molecular Vision,2008,14:1358-1372.
[20]ZHONG X,HUANG H,SHEN J,et al.Vascular endothelial growth factor-B gene transfer exacerbates retinal and choroidal neovascularization and vasopermeability without promoting inflammation[J].Molecular Vision,2001,17:492-507.
[21]QIU G,STEWART J M,SADDA S,et al.A new model of experimental subretinal neovascularization in the rabbit[J].Experimental Eye Research,2006,83(1):141-152.
[22]TAMAI K,SPAIDE R F,ELLIS E A,et al.Lipid hydroperoxide stimulates subretinal choroidal neovascularization in the rabbit[J].Experimental Eye Research,2002,74(2):301-308.
[23]FRAMME C,SACHS H G,KOBUCH K,et al.Clinical evaluation of experimentally induced choroidal neovascularizations in pigmented rabbits by subretinal injection of lipid hydroperoxide and consecutive preliminary photodynamic treatment with Tookad[J].Ophthalmologica,2008,222(4):254-264.
[24]BABA T,BHUTTO I A,MERQES C,et al.A rat model for choroidal neovascularization using subretinal lipid hydroperoxide injection[J].The American Journal of Pathology,2010,176(6):3058-3079.
