脂肪坏死MR表现的实验研究
2012-12-25李辉王坤俞海平王景美何健邵敏刘松余鸿鸣张顺周正扬
李辉,王坤,俞海平,王景美,何健,邵敏,刘松,余鸿鸣,张顺,周正扬,
(1.东南大学医学院,江苏南京 210009;2.南京市鼓楼医院放射科,江苏南京 210008;3.南京市鼓楼医院病理科,江苏南京 210008;4.南京市鼓楼医院 泌尿外科,江苏 南京 210008)
脂肪坏死是由于脂肪组织损伤而产生的一种少见良性非化脓性炎性病变,因其临床表现不具特征性,加之对其认识不足,临床误诊率较高[1]。如乳腺脂肪坏死易与乳腺癌相混淆[2],腹股沟脂肪坏死易与淋巴瘤相混淆[3],易导致误诊及过度治疗。有关脂肪坏死的影像学文献报道较少,且多以X线表现为主,MR方面仅见国外少数文献报道[4-5]。本研究采用射频消融技术制作猪的脂肪坏死模型,旨在探讨脂肪坏死的MR信号特点及相应的病理基础,为今后临床研究奠定基础。
1 材料与方法
1.1 实验动物及模型制作
实验用猪(约克夏)5只,猪龄56~62 d,体重15~19 kg,均为雌性。选择其项背部皮下脂肪层较厚的区域,进行多点射频干预。采用冷循环射频消融系统CC-1-220射频仪(Valleylab公司,美国),射频电极1 cm单针ACT1510(Valleylab公司,美国),穿刺深度1.5 cm,射频能量5 W,时间60 s。以病理检查结果为依据,5只实验猪共成功制作脂肪坏死模型22个。
1.2 MR扫描
采用飞利浦公司超导型Achieva 3.0T磁共振扫描仪,在造模后不同时间点(表1)对脂肪坏死区域进行MR扫描。猪左侧卧位,头先进,成像序列包括T1WI(TR 550 ms,TE 20 ms)、T2WI(TR 2 435 ms,TE 100 ms)、T2STIR(TR 4 573 ms,TE 80 ms,TI 250 ms)、磁共振灌注加权成像(perfusion weighted imaging,PWI)及T1WI增强扫描。成像方位包括轴位、矢状位及冠状位,层厚3.0 mm,层间距0.3 mm,FOV 300 mm。磁共振灌注扫描(4D_THRIVE,TR 3.1 ms,TE 1.5 ms):采用高压注射器(Spectris solaris EP,Medrad),经猪耳缘静脉内置套管针注射Gd-DTPA(钆喷酸葡胺,广州康臣),剂量 0.2 mmol·kg-1,流速 4 ml·s-1,注射时间<5 s,对比剂注射完毕,随即同速率注射等量生理盐水冲洗。灌注扫描为连续15次动态扫描,每次7.5 s,扫描时间共114.6 s。灌注扫描结束后直接行T1WI增强扫描。

表1 MR扫描时间及病理标本获取时间
1.3 图像后处理
将图像传到EWS(Extended MR Workspace)后处理工作站,由2位放射科医师分别独立观察并记录病灶形态、大小(矢状位取病灶最大层面,测量病灶最大径)、信号特征(以周围正常脂肪组织为参照)、强化程度及类型。灌注参数测量:将灌注成像序列加载入Basic T1 Perfusion软件,自动得到灌注图像。2位放射科医师分别手绘感兴趣区(ROI),ROI选择标准:在灌注图像上选择病变最大层面及强化最明显的区域(尽量避开肉眼可辨别的液化区域及病灶边缘),得到时间-信号强度曲线(time-signal intensity curve,TIC)。对不一致的分类或分型由两位医师共同商量后决定,定量数据取二者的平均值。
2 结 果
2.1 病灶形态、边缘及大小
早期(7~28 d)脂肪坏死病灶多呈边界欠清晰的圆形或类圆形,随后形态逐渐发生变化,边界逐渐清晰,2个月后病灶形态趋于稳定,60 d(中期)时病灶呈楔形8个,类圆形3个,不规则瘢痕状2个,境界清晰。病灶大小随时间延长逐渐缩小,早期改变迅速,中后期变化相对缓慢,3个月后病灶大小基本保持稳定。
2.2 MR信号特点
早期(14 d):19个病灶T1WI均呈不均匀稍低信号影,边缘可见环形低信号,6个病灶中心区域信号较均匀,13个病灶内可见点片状高信号区;T2WI均呈不均匀稍低信号;T2STIR均呈环形高信号,中心呈等或略低信号,病灶周边可见水肿。中后期:所有病灶在T1WI及T2WI上信号逐渐减低,均呈不同程度的低信号,部分病灶内见少许点片状高信号。T2STIR均呈片状较均匀高信号,周边水肿带消失。见图1、2。

图1 脂肪坏死病灶早期MRI

图2 脂肪坏死病灶中期MRI
2.3 磁共振灌注加权成像及强化特征
脂肪坏死病灶的磁共振灌注加权成像时间-信号强度曲线(TIC曲线)呈逐渐上升型(Ⅰ型),表现为曲线缓慢上升,没有明显的峰值及下降支;平台型(Ⅱ型),表现为早期较快强化到峰值后在峰值水平呈水平走势;未见速升速降型(Ⅲ型)。强化特点:所有病灶均有不同程度强化,强化类型有不规则环形强化、不均匀强化、较均匀强化;强化程度有轻度强化及中度强化,无病灶呈明显强化。见表2、3,图3~6。

表2 脂肪坏死病灶的磁共振灌注加权成像时间-信号强度曲线类型分型

表3 脂肪坏死病灶磁共振强化程度及强化类型
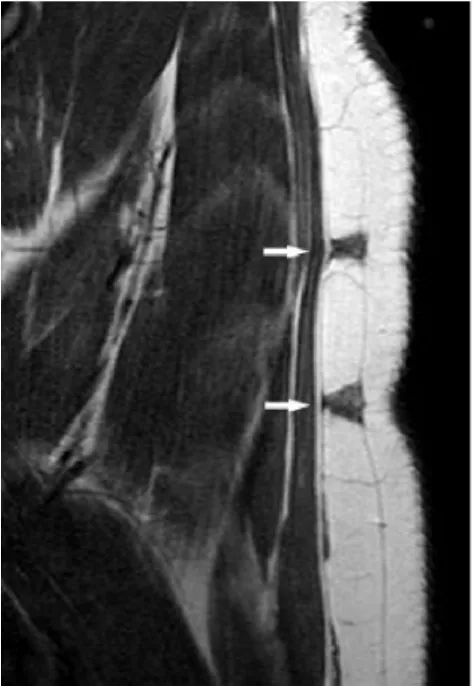
图3 造模75 d脂肪坏死病灶T1WI平扫图像

图4 与图3相同病灶T1WI增强扫描的图像

图5 造模后14 d磁共振灌注加权成像脂肪坏死病灶及其周围正常组织的TIC曲线

图6 脂肪坏死病灶TIC曲线
2.4 病理表现
造模约1周以后,肉眼见脂肪组织内形成一圆形或椭圆形硬块,可见较模糊的界限,切面呈灰黄色,见液化腔,内含脂肪液化后的油状物,病灶边缘呈环形浅红色,可见出血灶。中晚期病灶(45 d以后)边界清晰,呈质地较均匀浅红色实质性结节。镜检早期病变边缘主要是由纤维母细胞、较多吞噬脂质的泡沫细胞及混合性炎症细胞组成,可有含铁血黄素细胞,其内脂肪细胞崩解破裂,残存大小不等的空泡状轮廓,并可形成红染无结构的油膜状物。随病程延长,炎症反应逐渐消退,中后期纤维组织明显增生,形成有明显界限的结节状或星状瘢痕,此时镜检,纤维成分为主,部分病灶内仍可见留有少许含有油样物的空泡。见图7、8。

图7 造模后45 d脂肪坏死病灶手术切除后的病理图片(HE染色 ×40)
3 讨 论

图8 图7局部放大图(HE染色 ×200)
脂肪坏死是一种特殊类型的坏死,往往和各种原因所致的脂肪损伤有关,如放疗、射频治疗、肌肉注射、手术、外伤、自身免疫性疾病等[6],还有可能和寒冷、糖尿病、结核性血管炎有关,无明确诱因病例也不为少数。脂肪坏死在全身各部位均可发生,多见于脂肪较丰富的区域,最常见于乳房[7],特别是乳房重建术后脂肪坏死的发生率达12% ~35%[8];其次好发于四肢或臀背部[5]。其临床症状不具特征性,因此诊断困难,极易误诊。
关于脂肪坏死的MR表现,文献报道较少。目前普遍认为,脂肪坏死的影像学表现与其病理基础密切相关。Ganau等[9]将脂肪坏死分成4期,分别是超急性炎性期、急性炎性期、脂质囊肿期、异物或炎性肉芽肿期,随着时间的推移、病情发展,其病理改变不一,病灶中坏死液化的程度、是否伴有出血、肉芽组织的含量、是否有囊腔形成、囊腔内容物的成分、纤维增生充填的程度及是否出现钙化等是构成影像学表现的物理学基础。以本研究病理表现为基础,笔者将本研究中的脂肪坏死病灶病程发展分成3期:早期,病理表现主要以吞噬细胞及混合炎症细胞增生为主;中期,病灶边缘肉芽肿组织及纤维成分明显增多,但病灶中心还残留有较多皂泡样坏死脂肪组织;后期,纤维组织明显增生,形成界限清晰的结节状或星状的瘢痕组织,吞噬细胞及皂泡样脂滴基本消失。3期之间没有绝对的时间界限,病理表现相互可能有重叠,我们分期的目的是方便对其病程发展过程中不同时间各种MR表现的阐述。
本研究中脂肪坏死病灶模型体积均随时间推移逐渐减小,早期病灶变化较为明显,而中后期病灶形态体积变化相对缓慢,病灶各径线逐渐趋于稳定。在脂肪坏死与乳腺癌的鉴别上,如果影像学上随访观察到未经治疗的病灶体积缩小,则高度提示为脂肪坏死病变[7]。
本研究结果显示,脂肪坏死病灶早期在T1WI及T2WI呈等或稍低信号,随时间延长病灶信号逐渐减低,后期病灶均呈不同程度低信号,T1WI部分病灶内可见点片状高信号,分析原因可能是由于其中微小的出血灶、炎症反应所致,也有一部分点状高信号在压脂相呈低信号,我们认为是残余的未完全坏死的脂肪组织;不同时期,所有病灶在T2STIR均呈高信号。Chala等[10]报道,脂肪坏死在T1WI上可呈高信号、等信号或低信号,这取决于脂肪坏死的病理学分期及病灶内纤维组织的多少。
关于脂肪坏死的强化程度及类型,文献报道各异。Pierce等[11]认为,术后发生的脂肪坏死病灶多无明显强化。也有文献[12-14]报道脂肪坏死在对比剂注射后30 s会发生早期强化。关于脂肪坏死的强化类型,文献[10,12,15]报道有弥漫性或局灶性,均匀性或不均匀性,且局灶性强化多呈环形或周围强化。本研究结果显示,脂肪坏死病灶早期多呈环形强化,中心无明显强化,中后期的强化为均匀或不均匀轻中度强化。据此我们认为脂肪坏死的强化特征与其病程长短有关。从病理学方面分析原因,脂肪坏死病灶在发展过程中,早期病灶周围炎症细胞浸润,大量组织细胞增生,新生小血管生成,所以注射对比剂后呈不规则周围环形强化,而中央区是一些坏死液化的脂肪细胞(油脂),所以无明显强化。随着炎症反应的消退,病灶纤维化程度增多,病灶逐渐转变为均匀或不均匀轻中度强化。
磁共振灌注加权成像是通过采集组织动态强化的图像,半定量分析组织毛细血管血流灌注情况,间接评估局部的组织活力及功能。各种病灶的生长及转移的先决条件是新生血管的生成,它反映病灶的生物学行为与特点[16]。既往研究发现,各种病灶的TIC曲线形态基本分为三型:Ⅰ型,逐渐上升型,表现为曲线缓慢上升,没有明显的峰值及下降支;Ⅱ型,平台型,表现为早期较快强化到峰值后在峰值水平呈水平走势;Ⅲ型,早期快速强化后信号强度随即下降(或上升),然后出现平台期[17]。目前,普遍认为“速升速降”型(Ⅲ型)曲线多为恶性病变,鉴别良、恶性淋巴结病变具有一定的特异性。关于脂肪坏死的磁共振灌注成像特征,文献报道较少,且观点不尽相同。Solomon等[12]认为,在灌注的强化类型(时间-信号曲线)方面与恶性病变可能存在相似性。但 Coady等[18]及 Whitehouse 等[19]认为,脂肪坏死病灶呈边缘毛刺状的环形强化或弥漫性的早期强化,但是没有明显流入流出型TIC曲线。本组结果显示,通过灌注扫描得到的3期脂肪坏死的TIC曲线有逐渐上升型和平台型,没有病灶表现为速升速降型,这与 Coady 等[18]及 Whitehouse 等[19]观点一致。本研究所获得的TIC曲线包含快速上升段、缓慢上升段及平台段,可反映对比剂进入病变血管、由血管内向组织间隙扩散及分布的情况。脂肪坏死病灶的早期,炎症反应较重,病变内丰富且发育良好的微血管挤压了周围组织,延缓了对比剂的流出,所以多呈现出平台型的TIC曲线;而后期,炎症静止或消退,纤维组织形成,病变内血流明显减少,对比剂进入少且缓慢,所以多呈现出逐渐上升型的TIC曲线。
综上所述,脂肪坏死的MR表现具有一定的特征性,并在一定程度上反映了其病理特征,分析其MR增强表现及TIC曲线类型有助于对此病变的定性诊断。随着MR的不断普及和MR功能成像的广泛应用,对脂肪坏死MR表现特点必将积累更多经验,有效提高诊断正确率,避免给此类患者带来不必要的手术治疗及心理负担。
[1]CLARE S E,MORROW M.Management of the palpable breast mass.[M]//HARRIS J R,LIPPMAN M E,MORROW M,et al.Diseases of the breast.2nd ed.Philadelphia:Lippincott,Williams and Wilkins,2000:37-45.
[2] BILGEN I G,USTUN E E,MEMIS A.Fat necrosis of the breast:clinical,mammographic and sonographic features[J].Eur J Radiol,2001,39:92-99.
[3]BELAKHLEF A,JANI C,CHURCH C et al.Fat necrosis mimicking B-cell lymphoma A PET/CT and FDG study[J].Clinical Nuclear Medicine,2008,33(4):271-272.
[4]BAKLLIE M,MOK P M.Fat necrosis in the breast:review of the mammographic and ultrasound features,and a strategy for management[J].Australasian Radiology,2004,48:288-295.
[5]PHILIP R,JOANNA M,GRANINNE B,et al.Ultrasound and MRI findings in appendicular and truncal fat necrosis[J].Skeletal Radiol,2008,37:217-224.
[6]徐晓明,郑传斐,刘兴本,等.创伤性脂肪坏死法医学鉴定1例[J].法医学杂志,2010,26(3):237-238.
[7]臧晓红,郑建勋,赵小华,等.脂肪坏死的声像图表现[J].中国医学影像技术,2006,16(7):592-593.
[8]ROSEN P P.Inflammatory and reactive tumors.[M]//ROSEN P P.Rosen's breast pathology.Philadelphia:Lippincot-Raven,1997:23-56.
[9]GANAU S,TORTAJADA L,ESCRIBANO F,et al.The great mimicker:fat necrosis of the breast—magnetic resonance mammography approach[J].Curr Probl Diagn Radiol,2009,July/August:189-197.
[10]CHALA L F,BARROS N D,CAMARGO P D,et al.Fat necrosis of the breast:mammographic,sonographic,computed tomography,and magnetic resonance imaging findings[J].Curr Probl Diagn Radiol,2004,33:106-126.
[11]PIERCE W,HARMAS S,FLAMIG D,et al.Three-dimensional gadolinium-enhanced MR imaging of the breast:pulse sequence with fat suppression and magnetization transfer contrast[J].Radiology,1991,181:757-767.
[12]SOLOMON B,OREL S,REYNOLDS C,et al.Delayed development of enhancement in fat necrosis after breast conservation therapy:a potential pitfall of MR imaging of the breast[J].AJR,1998,170:966-968.
[13]COHEN E K,LEONHARDT C M,SHUMAK R S,et al.Magnetic resonance imaging in potential postsurgical recurrence of breast cancer:pitfalls and limitations[J].Can Assoc Radiol J,1996,47:171-176.
[14]GILLES R,GUINEBRETIIERE J M,SHAPEERO L G,et al.Assessment of breast cancer recurrence with contrast-enhanced subtraction MR imaging:preliminary result in 26 patients[J].Radiology,1993,188:473-478.
[15]TAKAHIRO K,NAOBUMI Y,JUN Y,et al.Fat necrosis of breast:a potential pitfall in breast MRI[J].Journal of Clinical Imaging,2002,26:250-253.
[16]徐秋贞,腾皋军,储成凤,等.64排CT体部肿瘤灌注成像的初步临床研究[J].东南大学学报:医学版,2007,26(6):440-442.
[17]PAULSON E S,SCHMAINDA K M.Comparison of dynamic susceptibility-weighted contrast-enhanced MR methods:recommen-dations for measuring relative cerebral blood volume in brain tumors[J].Radiology,2008,249(2):601-613.
[18]COADY A,MUSSURAKIS S,OWEN A,et al.Case report:MR imaging of fat necrosis of the breast associated with lipid cyst formation following conservative treatment for breast carcinoma[J].Clin Radiol,1996,51:815-817.
[19]WHITEHOUSE G H,MOORE N R.MR imaging of the breast after surgery for breast cancer[J].Magn Reson Imaging Clin North Am,1994,2:591-603.
