根细胞壁及其组分差异对植物吸附、转运Zn的影响
2012-12-25陈世宝中国农业科学院农业资源与农业区划研究所农业部植物营养与施肥重点实验室北京100081
陈世宝,孙 聪,魏 威,林 蕾,王 萌 (中国农业科学院农业资源与农业区划研究所,农业部植物营养与施肥重点实验室,北京 100081)
根细胞壁及其组分差异对植物吸附、转运Zn的影响
陈世宝*,孙 聪,魏 威,林 蕾,王 萌 (中国农业科学院农业资源与农业区划研究所,农业部植物营养与施肥重点实验室,北京 100081)
采用水培实验,研究了不同植物根细胞壁组分差异对Zn吸收、转运的影响及其机制.结果表明,在50mg/LZn处理下,不同植物对Zn的吸收、转运系数顺序为:小白菜≈芥菜≈生菜>青椒>西红柿>水稻,而在20mg/L Zn处理下,生菜茎叶中Zn的转运系数则大于芥菜,这可能与低浓度条件下Zn对生菜产生的低剂量刺激效应有关;利用植物活体根细胞解吸法对不同植物活体根系细胞壁中的Zn含量测定结果表明,不同植物的根细胞壁在去除了果胶成分后,根细胞壁中 Zn的含量显著增加,其中水稻根细胞壁增加最大,达到 53.7%,增加最小的是青椒(21.1%),而去除半纤维素后则显著降低了不同植物根细胞壁中Zn的含量,尤其是水稻根细胞壁最明显;吸附动力学实验表明,不同处理后的细胞壁对Zn的吸附是个快速反应过程,在吸附30min内所有处理均达到最大吸附量的91%以上,去除果胶显著增加不同细胞壁对Zn的吸附量,而进一步去除半纤维素后,不同细胞壁对 Zn的最大吸附量显著下降.以上结果表明,半纤维素含量的增加明显提高了不同植物根束缚Zn的能力而降低向地上部的运输.
锌;植物;细胞壁;转移系数;吸附动力学
根细胞壁是重金属进入植物体进行吸收、转运的第一道屏障.研究重金属在不同植物根系中的细胞、亚细胞分布规律对重金属在木质部转运的影响,对探明不同植物对重金属污染胁迫的耐性机制具有十分重要的意义[1].植物根细胞壁可分为初生细胞壁和次生细胞壁,初生细胞壁主要由纤维素、半纤维素、果胶以及蛋白质等组成[2-3].纤维素和半纤维素是细胞壁中主要的结构性多糖,起到维持细胞形状以及膨压的作用[3].目前,不同植物根系细胞壁对不同重金属的累积虽然已有较多报道[1,4-10],但在细胞壁对重金属的吸附研究中,不同植物的细胞壁组分构成及其对重金属吸附或络合等过程的贡献及其机制还有待进一步阐明.本文在前期不同种类植物对 Zn吸收敏感性筛选研究的基础上,对不同植物根细胞壁组成与Zn的吸收、转运间的耦合关系进行了研究,以期为探明不同植物对Zn胁迫的耐性机制提供理论依据.
1 材料与方法
1.1 供试植物
供试植物选择了本课题组前期[11]Zn毒性敏感性不同的植物类型共计 6种.具体包括:芥菜(Brassica campestris L.)、生菜(Lactuca sativa)、小白菜(Brassica chinensis L.)、青椒(Capsicum frutescens)、西红柿(Lycopersicon esculentum)以及水稻(Oryza sativa).
1.2 实验处理
将不同植物种子在10% (V/V) H2O2中表面消毒10min后,冲洗干净,以去离子水浸泡12h,取出种子放于润湿的纱布中直到种子露白,挑选出大小一致的种子播种于石英砂的塑料杯中,每盆中放置10棵种子放置于生长箱,生长箱的光照时间保持在14h,光强度约为280μmol/(m2×s),相对湿度保持在80%,昼夜温度保持在20~25℃.生长期间,定期补充营养液[9],并采用称重法维持培养基质固定的含水量,置于生长箱中培养14d.
试验 1:不同植物对 Zn吸收、转运的影响.生长箱中培养14d后,挑选生长一致的不同植株12棵转移到含有 Zn浓度分别为 0(CK),20, 50mg/L的1/4强度的Hoagland营养液的PVC培养筒(直径8.0cm,高15cm)中,每个培养筒3株植物,每个处理4次重复,以2.0mmol/L的2-吗啉乙磺酸缓冲液(MES)调节溶液pH6.0.营养液每2周更换一次,置于生长箱进行培养.在培养期间每隔3d更换一次营养液.28 d培养结束后,将植株取出并以去离子水冲洗干净后,分开地上部分以及地下部分,地上部分经过清洗、70℃烘干后消化测定其 Zn含量;将地下部分先经过去离子水冲洗,然后以25mL的10mmol/L EDTA溶液浸泡5min,以去除根表吸附的 Zn,然后再将根用去离子水冲洗干净,经过 70℃烘干后,经过消化以(石墨)原子吸收光谱法(F-AAS; Varian 220Z)测定植株地上和根中Zn的含量.
试验2:不同植物根细胞壁组分提取及对Zn吸收、转运的影响.挑选生长一致的不同植株12棵转移到含有Zn浓度分别为0(CK),20,50mg/L的1/4强度的Hoagland营养液中培养,除了细胞壁成分提取需要将CK设置8个重复外,其他Zn的暴露试验与试验1相同.试验结束后,将收获不同植物根系收获后于液氮中研磨至粉末状,按照Zhong等[12]的方法提取根系细胞壁.将根系粉末置于50mL离心管中以 75%冰乙醇冲洗15min后,10000r/min离心15min,并分别以冰丙酮、冰甲醇/氯仿混合物(1:1,V/V)及冰甲醇冲洗、10000r/min离心 15min,将沉淀冷冻干燥,即为根细胞壁.不同细胞壁组分中 Zn含量测定:将0.200g根细胞壁粉末置于 10mL 0.5%草酸铵缓冲液,在80℃水浴中振荡30min后,10000r/min离心 15min,上清液即为果胶;将沉淀用去离子水冲洗后冷冻干燥,用4mL 4% NaOH于室温下振荡离心(10000r/min),上清液即为半纤维素.经过消化以(石墨)原子吸收光谱法测定不同处理细胞壁中Zn的含量.
1.3 细胞壁及其组分对Zn的吸附
按照试验步骤 2,提取试验 2中不同植物对照处理中不同植物的根细胞壁组分,包括细胞壁、去除果胶后细胞壁及去除半纤维素的细胞壁成分.向250mL离心管中加入0.50g不同细胞壁组分,然后向每个离心管中加入 200mL浓度为200mg/L的Zn溶液(以ZnSO4·7H2O配制).处理液的离子强度采用0.1mmol/L KNO3维持,pH值以0.1mol/L的HNO3/KOH维持在6.0.将上述溶液置于25℃水浴中恒温振荡,并分别于1, 5, 10, 15, 30, 45, 60, 90, 120min取8mL悬浊液离心(10000r/min),以(石墨)原子吸收光谱法测定平衡液中Zn的浓度.
1.4 数据统计
所有实验数据均采用 Excel2007和SPSS13.0分析软件进行处理,LSD法检测差异显著性(P<0.05).实验结果以各个处理下 4个重复的平均值±标准误来表示.
2 结果与讨论
2.1 不同植物对Zn的吸收、转运系数
从图1中可以看出,在2种不同添加Zn浓度条件下,不同植株根及茎叶中 Zn的浓度有显著性的差异(P<0.05),根及茎叶中Zn的浓度随着培液中 Zn浓度的增加而增加.其中,在高浓度(50 mg/L)处理条件下,不同植物茎叶中Zn的浓度顺序为:小白菜≈生菜>芥菜>青椒>西红柿>水稻,而在低浓度(20 mg/L)处理下,顺序则表现为小白菜>青椒>生菜≈芥菜≈西红柿>水稻.
从图1B中可以看出,和植株茎叶中Zn含量变化趋势一样,随着水培液中Zn浓度的增加,根系中的Zn含量显著增加 (P<0.05).在高浓度(50mg/L)处理条件下,不同植物根中Zn的浓度顺序为:水稻>生菜≈青椒≈芥菜>西红柿≈小白菜,相对于高浓度处理而言,低浓度(20mg/L)处理下不同植株根中Zn的浓度变化差异不大,Zn的浓度顺序为青椒≈小白菜≈芥菜>西红柿>生菜≈水稻.
植物地上茎叶与根部重金属含量的比值称为重金属的转移系数(TF).转移系数常被用来衡量不同植物体对重金属从根部到地上部的有效转移程度.转移系数越大,植物对重金属的转运能力越强.植物对重金属的吸收、转运不仅与重金属的元素种类、离子价态及重金属在环境中共存离子的浓度等有关,而且与植物种类有十分重要关系[13-14],植物根细胞壁组成不同,对重金属离子在植物体内的向地上部分的转运能力也有很大差异[4,12].从表 1可以看出,在相同 Zn处理浓度条件下,不同植物茎叶对Zn的转运系数有显著性差异,在较低浓度20mg/L处理下,植物对 Zn的转运系数变化为0.14~0.49,小白菜>生菜≈芥菜≈青椒≈西红柿>水稻,而在高浓度50mg/L处理下,小白菜≈芥菜≈生菜>青椒>西红柿>水稻.不同处理浓度条件下转运系数的变化可能与不同植物在低浓度20(mg/L)条件下对Zn的刺激效应有关[15].从表1还可以发现,除对照处理外,在不同Zn处理浓度间,随着处理浓度的增加,不同植物对 Zn转运系数有降低的趋势.
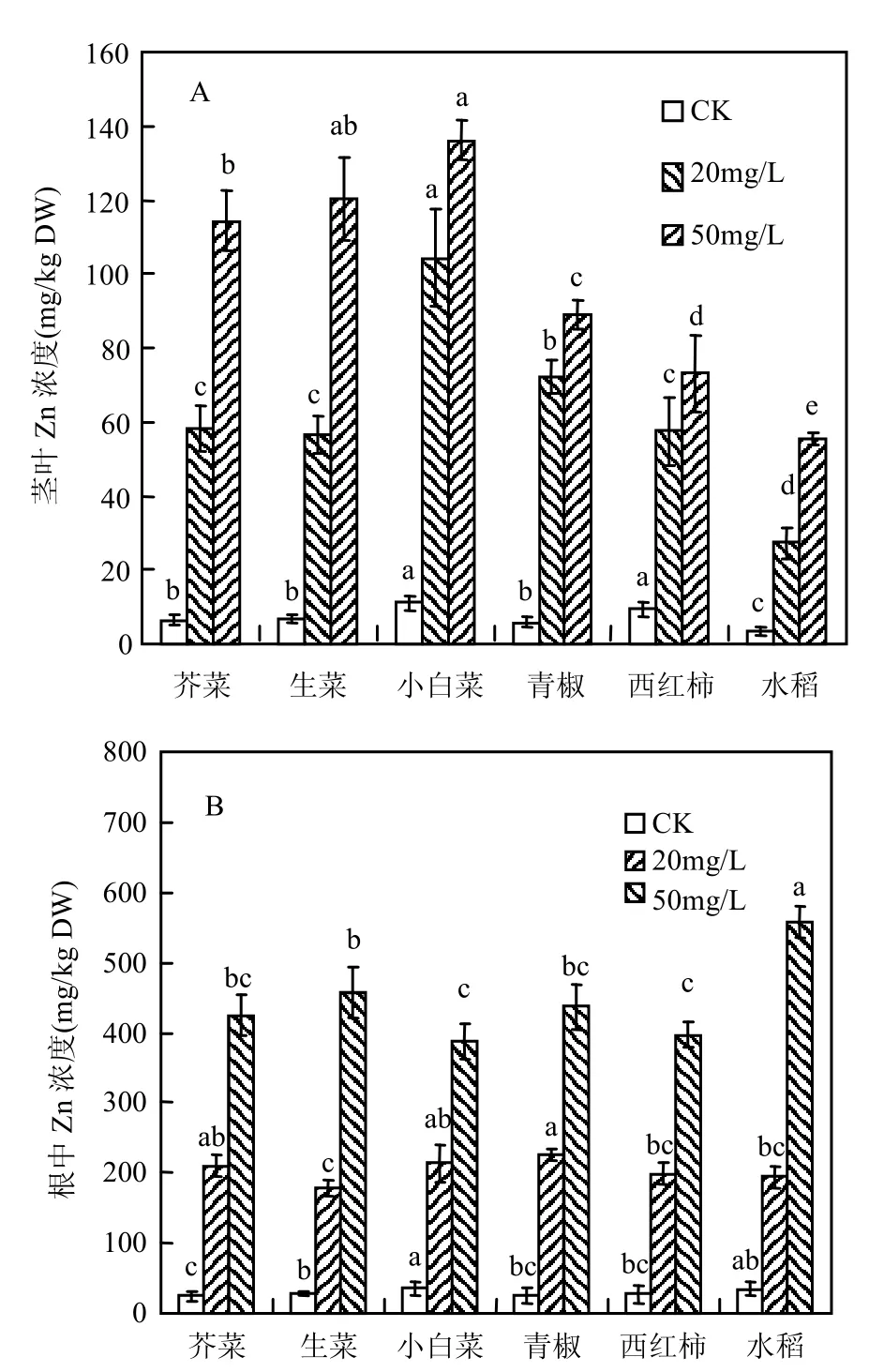
图1 水培条件下不同植物根、茎叶中Zn的含量Fig.1 Zn content in the shoots and roots of plant species under hydroponic culture

表1 不同植物在水培条件下对Zn的转移系数Table 1 Transfer factors of Zn by plant species under hydroponic culture
2.2 不同根细胞壁组分中 Zn的含量及其与植物Zn吸收的关系
细胞壁是重金属进入植物原生质体的第一道屏障,细胞壁对于重金属离子的络合能力大小对植物重金属胁迫的耐性机制有非常重要的作用[4,16].为了测定不同植物根细胞壁在水培条件下对Zn的络合性质的差异,本试验采用植物活体根细胞解吸的方法[3],测定不同植物活体根系细胞壁中的Zn含量,以期为探明不同植物对 Zn胁迫的耐性机制提供依据.在50mg/L处理下,不同植物根细胞壁及其不同细胞壁组分中Zn的含量见表2(20mg/L处理的结果与 50mg/L结果类似,此处省略).实验结果表明,不同植物细胞壁中Zn的含量随着Zn处理浓度的增加而显著增加(P<0.05);不同植物根系细胞壁中Zn的含量有显著性差异,最大含量达到 436.9mg/(kg FW),与最小含量[237mg/ (kg FW)]相差1.84倍.
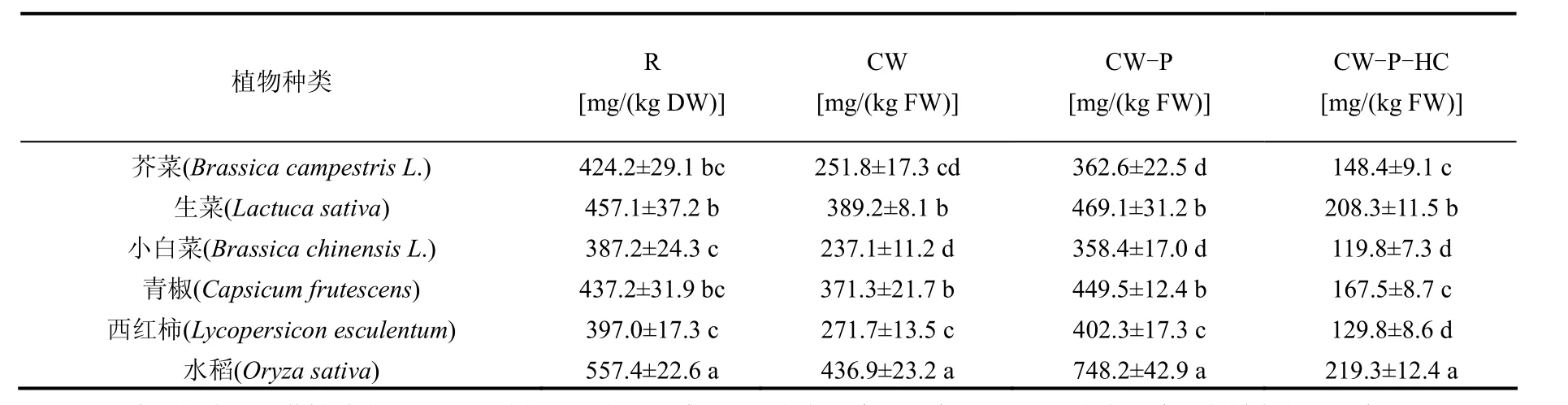
表2 在50mg/L Zn处理下根及不同细胞壁组分中Zn的含量Table 2 The Zn binding-capacity of different parts of roots under 50mg/L Zn treatments
本实验中,由于测定方法的不同,细胞壁和根系中Zn的含量分别以鲜重和烘干重作为基重,从细胞壁所结合的Zn含量占在根系吸收Zn含量的百分数变化可以看出,不同植物细胞壁所结合的Zn含量(鲜重基数)占在根系吸收Zn含量(干重基数)的百分数变化从 59.2%(芥菜)到 87.3%(水稻),这反映了不同植物根细胞壁是植物根系重金属的主要积累部位,植物可以通过将Zn固定在细胞壁内减轻Zn对植物的损伤,通过增加细胞壁中Zn的浓度,降低了Zn向原生质体的转运,从而能增加植物对Zn毒害的耐性.为了进一步探明不同植物根细胞壁在植物Zn吸收差异性机制,对不同植物根细胞壁组分在细胞壁络合 Zn中的作用进行了研究.不同植物根细胞壁去除果胶及果胶(P)、半纤维素(HC)后Zn的含量见表2.结果发现,不同植物的根细胞壁在去除了果胶成分后,细胞壁中Zn的含量显著增加,增加 21.1%~53.7%,增加最大的是水稻处理,而最小的是青椒;进一步去除半纤维素后,细胞壁中 Zn的含量则显著下降(表 2),降低40.8%~55.0%,降低最大的是水稻处理,而最小的是芥菜.Zn在植物根细胞壁中的亚细胞分布与Zn对各个细胞器的毒性有直接关系.细胞壁中有很多负电基团可以对带正电荷的重金属离子(Zn)起到络合、固定作用[18],而根细胞壁对于Zn的络合作用对降低其跨膜运输、减轻Zn胁迫起到了非常关键的作用.从表 2可以看出,不同植物细胞壁中半纤维素的含量对根细胞壁中 Zn的含量具有显著的影响,以上结果表明,半纤维素含量的增加明显提高了不同植物根束缚Zn的能力而降低Zn向地上部的运输.

图2 根细胞壁及其不同组分对Zn吸附的影响Fig.2 Effects of the root cell walls and its’ components on Zn adsorption under 200mg/L Zn treatment
2.3 不同植物根细胞壁组分对Zn的吸附
细胞壁由纤维素/半纤维素、果胶以及蛋白质等多种组分组成,所以细胞壁对 Zn的吸附能力也必然要受到细胞壁各个组成成分的影响.不同处理后(去除果胶及同时去除果胶和半纤维素处理)的植物细胞壁组分在等温条件下 Zn的吸附拟合曲线见图2所示,从图2中可以看出,不同处理后的根系细胞壁及其组分对溶液中Zn的吸附是一个由快速吸附过程和接近最大吸附量的吸附“平台”过程组成.在吸附30min后,不同植物不同处理的细胞壁成分对Zn的吸附基本达到了“平台”阶段,对溶液中Zn的吸附量达到最大量的91%以上.
从图2中还可以看出,就相同植物的不同处理的细胞壁成分间,去除果胶后的细胞壁对 Zn的吸附量最大,其次是原细胞壁和去除果胶和半纤维素成分后的细胞壁.而在不同植物的细胞壁及其不同处理的细胞壁成分中,不同处理对 Zn的吸附量之间存在显著性差异(P<0.05).就原细胞壁成分而言,在测定时间内,水稻根细胞壁对Zn的吸附量最大,达到 33.7mg/g,芥菜根细胞壁吸附量最小(18.1 mg/g),与 2种植物根细胞壁中Zn的含量变化趋势一致;而去除果胶成分后,显著提高了不同植物根细胞壁对 Zn的吸附能力.在去除果胶后细胞壁对 Zn的吸附量中,水稻根细胞壁处理吸附量最大,达到69.2mg/g,而芥菜吸附量最小(27.1mg/g),对Zn吸附量大小的顺序为:水稻>生菜>青椒>西红柿>小白菜>芥菜.不同植物细胞壁同时去除果胶和半纤维素后,细胞壁对Zn的吸附量却显著降低,与去除果胶后的细胞壁Zn吸附相比,水稻根细胞壁去除果胶和半纤维素后对 Zn最大吸附量降低幅度最大,达到 56.5%,其次分别为西红柿>小白菜>青椒>生菜>芥菜.比较细胞壁去除果胶后对Zn的吸附和细胞壁去除果胶和半纤维素后的吸附拟合曲线发现,半纤维素对细胞壁吸附 Zn的影响很大,特别是对于水稻根细胞壁而言,去除半纤维素后大大降低了根系细胞壁对 Zn的吸附能力,这说明半纤维素是植物细胞壁固定 Zn的重要部位,这也和前期类似的研究结果[4,19-21]一致,细胞基质中的半纤维素是阳离子结合的主要位点.
3 结论
3.1 水培实验结果表明,在高浓度(50mg/L)Zn处理下,不同植物对Zn的吸收、转运系数顺序为:小白菜≈芥菜≈生菜>青椒>西红柿>水稻,而在低浓度处理下,生菜茎叶中 Zn的转运系数则大于芥菜,这可能与低浓度条件下 Zn对生菜产生的低剂量刺激效应有关.
3.2 不同植物的根细胞壁在去除了果胶成分后,根细胞壁中 Zn的含量显著增加,其中,水稻根细胞壁的处理增加最大,达到 53.7%,增加最小的是青椒根细胞壁处理(21.1%);而去除半纤维素后则显著降低了不同植物根细胞壁中Zn的含量.
3.3 利用不同根细胞壁及其去除果胶、果胶和半纤维素后对 Zn的吸附结果发现,去除半纤维素后大大降低了不同植物根细胞壁对Zn的吸持能力,尤其是水稻根细胞壁最明显.细胞壁中半纤维素的含量对根束缚Zn离子从而阻止向地上部的运输具有十分重要的意义.
[1] Zhang J, Duan G L. Genotypic difference in arsenic and cadmium accumulation by rice seedlings grown in hydroponics [J]. Journal of Plant Nutrition, 2008,31:2168-2182.
[2] Li Y H, Qian Q, Zhou Y H, et al. BRITTLE CULM1,which encodes a COBRA-like protein, affects the mechanical properties of rice plants [J]. The Plant Cell, 2003,15: 2020-2031.
[3] Carpita N C M, Defernez K, Findlay B, et al. Cell wall architecture of the elongating maize coleoptile [J]. Plant Physiol., 2001,127:551-565.
[4] Zhang X H, Lin A J, Gao Y L, et al. Arbuscular mycorrhizal colonisation increases copper binding capacity of root cell walls of Oryza sativa L. and reduces copper uptake [J]. Soil Biology and Biochemistry, 2009,41(5):930-935.
[5] Bueno B Y M, Torem M L, Molina F, et al. Biosorption of lead(II), chromium(III) and copper(II) by R. opacus: equilibrium and kinetic studies [J]. Minerals Engineering, 2008,21:65-75.
[6] Kim D Y, Lucien B, Masayoshi M, et al. The ABC transporter AtPDR8 is a cadmium extrusion pump conferring heavy metal resistance [J]. The Plant Journal, 2007,50:207-218.
[7] Abedin M J M, Cresser S, Meharg A A, et al. Arsenic accumulation and metabolism in rice (Oryza sativa L.) [J]. Environmental Science and Technology, 2002,36:962-968.
[8] 黄 艺,陶 澍.污染条件下VAM玉米元素积累和分布与根际重金属形态变化的关系 [J]. 应用生态学报, 2002,13(7): 859-862.
[9] 叶林春,张青松,蒋小军,等.矿区植物假繁缕对铅、锌积累特性的研究 [J]. 中国环境科学, 2010,30(2):239-245.
[10] 徐明岗,纳明亮,张建新,等.红壤中 Cu、Zn、Pb 污染对蔬菜根伸长的抑制效应 [J]. 中国环境科学, 2008,28(2): 153-157.
[11] 魏 威,梁东丽,陈世宝.不同土壤中外源锌植物毒性的物种敏感性分布研究 [J]. 生态学杂志, 2012,31(3):538-543.
[12] Zhong H, Lauchli A. Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity [J]. Journal of Experimental Botany, 1993,44:773-778.
[13] 李 鸣,吴结春,李丽琴.鄱阳湖湿地22种植物重金属富集能力分析 [J]. 农业环境科学学报, 2008,27(6):2413-2418.
[14] 崔 爽,周启星,晁 雷.某冶炼厂周围8种植物对重金属的吸收与富集作用 [J]. 应用生态学报, 2006,17(3):512-515.
[15] Li B, Zhang X, Wang X D, et al. Refining a biotic ligand model for nickel toxicity to barley root elongation in solution culture [J]. Ecotoxicol. Environ. Saf., 2009,72:1760-1766.
[16] Zhang Y X, Chai T Y, Gérard B. Research advances on the mechanisms of heavy metal tolerance in plants [J]. Acta Botanica Sinica, 1999, 41(5):453-457.
[17] Vargaa A, Za´raya G, Fodor F. Determination of element distribution between the symplasm and apoplasm of cucumber plant parts by total reflection X-ray fluorescence spectrometry [J]. Journal of Inorganic Biochemistry, 2002,89:149-154.
[18] Vivas A, Vörös A, Barea J M, et al. Beneficial effects of indigenous Cd-tolerant and Cd-sensitive Glomus mosseae associated with a Cd-adapted strain of Brevibacillus sp. in improving plant tolerance to Cd contamination [J]. Applied Soil Ecology, 2003,24:177-186.
[19] Zheng S J, Lin X Y, Yang J L, et al. The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant (Triticum aestivum L.) cultivar [J]. Plant and Soil, 2004, 261:85-90.
[20] MacFarlane G R, Burchett M D. Cellular distribution of copper, lead and zinc in the grey mangrove, Avicennia marina (Forsk.) vierh [J]. Aquatic Botany, 2000,68:45-59.
[21] Sousa A I, Cacador I, Miguel A. Heavy metal accumulation in halimione portulacoides: Intra- and extra-cellular metal binding sites [J]. Chemosphere, 2008,70:850-857.
Difference in cell wall components of roots and its effect on the transfer factor of Zn by plant species.
CHEN Shi-bao*, SUN Cong, WEI Wei, LIN Lei, WANG Meng (Key Laboratory of Plant Nutrition and Fertilization, Ministry of Agriculture, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China). China Environmental Science, 2012,32(9):1670~1676
A hydroponic culture experiment was conducted to investigate the uptake and transfer factor (TF) of zinc (Zn) by different plant species, the translocation and the redistribution of Zn in the cell wall and its’ components were also studied. The results showed that the Zn uptake and its translocation differed significantly between six cultivars, the largest shoot Zn concentrations were found in Chinese cabbage and lettuce, while rice had the largest Zn concentration in root. With the addition of 50mg/L Zn in solution, the shoot to root transfer factors of Zn by plant species followed: Chinese cabbage ≈ leaf mustard ≈ lettuce>sweet green pepper > tomato > rice, however, the TF of lettuce exceeded the leaf mustard under the lower addition concentration (20mg/LZn), it’s probably related with the hormesis of Zn phyto-toxicity to lettuce. The Zn immobilization by cell wall was an important mechanism for Zn detoxification. By the in-situ desorption technique, the Zn accumulation in cell walls and their components were measured. The result showed that the Zn contents of cell walls increased significantly after removing pectin among plant species, the largest increment of 53.7% was found with rice while the least (21.1%) with sweet green pepper. The result of adsorption kinetics of Zn on the root cell walls indicated the adsorption of Zn by raw cell walls and treated cell walls was a fast reaction, more than 91% of total Zn was adsorbed by the adsorbents within 30min, the adsorption maximum of Zn by cell walls increased significantly after removing pectin among plant species, on the contrary, the adsorption maximum of Zn by cell walls decreased remarkably after removing pectin and hemicellulose, especially with the cell walls of rice. The results indicated that the hemicellulose components in cell walls played an important role in bonding Zn and thereafter reducing the translocation of Zn in xylem in plants.
zinc;plant species;cell wall;transfer factor;adsorption kinetics
2012-01-10
国家自然科学基金资助项目(21077131);农业部农业公益性行业专项(200903015,201103007)
* 责任作者, 研究员, sbchen@mail.caas.net.cn
X503.23
A
1000-6923(2012)09-1670-07
陈世宝(1971-),男,安徽马鞍山人,研究员,博士,从事土壤中重金属环境行为与环境质量研究.发表论文60余篇.
