外源抗坏血酸对龙眼保鲜效果的影响
2012-12-24董乐
董 乐
(泉州师范学院 化学与生命科学学院,福建 泉州 362000)
龙眼 (Dimocarpus longan)原产我国南部和西南部,为我国特产名果。其果实风味独特,具较高的营养和医疗保健价值,历来深受人们的喜爱[1]。我国龙眼在世界果品生产中占有独特地位,品种资源、栽培面积和产量均居世界首位。龙眼果皮薄,肉多汁,含糖量高,含酸量低;成熟季节高温多湿,采后呼吸作用旺盛,衰败迅速,遇微生物侵染,果实极易变质腐烂。龙眼果实采后在自然条件下存放,通常3 d左右风味即发生劣变,超过1周就会完全丧失食用价值。由于我国龙眼的产地消费量只占其生产量的20%,其余80%为外销或贮藏加工[2],近20年来,国内外学者对龙眼采后生理以及果皮褐变机理和贮运保鲜的技术等方面开展了多方面的研究并取得一定进展。果实采后的快速衰变与其果肉采后代谢产生的大量的活性氧是分不开的,如果细胞中的活性氧无法被抗氧化系统及时清除,就会导致氧化胁迫[3]。本文探讨了外源抗坏血酸对龙眼保鲜效果的影响。
1 材料与方法
1.1 材料
所用材料为龙眼品种立冬本。2011年10月19日采自莆田市华亭镇龙眼示范基地。施保克和多菌灵购自广州诚中农资有限公司;柠檬酸、石英砂、磷酸二氢钠、磷酸氢二钠、乙酸钠、无水乙醇均为国产分析纯;丙二醛 (MDA)测定试剂盒、超氧化物歧化酶 (SOD)测定试剂盒、过氧化物酶(POD)测定试剂盒、谷胱甘肽 (GSH)测定试剂盒、蔗糖测定试剂盒、过氧化氢酶 (CAT)测定试剂盒、过氧化氢 (H2O2)测定试剂盒和Vc测定试剂盒均购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 试验处理
挑选大小均一、无机械损伤、无病虫害、约九成熟的龙眼果实,用施保克3 mL·L-1+多菌灵500 mg·L-1+ 柠檬酸 15.0 mmol·L-1浸果 15 min,杀灭果实表面的各种病菌,并以此处理为对照(CK)。另外在此溶液中加入外源抗坏血酸100.0 mmol·L-1(AsA处理)浸果15 min,浸果处理后在室内自然晾干,分别装入聚乙烯袋中并封口,每袋约3.0~3.5 kg。试验材料分2组处理,1组在室温28℃ ~30℃贮藏,另1组在 (4±1)℃冷库贮藏,相对湿度为80%。室温下每2 d,低温下每4 d取样1次,每次取5~6个外观良好且果皮完好的果实来测定相关生理参数。
1.2.2 相关生理指标测定
称取5 g鲜龙眼果肉,剪碎后加45 mL 0.05 mol·L-1的磷酸缓冲液和少量石英砂于冰浴中研磨,将匀浆全部转入离心管,在4℃,4 000 r·min-1的离心机中离心沉淀30 min,取上清液,经过滤后分装于1.5 mL的离心管中,并置于-80℃冰箱中保存,备用。
果肉的MDA含量、SOD活性、POD活性、谷胱甘肽GSH含量、蔗糖含量、CAT活性、H2O2含量和Vc含量均按试剂盒说明书提供的方法测定。
2 结果与分析
2.1 AsA处理对龙眼果肉MDA含量的影响
MDA是膜脂过氧化作用生成的初级产物,其含量的多少反映膜脂过氧化作用的程度[4]。
在室温条件下 (图1中 a),AsA处理的龙眼果肉MDA含量随着贮藏时间的延长而提高;到第5天时,AsA处理的果肉 MDA含量比第1天高,但比对照降低了28.4%,达极显著差异。
在4℃低温下 (图1中b)贮藏的前5 d,处理间的MDA含量没有明显差异;到第9天时,对照的果肉MDA含量略高于AsA处理的果实;到第17天时,AsA处理的果实,其果肉MDA含量与第9天变化不大,比对照降低了28.6%。说明 AsA处理的果实能有效地减少果肉细胞膜脂过氧化程度。
由图1可知,对照的和AsA处理的龙眼果肉,在室温贮藏5 d和低温贮藏17 d后,其MDA含量提高的幅度相近。不同的是AsA处理的龙眼果肉MDA含量,室温贮藏的提高较快,说明在一定时间内,低温结合AsA处理的果实能有效地减少果肉细胞膜脂过氧化程度,降低MDA的生成。
2.2 AsA处理对龙眼果肉SOD活性的影响
在室温条件下 (图2中a),对照和 AsA处理的龙眼果肉的SOD活性均呈下降趋势。到第3天时,AsA处理的SOD活性比对照的提高7.6%。到第5天时,对照和AsA处理的SOD活性分别比第1天下降了68.4%和30.2%,而AsA处理的SOD活性极显著高于对照。
在4℃低温下 (图2中 b),随着贮藏时间的延长,龙眼果肉中SOD活性不断下降,但AsA处理果肉的SOD活性下降缓慢,相同贮藏天数下均极显著高于对照。至第17天时,对照与AsA处理的SOD活性分别比第1天下降了41.4%和27.6%。说明龙眼果肉经AsA处理后能够显著地抑制SOD的活性的下降。
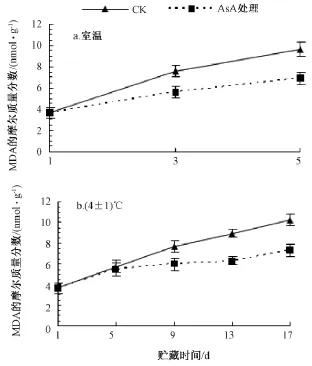
图1 AsA处理对果肉MDA含量的影响
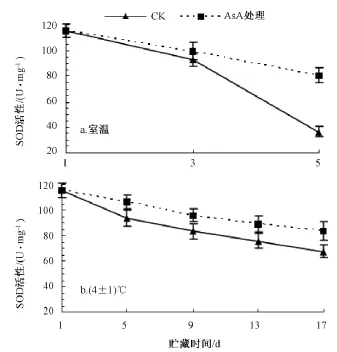
图2 AsA处理对果肉SOD活性的影响
由图2可知,就对照而言,贮藏5 d后,龙眼果肉的SOD活性室温比低温贮藏的下降了49.2%,而AsA处理果肉的SOD活性,在低温贮藏17 d后比室温贮藏5 d下降32.0%。由此说明低温配合AsA处理更有利于龙眼果肉保持较高的SOD活性。
2.3 AsA处理对龙眼果肉POD活性的影响
室温条件下 (图3中a),龙眼果肉中POD的活性随着贮藏时间的延长而上升,至第3天时,对照与AsA处理果肉的POD活性无显著差异;至第5天时,与对照相比,经AsA处理果肉的POD活性的上升趋势显著下降,AsA处理果肉的POD活性比对照的低21.2%。这表明AsA处理在一定程度上能够降低龙眼果肉的POD活性。
在4℃低温下 (图3中b),龙眼果肉中POD的活性在前5 d均呈下降趋势,但变化差异不显著;第5天后活性开始呈上升趋势。AsA处理龙眼果肉的POD活性的上升趋势比对照的缓慢,至第17天时,对照中果肉POD活性上升了35.1%,而AsA处理果肉POD活性上升了12.6%,且AsA处理与对照的果肉POD活性之间差异显著。
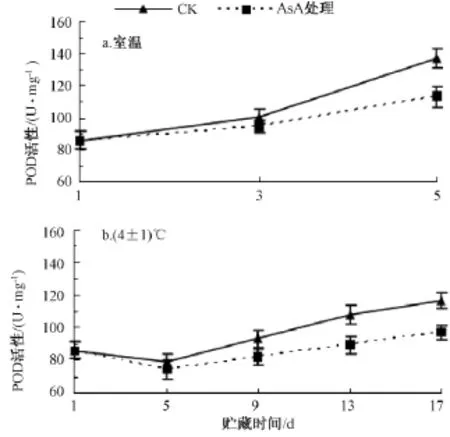
图3 AsA处理对果肉POD活性的影响
由图3可知,室温下第5天龙眼果肉的POD活性高于低温下第17天果肉POD的活性,说明贮藏温度越高,龙眼果肉POD活性越强,即低温配合AsA处理更有利于龙眼的贮藏。
2.4 AsA处理对龙眼果肉GSH含量的影响
室温条件下 (图4中 a),AsA处理果肉的GSH含量均随着贮藏时间的延长而下降。相同贮藏时间时,AsA处理果肉的GSH含量均高于对照。AsA处理果肉的GSH含量在前3 d基本不变 (图5)。比较第5天与第1天的结果,对照与AsA处理龙眼果肉的GSH含量分别下降了32.9%和10.5%。
在4℃低温下 (图4中 b),贮藏前5 d的对照和AsA处理果肉的GSH含量均没有显著变化(图6);在第9天后,对照和 AsA处理果肉的GSH含量均显著降低,且AsA处理果肉的GSH含量均显著高于对照;至17 d时,对照与AsA处理中龙眼果肉的GSH含量分别比第1天下降了36.8%和26.3%。说明经AsA处理后,龙眼果肉能够维持较多的GSH含量。
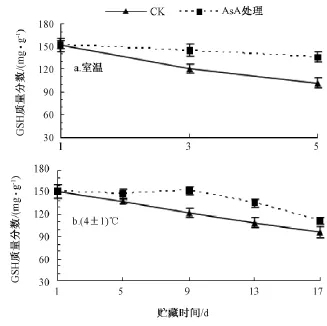
图4 AsA处理对果肉GSH含量的影响
由图4可知,对照中,室温贮藏5 d龙眼果肉的GSH含量与低温贮藏13 d时的无显著差异;当AsA处理后,低温贮藏17 d龙眼果肉的GSH含量比室温贮藏5 d的还高15.8%。说明低温配合AsA处理能极显著减少GSH含量的下降。
2.5 AsA处理对龙眼果肉蔗糖含量的影响
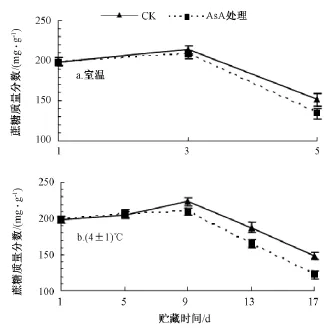
图5 AsA处理对果肉蔗糖含量的影响
室温条件下 (图5中a),经AsA处理的龙眼果肉蔗糖含量低于对照。在贮藏前3 d,龙眼果肉蔗糖含量基本不变。比较第5天与第1天的结果,对照与AsA处理龙眼果肉的蔗糖含量分别下降了23.8%和32.3%。
在4℃低温下 (图5中b),经AsA处理的龙眼果肉蔗糖含量低于对照。在贮藏前5 d,龙眼果肉蔗糖含量基本不变;至第17天时,对照与AsA处理中龙眼果肉的蔗糖含量分别比第1天下降了25.3%和38.5%,存在显著性差异。
由图5可知,随着贮藏时间的延长,蔗糖含量都是先缓慢升高后迅速下降。但AsA处理龙眼果肉的蔗糖含量基本低于对照。
2.6 AsA处理对龙眼果肉CAT活性的影响
室温条件下 (图6中a),龙眼果肉的CAT活性随着贮藏时间的延长逐渐下降。在贮藏的第5天,对照和AsA处理龙眼果肉的CAT活性分别比第1天下降了47.5%和23.6%,且AsA处理龙眼果肉的 CAT活性极显著高于对照的 CAT活性,高45.5%。
在4℃低温下 (图6中b),龙眼果肉的CAT活性随着贮藏时间的延长也呈下降趋势。在贮藏的前5 d,对照与AsA处理龙眼果肉的CAT活性变化无显著差异。第5天后,AsA处理龙眼果肉的CAT活性始终高于对照的,且存在显著差异;至第17天时,对照和AsA处理龙眼果肉的CAT活性分别比第1天下降45.1%和29.7%,且AsA处理的CAT活性极显著高于对照,达30.0%。结果表明,AsA处理可以抑制龙眼贮藏过程中CAT活性的降低。
由图6可知,室温下第5天的对照龙眼果肉的CAT活性比低温下第17天时AsA处理龙眼果肉的CAT活性低33.9%,达极显著差异。
2.7 AsA处理对龙眼果肉H2O2含量变化的影响
室温条件下 (图7中a),随着贮藏时间的延长,龙眼果肉H2O2的含量不断地增加。至第5天时,对照与AsA处理龙眼果肉H2O2的含量分别比第1天高832.4%和529.4%;对照龙眼果肉H2O2的增加量比AsA处理的高,且对照与处理间差异显著。
在4℃低温下 (图7中 b),随着贮藏时间的延长,龙眼果肉H2O2的含量不断地增加。前5 d增加的趋势较为缓慢。第5天之后,龙眼果肉H2O2含量增加的趋势明显加快,但AsA处理龙眼果肉H2O2的含量始终显著低于对照的;至第17天时,对照的和AsA处理龙眼果肉H2O2的含量分别比第1天增加了671%和579%。
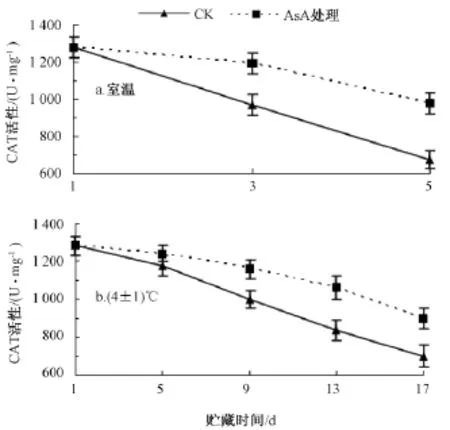
图6 AsA处理对果肉CAT活性的影响
由图7可知,室温下第5天的对照龙眼果肉H2O2的含量比低温下第17天的含量高20.0%,达显著差异,高达37.2%。即H2O2的含量发生累积的程度降低。因此,低温结合AsA处理对龙眼的安全贮藏是有利的。
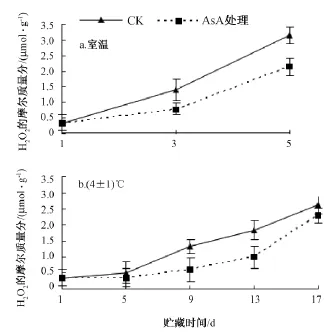
图7 AsA处理对果肉H2O2含量的影响
2.8 AsA处理对龙眼果肉Vc含量的影响
室温条件下 (图8中a),龙眼果肉的Vc含量随着贮藏时间的延长不断下降。与对照比较,AsA处理龙眼果肉的Vc含量的下降相对缓慢。至第5天,对照和AsA处理龙眼果肉的Vc含量分别比第1天下降了33.7%和16.9%。AsA处理能够维持龙眼果肉中Vc含量。
在4℃低温下 (图8中b),龙眼果肉的Vc含量随着贮藏时间的延长亦呈下降趋势。在第5天时,AsA处理龙眼果肉Vc含量与对照无显著差异;第5天后,对照龙眼果肉 Vc含量降幅加快,且AsA处理与对照间差异显著;至第17天,对照和AsA处理龙眼果肉的Vc含量与第1天比较,分别呈极显著和显著差异,分别下降了48.2%和26.5%。
由图8可知,在低温下Vc下降的趋势比在室温下缓慢。与室温下贮藏至第5天时对照Vc含量相比,低温下贮藏至第13天时AsA处理龙眼果肉的Vc含量仍无显著差异。这说明在一定程度上,低温配合AsA处理更有利于龙眼的保鲜。
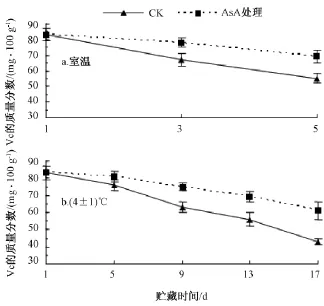
图8 AsA处理对果肉Vc含量的影响
3 讨论
陈少裕[5]研究表明,植物衰老是细胞内活性氧化代谢平衡被破坏,产生大量自由基,进而引发或加剧膜脂过氧化作用,造成细胞膜系统结构和功能的破坏,导致细胞膜透性的增加和MDA含量的上升。膜脂过氧化作用与果实成熟衰老密切相关[6]。SOD作为果实内重要的抗氧化系统组成物质,能够有效的清除活性氧,减少机体受活性氧的攻击,保持细胞膜透性,减少MDA生成。本实验中,AsA处理的龙眼果实SOD活性明显高于对照,而MDA的含量均低于对照,说明经AsA处理后,果实中的SOD能够有效地清除活性氧自由基,降低膜脂过氧化作用,延缓龙眼果实的衰老,达到保鲜效果。
AsA和GSH是两种重要的抗氧化物质,在植物体内可通过抗坏血酸-谷胱甘肽 (AsA-GSH)循环清除活性氧。有研究表明,植物在逆境下,以AsA和GSH为底物,通过提高了这个循环过程中的谷胱甘肽还原酶和抗坏血酸过氧化物酶活性,加强对活性氧的清除作用,降低了氧化胁迫[7-8]。实验中发现,经AsA处理能显著延缓贮藏过程果肉GSH含量的下降,维持较高的抗氧化物质含量,为抗坏血酸-谷胱甘肽循环提供了更多的底物。通过各种处理降低活性氧的胁迫,提高保鲜效果在多种果实上已被证实,如采后的番荔枝和番茄[9]。因此在龙眼保鲜过程中只要降低活性氧的产生和提高对活性氧的清除能力,可以促进龙眼果肉的保鲜效果。
蔗糖是参与代谢的主要能源物质,能提供呼吸基质,增加呼吸速度,阻止蛋白质的分解,维持酰胺的合成,维持生物膜的完整性[10]。研究结果中,无论在室温还是在低温贮藏条件下,AsA处理后蔗糖的含量均比对照的低,这可能由于采摘的果实还未完全成熟,或是保鲜效果差的果实,较利于促进果实内贮藏物质向可溶性糖转化。在相同贮藏时间下,低温贮藏蔗糖的含量均比室温贮藏的高。说明低温能够抑制龙眼果肉蔗糖含量在贮藏过程中的降解速率,从而提高了保鲜效果。
在实验中还发现,通过AsA处理后,能显著延缓贮藏过程中龙眼果肉Vc抗氧化物含量的降低和降低POD的活性,这两种效果在一定程度上都有利于保持植物果实中较高含量的抗氧化物质,延缓了果实的衰老过程,从而有利于果实的保鲜效果。
经AsA处理过的果实,由于AsA对活性氧的清除作用,从而使由于体内活性氧代谢活动的加强而使H2O2的含量发生累积的程度降低,且在清除活性氧使其在酶解的过程中也会激活植物体自身存在的酶防御系统,提高CAT的活性,进而又消除了细胞内的活性氧和自由基,使细胞内的氧化还原系统维持在一个较平衡的状态,对细胞起到了保护作用[11]。
高温是引起龙眼果实腐败和衰老的主要原因,在室温下,龙眼果实中酶的活性较高,呼吸作用的强度较大,而且微生物的活动也较为活跃。实验研究表明,适当的低温在一定程度上能够有效的控制果实中部分酶的活性,控制微生物的活动,降低果实的呼吸强度,保持果实较好品质,延长果实的贮藏期[12-13]。因此用AsA处理,然后结合低温贮藏更能够有效的抑制龙眼果肉的腐烂和衰老,提高龙眼采后的保鲜效果。
4 小结
AsA处理不管在常温还是在低温贮藏下都提高了龙眼果实的保鲜效果。
AsA处理龙眼果实后,低温贮藏的保鲜效果又相对高于常温贮藏。
[1] 邱武陵,张恢志.中国果树志·龙眼枇杷卷[M].北京:中国林业出版社,1996:1-43.
[2] 李明.我国龙眼贮藏保鲜与加工利用现状 [J].热带作物科技,1998(2):28-31.
[3] Mo Y,Gong D,Liang G,et al.Enhanced preservation effects of sugar apple fruits by salicylic acid treatment during postharvest storage [J].Journal of the Science of Food and Agriculture,2008,88(15):2693-2699.
[4] 林河通,习玙芳,陈绍军.龙眼果实采后失水果皮褐变与活性氧及酚类代谢的关系 [J].植物生理与分子生物学报,2005,31(3):287-297.
[5] Chen S Y.Damage of membrane lipid peroxidation on the cells of plants [J].Plant Physiology Communications,1991,27(2):84-90.
[6] 吴敏,陈昆松,张上隆.桃果实采后成熟过程中脂氧合酶活性变化 [J].园艺学报,1999,26(4):227-231.
[7] Asada K.The water-water cycle as alternative photon and electron sinks[J].Philosophical Transactions of the Royal Society of London, Series B:Biology Science,2000,355(1402):1419-1431.
[8] Nocter G,Foyer C H.Ascorbate and glutathione:keeping active oxygen under control[J].Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 49 (1):249-279.
[9] 王愈,李里特.高压电场处理对贮藏番茄活性氧代谢的调节 [J].农业工程学报,2009,25(1):255-259.
[10] 高勇,吴绍锦.切花保鲜剂研究综述 [J].园艺学报,1989,16(2):139-145.
[11] 耶兴元,何晖,仝胜利.抗坏血酸与植物抗氧化性的关系[J].信阳农业高等专科学校学报,2009,12(4):21-34.
[12] 赵云峰,林河通,林娇芬,等.龙眼采后果肉生理生化变化研究 [J].华 南农业 大学学 报,2002,23(1):20-23.
[13] 孔祥佳,林瑜.低温贮藏对晚熟龙眼“立冬本”果实采后生理和品质的影响 [J].包装与食品机械,2008,26(1):1-6.
