用Candida lipolytica脂肪酶手性转酯拆分农药中间体rac-1-苯乙醇
2012-12-24范卫东范永仙陈小龙
范卫东,范永仙,陈小龙
(1.浙江工业大学 生物与环境工程学院 发酵工程研究所,浙江 杭州 310014;2.浙江天新药业有限公司,浙江 天台 317200)
随着生命科学的进一步发展,人们已充分认识并开始重视手性药物异构体在生物体内代谢、药理作用、临床效果和毒副作用的差异[1]。研究表明,以对映体纯化合物给药比其外消旋物疗效更好、更安全[2]。因此,研究和分离手性化合物具有重要的学术意义和实用价值。光活性醇是精细化学品和药物合成的重要中间体,在农药、医药和化工等领域有着广泛的应用[3]。其制备可以通过化学法或生物法拆分来获得。由于生物法 (生物催化和生物转化)拆分具有高效、反应条件温和、高手性选择性、对环境友好等原因,已引起广泛关注[4-8]。1-苯乙醇是重要的有机化合物,可作为手性中间体被广泛地应用于手性药物或天然产物的合成[9]。由此可见,发展高效的不对称合成方法来合成1-苯乙醇具有十分重要的意义。目前,利用脂肪酶高度的立体选择性,在有机溶剂中进行转酯化手性拆分制备单一手性醇 (酯)倍受人们的关注,特别是手性1-苯乙醇[10-12]。但所用的脂肪酶基本上是Novozym 435(Candida antarctica lipase B,CALB),而利用其他来源脂肪酶来拆分手性醇比较少。本文比较了CALB和部分其他脂肪酶拆分1-苯乙醇,并使用C.lipolytica脂肪酶手性转酯拆分rac-1-苯乙醇制备 (S)-1-苯乙醇,优化了脂肪酶在有机相中手性拆分1-苯乙醇的条件。
1 材料与方法
1.1 脂肪酶及试剂
C.lipolytica脂肪酶 (北京凯泰新世纪生物技术有限公司),Novozym 435(Novozymes),猪胰脂肪酶 (Sigma-Aldrich),扩展青霉脂肪酶 (福建龙马生化厂),黑曲霉脂肪酶 (深圳市绿微康生物工程有限公司),rac-1-苯乙醇和乙酸乙烯酯 (南京康满林化工实业有限公司和江苏永华精细化学品有限公司);所有其他化学试剂均为分析纯。
1.2 转酯化反应
如图1所示,脂肪酶转酯化反应的底物为rac-1-苯乙醇和乙酸乙烯酯,经 C.lipolytica脂肪酶转酯化反应,得到 (S)-1-苯乙醇、 (R)乙酸-1-苯乙酯和乙醛。
具体操作如下:取0.02 mol·L-1(12.2 μL)1-苯乙醇,0.1 mol·L-1(46 μL)乙酸乙烯酯。以乙酸乙烯酯作溶剂,反应体系5 mL,10 mg C.lipolytica脂肪酶,置于30℃,150 r· min-1的摇床中进行转酯化反应。
1.3 产物的分离与检测
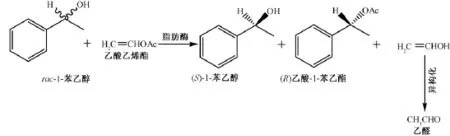
图1 脂肪酶转酯化反应
转酯化反应每隔一定时间取样,然后在样品中加入一定比例的乙酸乙酯,振荡萃取30 min,离心(12 000 r·min-1,5 min,4℃)分离,取上层有机溶液,用无水 Na2SO4干燥。产物乙酸-1-苯乙酯和未反应完全的底物1-苯乙醇用SP-6890型气相色谱仪 (山东鲁南瑞虹化工仪器有限公司,装有手性毛 细 管 柱 Cyclodex-B,30 m×0.250 mm ×0.25 mm,FID检测器)分析。色谱条件:柱温使用程序升温,初温85℃维持3 min,升温速率15℃·min-1,终温140℃维持3 min;进样器气化温度和FID检测温度分别为240℃和250℃;载气N2, 流 量 3.0 mL·min-1, 分 流 比 50∶1, 样 量0.4 μL,使用面积归一化法分析。
转化率/%=(初始底物峰面积-剩余底物峰面积)/初始底物峰面积×100。
初始底物峰面积=剩余底物峰面积+生成产物所需的底物的峰面积。
1-苯乙醇对映体过剩值 (e.e.值)/%=(S-1-苯乙醇的峰面积 -R-1-苯乙醇的峰面积)/(S-1-苯乙醇的峰面积 +R-1-苯乙醇的峰面积)×100。
2 结果与分析
2.1 不同来源脂肪酶拆分1-苯乙醇
取 0.02 mol·L-1(12.2 μL)1-苯 乙 醇,0.1 mol·L-1(46 μL)乙酸乙烯酯,乙酸乙烯酯作 溶 剂, 反 应 体 系 5 mL, 摇 床 30℃,150 r·min-1。
由图2可以看出,5种脂肪酶都有拆分能力。Novozym 435可将底物完全拆分,其次是假丝酵母脂肪酶,168 h时底物e.e.值达到19.01%,转化率15.97%。但目前对Novozym 435的研究已经比较成熟,而对假丝酵母脂肪酶的催化拆分条件研究较少,所以本文采用假丝酵母脂肪酶作进一步的研究。
2.2 不同溶剂对反应的影响
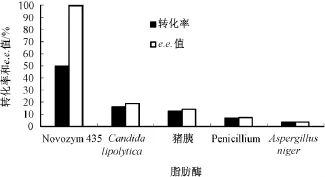
图2 不同来源脂肪酶对酯转化的影响
各种溶剂的log P值和对脂肪酶转酯化的影响分别如表1和图3所示。表1和图3可以看出,溶剂的疏水性系数对转化率有一定的影响。除了正己烷以外,疏水性系数大于2.5的溶剂,168 h后转化率均达到30%以上;正庚烷的转化率最高为49.75%,1-苯乙醇e.e.值达到99.02%。故选择正庚烷为溶剂。
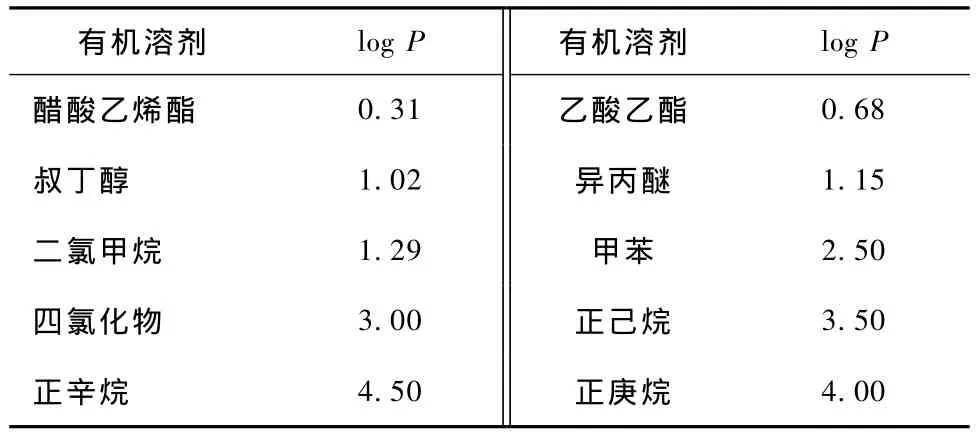
表1 有机溶剂的log P
2.3 加酶量对反应的影响
如图4所示,随着加酶量的增加 (5~20 mg),底物的转化率稳步上升,72 h时转化率从37.40%增加到50.00%,反应速率明显提高。进一步增加酶量,72 h时,30 mg转化率为43.21%,40 mg为48.30%,提高不明显甚至有所下降。所以,从加快反应速率和节约脂肪酶两方面综合考虑,最佳加酶量为20 mg。经过酶量的优化,反应时间从之前的168 h大幅缩短到72 h。
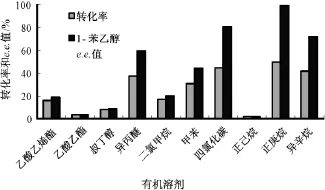
图3 有机溶剂反应的影响
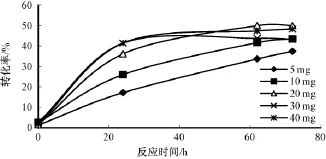
图4 脂肪酶加酶量对转化率的影响
2.4 反应体系水活度对反应的影响
在酶促反应中,水活度对保持酶的活性和酶反应速率非常重要。实验取20 mg C.lipolytica脂肪酶, 0.02 mol·L-1(12.2 μL)1-苯 乙 醇,0.1 mol·L-1(46 μL)乙酸乙烯酯,正庚烷作溶剂,加入不同含结晶水的无机盐来维持水活度摇床温度30℃,转速150 r· min-1(图5-6)。
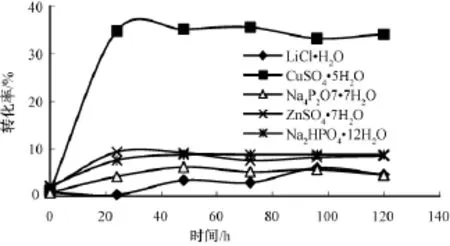
图5 水活度对转化率的影响
LiCl·H2O(Aw=0.023)水活度过低,脂肪酶失水而失活,转化率只有4.54%;Na4P2O7·7H2O(Aw=0.47)、ZnSO4·7H2O(Aw=0.62)、Na2HPO4·12H2O(Aw=0.85)等水活度过高,影响了酶的均相分布。当水活度为0.35(CuSO4·5H2O)时,转化率最高。
2.5 温度对反应的影响
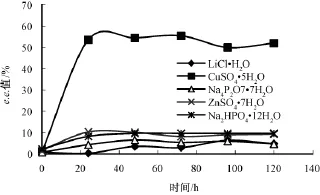
图6 水活度对1-苯乙醇e.e.值的影响
酶反应温度既影响反应速率,同时也影响酶活性。温度越高,反应速度越快,酶失活越快。实验取 0.02 mol·L-1(12.2 μL)1-苯 乙 醇,0.1 mol·L-1(46 μL) 乙 酸 乙 烯 酯,20 mg C.lipolytica脂肪酶,用正庚烷作溶剂,反应体系5 mL,水活度0.35。
25~45℃时,转化率、1-苯乙醇 e.e.值和反应速率 (图7-8)均随温度升高而上升,96 h转化率从44.73%上升到49.86%,1-苯乙醇 e.e.值从80.93%上升到99.44%,45℃下仅48 h转化率就达到49.84%。当温度继续上升时,转化率和1-苯乙醇e.e.值开始下降,至55℃,96 h时仅剩43.84%。这与文献[11-12]中描述的C.lipolytica脂肪酶在50~60℃失活一致。综合考虑,温度选择45℃较为合适。
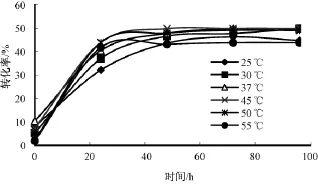
图7 温度对转化率的影响
2.6 底物浓度对反应的影响
1-苯 乙 醇 浓 度 分 别 为 0.02,0.04,0.06,0.08,0.10 mol·L-1,乙酸乙烯酯浓度对应为0.1,0.2, 0.3, 0.4, 0.5 mol·L-1时, 放 入45℃,150 r·min-1的摇床中反应。
随着 1-苯乙醇浓度从0.02 mol·L-1上升到0.08 mol·L-1,72 h时的转化率一直维持在49.82% ~49.87%之间,1-苯乙醇 e.e.值也很高,但进一步提高 1-苯乙醇浓度为0.1 mol·L-1时,转化率明显下降至45.82%,1-苯乙醇 e.e.值也只有88.88%。所以0.08 mol·L-11-苯乙醇和0.4 mol·L-1乙酸乙烯酯为较合适的底物浓度 (图9-10)。
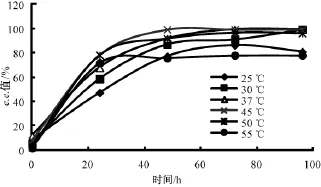
图8 温度对1-苯乙醇e.e.值的影响
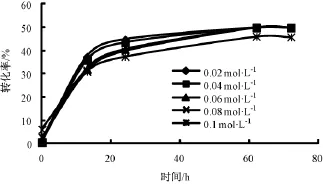
图9 底物浓度对转化率的影响
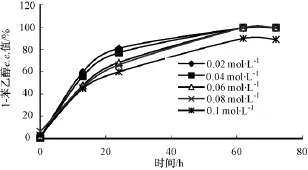
图10 底物浓度对1-苯乙醇e.e.值的影响
3 小结
综上可知,利用国产的C.lipolytica脂肪酶手性转酯拆分rac-1-苯乙醇制备 (S)-1-苯乙醇是可行的,较佳反应工艺为:反应体系5 mL,正庚烷为溶剂,加酶量为20 mg,水活度为0.35,反应温度45℃,rac-1-苯乙醇浓度为0.08 mol·L-1,乙酸乙烯酯为0.4 mol·L-1。经过优化,转化率从15.97%上升到49.88%,(S)-1-苯乙醇 e.e.值
由于目前对C.lipolytica脂肪酶手性转酯拆分rac-1-苯乙醇制备 (S)-1-苯乙醇研究比较少,对其酶动力学及动态拆分动力学等还有待进一步研究。
[1] Anirban G,Rajiv K.Efficient heterogeneous catalytic systems for enantioselective hydrogenation of prochiral carbonyl compounds[J].J Catal,2004,228(2):386-396.
[2] Vetere V,Faraoni M B,Santori G F,et al.New approach toward the synthesis of asymmetric heterogeneous catalysts for hydrogenation reactions [J].J Catal,2004,226 (2):457-461.
[3] Chaubey A, Parshad,Gupta P. Arthrobactersp. lipase immobilization for preparation of enantiopure masked β-amino alcohols[J].Bioorg Med Chem,2009,17(1):29-34.
[4] Hudlicky T,Reed J W.Applications of biotransformations and biocatalysis to complexity generation in organic synthesis [J].Chem Soc Rev,2009,38(11):3117-3132.
[5] Tao J H,Xu J H.Biocatalysis in development of green pharmaceutical processes[J].Cur Opin Chem Biolog,2009,13(1):43-50.
[6] Woodley J M.Biocatalysis for pharmaceutical intermediates:the future is now [J].Trends Biotechnol, 2008,26 (6):321-327.
[7] Patel R N.Synthesis of chiral pharmaceutical intermediates by biocatalysis[J].Coordin Chem Rev,2008,252(5-7):659-701.
[8] Ran N Q,Zhao L S,Chen Z M,et al.Recent applications of biocatalysis in developing green chemistry for chemical synthesis at the industrial scale[J].Green Chem,2008,10(4):361-372.
[9] Suan C L, SarmidiM R. Immobilised lipase-catalysed resolution of(R,S)-1-phenylethanol in recirculated packed bed reactor[J].J Mol Catal B:Enzym,2004,28(2-3):111-119.
[10] Benaissi K,Poliakoff M,Thomas N R.Dynamic kinetic resolution of rac-1-phenylethanol in supercritical carbon dioxide[J].Green Chem,2009,11(5):617-621.
[11] De los Rios A P,Hernandez-Fernandez F J,Tomas-Alonso F,et al.Biocatalytic kinetic resolution of rac-1-phenylethanol and rac-2-pentanol in hexane medium:ACYL donor and water content effects [J].Can J Chem Eng,2010,88(3):442-446.
[12] Ou L,Xu Y,Ludwig D,et al.Chemoenzymatic deracemization of chiral secondary alcohols:Process optimization for production of(R)-1-indanol and(R)-1-phenylethanol[J].Org Proc Res Develop,2008,12(2):192-195.
