靶向沉默ADAM10 基因对心肌细胞N-cadherin 加工的影响*
2012-12-23李小鸥陈亚隽周丽荣
李小鸥, 黄 巍, 陈亚隽, 周丽荣
(1武汉大学人民医院儿科,湖北 武汉430070;2武汉市医学科学研究所,湖北 武汉430032 3华中科技大学同济医学院附属同济医院呼吸与危重症医学科,湖北 武汉430030)
神经型钙黏蛋白(neural cadherin,N-cadherin)是调节细胞与细胞之间、细胞与基质之间黏附反应的重要媒介,对维持组织结构形态起重要作用。N-cadherin 与连环蛋白(catenins)形成N-cadherin/catenins 复合体(钙-连复合体)可使N-cadherin 集中定位细胞与细胞间的接触部位,该复合体任何一种成分异常都会影响到N-cadherin 介导的细胞黏附功能。
基于对N-cadherin 加工代谢过程的深入了解,现已在成纤维细胞和神经细胞中发现N-cadherin 有一条非常重要的解整合素金属蛋白酶家族ADAMs(a disintegrin and metalloproteinase proteins)加工途径,ADAMs 在N-cadherin 胞外域N 端的R714-I715处将其水解,破坏了N-cadherin 的分子完整性,影响了钙-连复合体的形成,导致其功能丧失并引发相应的病理生理改变[1-2]。研究表明在成纤维细胞和神经细胞中,N-cadherin 的ADAMs 加工途径对相应系统功能的正常发挥起关键作用[2],参与上述加工途径的蛋白水解酶主要是ADAM 家族中的ADAM9、ADAM10 和ADAM17,特别是ADAM10 发挥了尤为重要的作用[3]。但是心肌细胞中ADAMs 和N-cadherins 相互作用的研究仅是开始,很多问题尚不清楚,本研究将靶向沉默ADAM10 的siRNA 表达载体导入大鼠心肌细胞,并建立稳定表达的细胞系,通过观察该载体对细胞N-cadherin 的ADAMs 加工途径的影响,以明确心肌细胞中ADAM10 在N-cadherin 底物加工过程中的重要性,目的是为探求该加工途径在维持心肌组织结构形态和完整性中的作用打下基础。
材 料 和 方 法
1 主要材料和试剂
大鼠ADAM10 干扰载体[sc-270165 ADAM10 siRNA(r)]购自Santa Cruz,兔抗ADAM10 抗体购自eBioscience,兔抗N-cadherin 抗体购自Abcam,AP 标记羊抗兔抗体购自Santa Cruz。嘌呤霉素购自Sigma。转染试剂脂质体LipofectamineTM2000 为Invitrogen 产品。
2 方法
2.1 细胞复苏与培养 大鼠心肌细胞(H9c2)购自中国科学院上海生命科学研究院细胞资源中心。液氮中取出H9C2 细胞,37 ℃水浴化冻,快速放入含10%胎牛血清、0.5% 青链霉素的MEM 培养液中,置于37 ℃、5% CO2培养箱中孵育,生长至90% 密度时传代,转染前1 d 换无抗生素的培养液过夜。
2.2 建立稳定表达的H9c2 细胞株 转染前1 d 取对数生长期的H9c2 细胞以2 ×105cells/well 的密度接种于24 孔板。无抗生素MEM 培养液(10%FBS)培养过夜。待细胞贴壁生长达80%~90%融合时,弃去细胞培养液,用无血清培养液洗涤细胞1 次,然后按脂质体转染试剂LipofectamineTM2000 的说明书将提取并纯化的sc-270165 ADAM10 siRNA(r)质粒转染H9c2 细胞,转染后4 h 更换培养液,用含5 mg/L 嘌呤霉素的培养液培养,48 h 观察瞬时表达情况,3 ~4 d 后当对照组细胞大部分死亡时,根据嘌呤霉素最小致死浓度实验,改用3 mg/L 的嘌呤霉素维持筛选,每2 ~3 d 换液传代,2 周后抗性克隆初步形成。在细胞融合达80%时,将细胞移至6 孔板培养,筛选单克隆至培养瓶中扩增,并在细胞的对数生长期收集细胞,进行各项实验。
2.3 Western blotting 检测ADAM10 蛋白的表达 RIPA 法提取转染组和空白对照组细胞总蛋白,BCA 法测定蛋白浓度。50 μg 总蛋白进行10% SDS-PAGE 电泳,300 mA 2h 转至NC膜。NC 膜经5%脱脂奶粉的TBS-T 溶液室温封闭2h 后,与兔抗鼠ADAM10 抗体(1∶600)4 ℃孵育过夜。TBS-T 溶液洗膜3 次后,NC 膜与HRP 标记羊抗兔II 抗(1∶1 000)室温孵育1 h,TBS-T 溶液再次漂洗3 次后ECL 化学发光观察。将胶片进行扫描或拍照,用凝胶图像处理系统分析。实验重复3 次。
2.4 Western blotting 检测N-cadherin 及其C 末端片段(Cterminal fragment,CTF) I 抗为兔抗N-cadherin 的多克隆抗体,抗原识别表位针对N-cadherin 的C 端,也识别CTF,其余方法同2.3。
2.5 流式细胞技术检测心肌细胞跨膜表达的N-cadherin
用PBS 将上述离心后的细胞吹打下来,再用PBS 洗2 次后,加入以PBA(含10%BSA)1∶100 稀释的抗N-cadherin 抗体,4 ℃作用1 h,PBS 洗2 次,加入1∶60 稀释的荧光II 抗,4 ℃作用1 h,PBS 洗2 次,细胞悬浮0.5 mL PBS,进行流式细胞术检测N-cadherin。
2.6 心肌细胞黏附实验 每孔100 μL 纤维连接蛋白(10 mg/L)包被96 孔板,以100 mg/L 多聚赖氨酸和1%牛血清白蛋白包被孔作为最大和最小黏附参照。将空白对照组和稳转细胞组细胞分别制备成5 ×108cells/L 细胞悬液,每孔加入100 μL,37 ℃、5% CO2、饱和湿度孵育3 h。磷酸盐缓冲液洗涤除去未黏附细胞,多聚甲醛固定,1% 亚甲蓝溶液染色20 min,每孔加入100 μL 1 mol/L HCl,37 ℃40 min,酶标仪测定600 nm 处吸光度(A),细胞黏附率(%)= (实验组A 值-牛血清白蛋白孔A 值)/(多聚赖氨酸孔A 值-牛血清白蛋白孔A 值)×100%。
3 统计学处理
结 果
1 稳转细胞株的建立
脂质体法转染H9c2 细胞,经嘌呤霉素筛选后建立稳定表达细胞株。Western blotting 检测ADAM10 蛋白的表达,见图1。结果显示与对照组相比,转染ADAM10 siRNA 细胞的ADAM10 蛋白水平降低了75.2%。表明本实验所用的siRNA能有效而特异地沉默ADAM10 基因,抑制其蛋白表达。
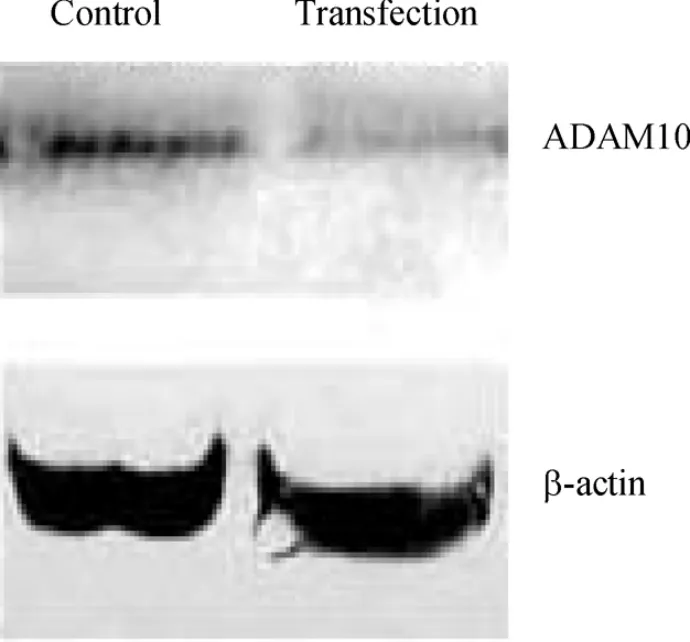
Figure 1. Expression of ADAM10 protein detected by Western blotting.图1 转染组与对照组ADAM10 蛋白的表达
2 Western blotting 检测细胞N-cadherin 及其CTF 蛋白表达
Western blotting 检测ADAM10 siRNA 转染组和对照组N-cadherin 及其CTF 蛋白表达。转染组细胞中N-cadherin蛋白的表达较正常细胞明显增多,CTF 蛋白表达明显减少,见图2。
3 流式细胞术检测心肌细胞表面N-cadherin 表达的变化
阴性对照组N-cadherin 的表达为(42.23 ±2.52)%,转染组心肌细胞表面N-cadherin 的表达为(73.48 ±3.41)%,与对照组相比明显增多(P <0.05)。
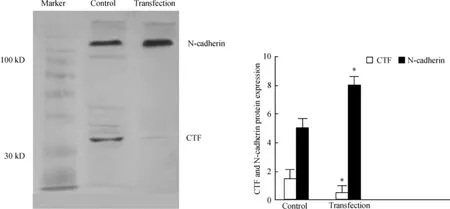
Figure 2. The expression of N-cadherin and its C-terminal fragment (CTF)detected by Westem blotting. * P <0.05 vs control.图2 N-cadherin 及其CTF 的蛋白表达
4 细胞黏附实验
阴性对照组细胞黏附率为(40.21 ±4.50)%,ADAM10 siRNA 转染组为(60.23 ±6.50)%,差异有统计学意义(P <0.05),表明转染组心肌细胞黏附率较对照组明显升高。
讨 论
众所周知,闰盘是心肌细胞的连接结构,使心肌形成一个功能上的整体。钙-连复合体作为心肌细胞闰盘中间连接的一个重要组成成分,是形成闰盘结构的关键分子基础,已成为近年来的研究热点。钙-连复合体位于闰盘的黏合膜,同时也是肌原纤维的附着点,在心肌细胞的发育及成熟阶段高度表达[4]。它同细胞骨架的相互联系和相互作用有重要功能[4]:(1)介导心肌细胞间的黏附反应,使心肌细胞形成牢固连接;(2)固定心肌纤维的定向排列,防止心肌纤维滑脱,保持心肌纤维舒缩的一致性和协调性。因此,钙-连复合是心肌细胞形态维持、物质运输和跨膜信息传递的重要结构基础。
钙-连复合体功能的正常发挥有赖于其完整性,其组成成员质和量的改变都可以引起复合体的功能异常。目前在成纤维细胞和神经细胞中发现ADAM10 可以特异性水解N-cadherin,产生N 端的NTF(95 kD)和C 端的CTF1(40 kD),再由γ-分泌酶将CTF1 片段进行水解,产生可溶性的CTF2(35 kD)。跨膜的N-cadherin 依次被ADAMs 和γ-分泌酶水解,分子的完整性遭到破坏,影响了钙-连复合体的形成[4-5]。鉴于以上成纤维细胞和神经细胞中的研究结果,我们推测心肌细胞中N-cadherin 也存在这样ADAMs 加工途径,对N-cadherin 在细胞中的定位分布及钙-连复合体的形成有重要作用
为了证明我们的推论,本实验首先利用ADAM10 siRNA转染入大鼠心肌细胞(H9c2),通过嘌呤霉素筛选,成功获得了ADAM10 稳定沉默的心肌细胞株。Western blotting 检测结果显示ADAM10 siRNA 稳转细胞组与阴性对照组相比,N-cadherin 蛋白表达水平明显提高,同时CTF 的表达也有所下调,流式细胞术的结果也提示转染组心肌细胞跨膜表达的N-cadherin 增加。以上结果说明心肌细胞中ADAM10 对N-cadherin 的加工水解对N-cadherin 在细胞中的定位分布及钙-连复合体的形成有重要作用。黏附实验的结果表明转染组心肌细胞黏附能力明显提高,从而进一步明确了心肌细胞中ADAM10 对N-cadherin 的水解破坏了N-cadherin 分子的完整性,影响了钙-连复合体的形成,并引发了相应的病理生理改变。
[1] Matsuda T,Fujio Y,Nariai T,et al. N-cadherin signals through Rac1 determine the localization of connexin 43 in cardiac myocytes[J].J Mol Cell Cardiol,2006,40(40):495-502.
[2] Reiss K,Maretzky T,Ludwig A,et al. ADAM10 cleavage of N-cadherin and regulation of cell-cell adhesion and β-catenin nuclear signaling[J].EMBO J,2006,25(4):762-765.
[3] Zhou J,Qu J,Yi XP,et al. Upregulation of γ-catenin compensates for the loss of β-catenin in adult cardiomyocytes[J]. Am J Physiol Heart Circ Physiol,2007,292(1):H270-H276.
[4] Kostetskii I,Li J,Xiong Y,et al. Induced deletion of the N-cadherin gene in the heart leads to dissolution of the intercalated disc structure[J]. Circ Res,2005,96(3):346-354.
[5] Marabaoud P,Wen Ph,Dutt A,et al. A CBP binding transcriptional repressor produced by the PS1/epsilon-cleavage of N-cadherin and regulation of cell-cell adhesion and β-catenin nuclear signaling[J]. EMBO J,2005,24(4):742-752.
