QF-PCR技术在快速产前诊断常见非整倍体染色体异常中的应用*
2012-11-06滕奔琦王青青林俊伟叶燕绸侯红瑛
滕奔琦, 章 钧, 林 颖, 王青青, 林俊伟, 叶燕绸, 侯红瑛
(中山大学附属第三医院妇产科,广东 广州 510630)
1000-4718(2012)09-1644-07
2012-07-04
2012-08-27
广东省科技计划项目(No.2011B061200045);广州市科技计划项目(No.2010GN-E00221);广东省科技计划项目(No.2009B060700107)
△通讯作者Tel: 020-85252625; E-mail: tenben@tom.com
QF-PCR技术在快速产前诊断常见非整倍体染色体异常中的应用*
滕奔琦, 章 钧, 林 颖, 王青青, 林俊伟, 叶燕绸, 侯红瑛△
(中山大学附属第三医院妇产科,广东 广州 510630)
目的利用定量荧光PCR(QF-PCR)产前诊断常见非整倍体染色体异常。方法对95例羊水样本采用QF-PCR技术检测短串联重复序列(STR)的多态性信息含量(PIC),并将所得实验结果与染色体核型分析结果进行比较。结果QF-PCR检测发现95例羊水标本中正常63例,21三体14例(1例嵌合型,1例易位型),18三体4例,(45,X)3例,(47,XXX)8例;检测结果与染色体核型分析结果一致。QF-PCR检测结果的符合率为96.8%。结论QF-PCR可快速检测非整倍体染色体异常,并且结果可靠。
非整倍体; 短串联重复序列; 多态性信息含量
材 料 和 方 法
1标本来源
标本来源于2011年1月至2012年8月于我院符合产前诊断指征并行羊膜腔穿刺抽取羊水标本95例。羊膜腔穿刺抽取羊水方法:孕妇取仰卧位,确定穿刺位点,常规消毒铺巾,在B超探头引导下行羊膜腔穿刺,抽取羊水20 mL,其中18 mL用于羊水细胞培养染色体分析,2 mL用于QF-PCR检测。所有孕妇行羊膜腔穿刺前均已签署知情同意书。
2主要试剂和仪器
2.1主要试剂TaqDNA聚合酶和荧光素(FAM、HEX和TAMRA)购自Invotrigen;Qiagen DNA Mini Kit、PCR 反应缓冲液、dNTP和Mg2+购自Qiagen。
2.2主要设备 遗传分析仪(3100)、PCR扩增仪(9600)为ABI产品;染色体核型分析系统为上海北昂医疗技术有限公司产品;微量移液器为Finnpipette产品;高速离心机为上海安亭科学仪器厂产品。
3方法
3.1引物设计和合成 根据文献及Genomic Data Base,使用Primer 3.0设计PCR 引物。选取5条目标染色体上杂合率高、片段长度不一的STR位点共12个及1个性别标记位点AMXY。通过预实验,最终将13对引物分为2组,性染色体和21号染色体上的7对引物(D21S1435、D21S1411、D21S11;AMXY、DXS981、DX6809、X22)为1组,13和18号染色体6对引物(D13S631、D13S742、D13S634;DXS981D、18S535、D18S978、D18S977)为1组。性染色体和13号染色体引物的正义引物上加上荧光素FAM标记;21和18号染色体引物的正义引物上加上荧光素HEX标记。AMXY为性别标记位点,AMX:女性;AMX、AMY:男性;见表1。
高职院校学校层面建立的创客空间,要有效孵化来自理工文商等不同学科背景的大学生创新创业项目,培养大学生创新创业综合能力,客观上来讲值得进一步研究。高职院校大学生创新创业,在创业上关注过多,创新上关注较少。因此,本文从二级学院(系部)创办创客空间的角度出发,研究高职院校大学生创新创业人才培养路径。
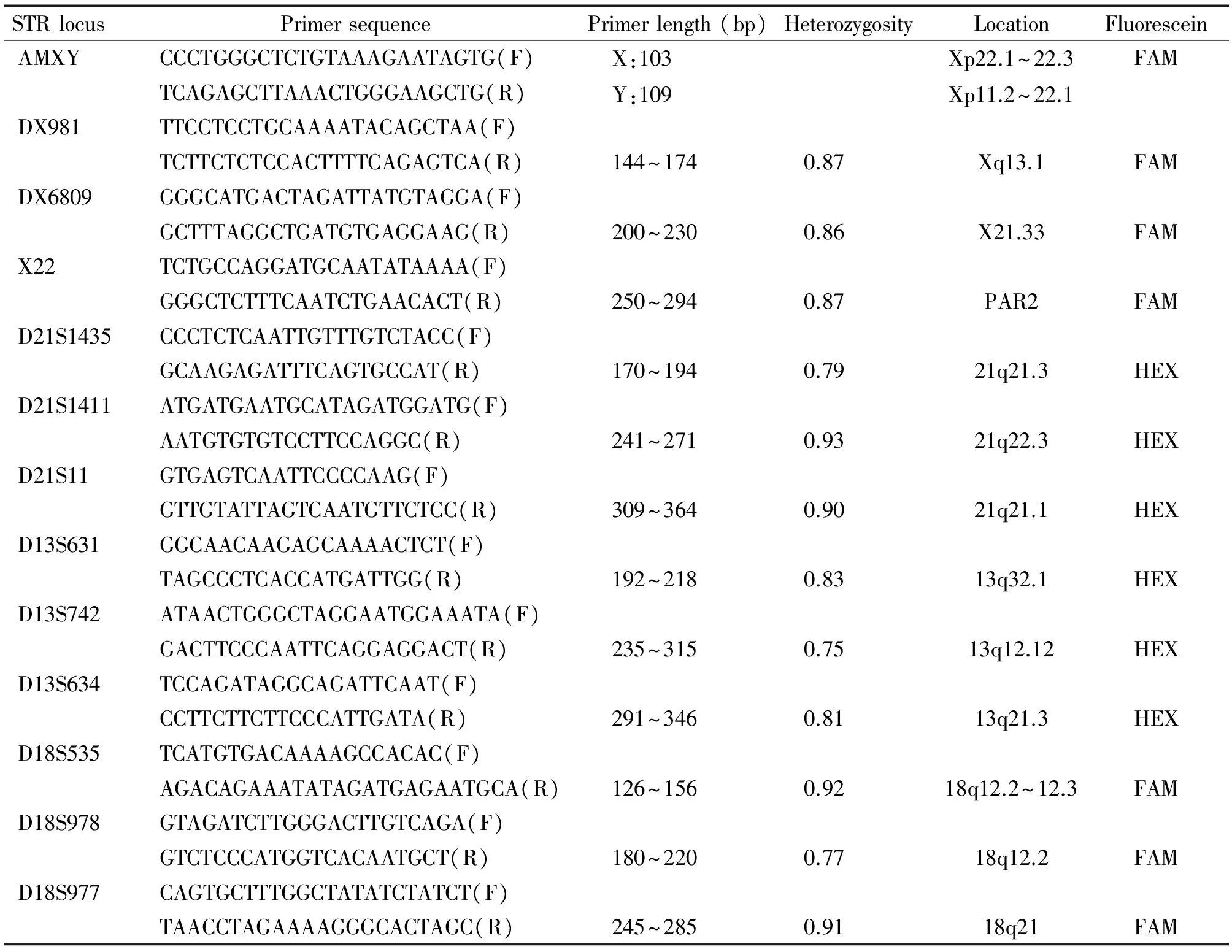
表1 12对STR位点及AMXY位点的引物序列
3.2PCR反应体系 10×PCR buffer (含Mg2+)2.5 μL;dNTP (2.5 mmol/L)2.0 μL;Primer Mix(10 μmol/L)根据多重PCR调整的引物剂量和浓度加入正向引物和反向引物。模板DNA 1.0 μL;Taq酶(5×106U/L)0.125 μL;加水(去离子灭菌水)至总体系25 μL。PCR反应条件:94 ℃预变性5 min,93 ℃30 s,60 ℃30 s,72 ℃ 30 s,40个循环,72 ℃7 min,4 ℃保存。
3.3多重荧光PCR产物检测 取去离子甲酰胺 9 μL与GS500 0.5 μL混合,再加入PCR产物 1 μL 放置PCR仪中98 ℃变性5 min,立即置于冰上5 min,转移至上机板上。将样本放入ABI 3100遗传分析仪的样品架中,设置相关参数,输入样品信息,POP4凝胶电泳30 min。最后通过GeneMaker 1.80软件系统进行定量分析。
3.4QF-PCR 非整倍体诊断的判断标准 根据国际公认的判断标准(ACC/CMGS best practice meeting was held on the 15th April, 2004),正常双峰面积比值(高峰面积∶矮峰面积)区间为:0.8~1.4,凡双峰面积比值>1.8或者<0.65,则可判定为三体,1个样本出现2个有意义位点方可明确诊断[1-2]。
4统计学处理

结 果
1正常核型羊水细胞QF-PCR检测结果
QF-PCR所选12个STR位点在66例核型正常胎儿中的PIC分别为:DXS981(0.815)、DX6809(0.741)、X22(0.658);D21S1435(0.667)、D21S1411(0.870)、D21S11(0.833);D18S535(0.759)、D18S978(0.759)、D18S977(0.704);D13S631(0.667)、D13S742(0.926)、D13S634(0.778)。在所选的12个STR位点中,9个STR位点PIC均较高,3个位点(X22、D21S1435和D13S631)的PIC稍低,见表2。
2非整倍染色体异常疾病的QF-PCR检测结果
QF-PCR检测95例羊水样本结果正常63例,Down综合征14例,Edwards综合征4例, Turner综合征3例,Klinefelter综合征8例。QF-PCR 诊断结果与染色体核型分析结果一致。异常结果STR位点扩增分析结果见表3、表4。结果判定:染色体上的任意STR位点出现3个等位基因荧光峰,峰值面积比值为1∶1∶1时,或者STR位点出现2个等位基因荧光峰,峰值面积比为2∶1或1∶2 或出现峰值面积未达到2∶1或1∶2,但<0.65 或者>1.8 时,诊断为非整倍体染色体异常。AMX 与AMY 面积比值接近1∶1,提示该胎儿为男性。其中1例Down综合征男性胎儿阳性样本的基因扫描图像见图1,经染色体核型分析结果为: 47,XY,+21,核型图见图2;1例Down综合征阴性样本的检测结果见图3,经染色体核型分析结果为: 46,XY,核型图见图4。
表2正常标本12个STR位点的检测结果


STRlocusHeterozygosityRatiooftwopeakareaamongheterozygotes95%CIDX9810.8151.175±0.1101.126~1.114DX68090.7401.160±0.8511.120~1.201X220.6851.165±0.1501.105~1.224D21S14350.6671.186±0.0771.160~1.212D21S14110.8701.088±0.1051.057~1.119D21S110.8331.136±0.1031.105~1.168D13S6310.6670.971±0.1110.932~1.009D13S7420.9261.094±0.0881.069~1.119D13S6340.7781.080±0.0651.061~1.101D18S5350.7591.143±0.1311.099~1.187D18S9780.7591.102±0.0831.075~1.129D18S9770.7041.113±0.0831.082~1.143
表3常染色体异常标本(21三体14例或18三体4例)6个STR位点检测结果
Table 3. The results of 6 STR loci in chromosome aneuploidies(14 cases of trisomy 21 and 4 cases of trisomy 18)

STRlocusThreepeaksTwopeaksSinglepeakRatioofpeakareaD21S14356802.083±0.162D21S14116621.970±0.136D21S116802.013±0.108D18S535202—D18S9782201.934±0.000D18S9770403.331±0.521
表4性染色体异常标本(47,XXX8例和45,X3例)4个STR位点检测结果
Table 4. The results of 4 STR loci in chromosome aneuploidies(sex chromosome)

STRlocus47,XXX45,XRatioofpeakareaThreepeaksTwopeaksSinglepeakSinglepeakAMXY08031.951±0.245S98104431.565±0.466S680904431.133±0.057X2204432.510±0.014
图1示1例Down综合征男性胎儿羊水标本的基因扫描图像,D21S1435呈现峰面积比例2∶1,D21S1411呈现峰面积比例2∶1,D21S11呈现三峰面积比例1∶1∶1。这3个位标均强烈提示胎儿为21三体综合征患者。AMX与AMY面积之比值接近1∶1,提示该胎儿为男性。经过染色体核型分析证实胎儿是21三体综合征男性患者,其核型分析结果是:47,XY,+21。

Figure 1. Typing of the DNA genescan of one of trisomy 21 syndrome fetus.The D21S11 (green, 309~364 bp) marker showed triallelic trisomic peaks. The D21S1435 (green, 170~194 bp) and D21S1411 (green, 241~271 bp) markers showed diallelic trisomic peaks. The X and Y chromosome-specific AMXY markers were amplified (blue, 101~109 bp).
图11例Down综合征阳性样本DNA基因扫描分型图

Figure 2. Chromosomal karyotype of one of trisomy 21 syndrome fetus.
图21例Down综合征阳性样本染色体核型图
图3示胎儿的AMX为单峰, 提示为女性胎儿。DX981、DX6809及X22均呈现2个面积比接近于2∶1的双峰,提示胎儿存在3条X染色体。据此预测胎儿同时存在3条X染色体, 核型为47, XXX。其它染色体上的各位标荧光峰均显示正常,经染色体核型分析证实,符合Jacobs综合征的诊断,见图4。
图5示胎儿的AMX为单峰,提示为女性胎儿。DX981、DX6809及X22均呈现单峰,提示仅1个X染色体的存在。据此预测胎儿核型为45,X。其它染色体上的各位标荧光峰均显示正常,经染色体核型分析证实,符合45,X单体综合征的诊断。
3QF-PCR技术的检测结果与染色体核型分析结果的比较
95例羊水标本均成功进行QF-PCR检测,发现正常63例,21三体14例,18三体4例,X单体3例,三体(47,XXY)8例。上述检测结果与染色体核型分析结果一致。但2例核型为46,XX的X染色体上的3个STR位点及1例核型为46,XX的18号染色体上的3个STR位点出现纯合子的情况,QF-PCR方法对其诊断出现信息量不足的情况,导致结果无法判断。95例羊水标本行染色体核型分析均成功,发现66例为正常核型,14例为21三体,其中包括嵌合型1例,核型为46,XY,der(21:21)(46.7%)/46,XY(53.3%),易位型1例,核型为46,XY,-14,+t(14q21q),18-三体4例,(45,X)3例,(47,XXY)8例。QF-PCR检测结果的符合率96.8%;对于21、18、13、X 及Y 染色体非整倍体的检出率为100%,假阳性率为0,假阴性率0,见表5。

Figure 3. Typing of the DNA genescan of one of Jacobs syndrome (47,XXX) fetus.The AMX showed monosomic peak (blue, 102 bp). The DX981 (blue, 144~174 bp), the DX6809 (blue, 200~230 bp) and the X22 (blue, 250~294 bp) markers showed diallelic trisomic peaks.
图31例Jacobs综合征(47,XXX)阳性样本DNA基因扫描分型图

Figure 4. Chromosomal karyotype of one of Jacobs syndrome (47,XXX) fetus.
图41例Jacobs综合征(47,XXX)阳性样本染色体核型图

Figure 5. Typing of the DNA genescan of one of Turner syndrome (45,X) fetus.The AMX (blue, 102.3 bp), the DX981 (blue, 160.6 bp), the DX6809 (blue, 209.3 bp) and the X22 (blue, 302.9 bp) markers showed monosomic peak.
图51例Turner综合征(45,X)阳性样本DNA基因扫描分型图

Figure 6. Chromosomal karyotype of one of Turner syndrome (45,X) fetus.
图61例Turner综合征(45,X)阳性样本染色体核型图
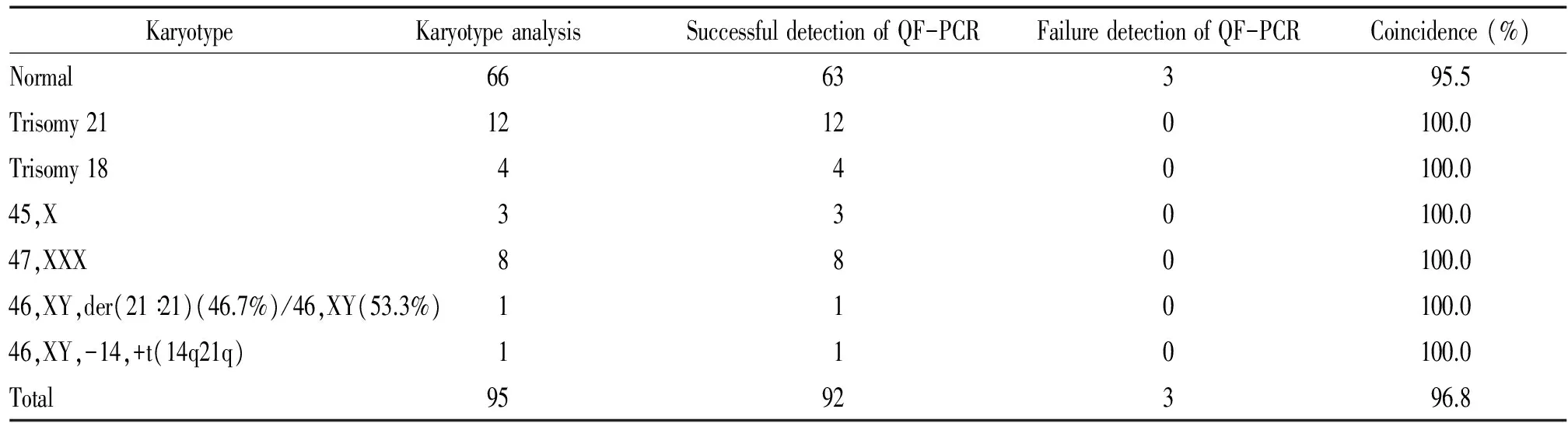
表5 QF-PCR技术的检测结果与染色体核型分析结果
4妊娠结局随访
14例21三体及4例18三体胎儿在QF-PCR检测发现异常后,均于抽取羊水后1周内住院引产, 引产后取胎儿皮肤组织再次行QF-PCR检测及染色体核型分析,均与产前诊断结果相符。66例羊水染色体核型正常的孕妇均妊娠至34周后分娩,新生儿未见明显异常。
讨 论
QF-PCR是一种通过对STR进行扩增,以对染色体拷贝数目异常进行快速产前诊断的方法。QF-PCR 应用了光谱技术与计算机技术相结合,其优点主要表现在高敏感性、高特异性、高精确性、高效性等方面。STR遗传多态性可用杂合度和多态信息量等指标来衡量, 多态信息量大于0.5, 表明遗传标记可提供高度的遗传信息[3]。多态位点的基因频率、杂合度、多态信息含量等参数因样本来源、群体不同而有差异。本实验所选用的9个STR位点DXS981、DX6809、D21S1411、D21S11、D18S535、 D18S978、D18S977、D13S634和D13S742的PIC均较高,3个位点(X22、D21S1435和D13S631)的PIC稍低,但均在0.5以上, 表明本实验所选取的STR位点基本上可提供高度的遗传信息。
在实际操作中1个正常的二倍体细胞的2个等位基因中的一个会被优先扩增, 并随着反应的进行被优先扩增的产物也被用作模板过度表达[4],所以在本实验结果中显示的等位基因峰面积比值并不完全是1∶1,比值范围在0.97~1.18 之间,与文献报道的正常杂合二倍体每一检测位点双峰面积比值一般在0.8~1.4的范围相符合[5]。
本研究使用D21S1435、D21S1411、D21S11等新位点对14例21三体、4例18三体、3例X单体和8例X三体(47,XXX)进行检测。通过3~4个位点的结合检测, 检出率高达100%。文献报道使用4个以上位点结合检测21三体才可达100%。因此,上述位点可被用于常见非整倍体染色体异常的快速产前诊断。
本研究中95份羊水标本经QF-PCR技术扩增成功,所有结果均在48 h内得出,其中所有染色体核型分析正常的样本用QF-PCR检测均无染色体数目异常,21、18、13、X 及Y五种染色体非整倍体用QF-PCR 技术均可全部检出,无假阳性。本研究结果表明QF- PCR 技术在检测这五种非整倍体上敏感性和特异性均为100%,与核型分析比较快速、成本低、所需样本量少、自动化程度高、操作简便及适合大规模应用,所以QF-PCR可作为核型分析培养失败的一个补充。
本研究发现2例性染色体3个STR位点为纯合子及1例18号染色体上3个STR位点均为纯合子的标本,QF-PCR技术对其诊断出现信息量不足的情况,这主要是因为染色体上的特异性STR位点数选用少的原因,可以通过增加STR检测位点来解决。本实验中1例嵌合型21三体,嵌合比例46.7%,被准确检测出。QF-PCR技术对于嵌合体的检测存在一定的局限性。应用QF-PCR方法目前仅能检出包括常见非整倍体异常, 尚不能检出染色体平衡易位及异常核型<15%三体细胞或<20%单体细胞存在时嵌合体[6]。QF-PCR 检测结果还会受到检测位点选择、STR 位点杂合度等因素的影响, 因此在临床项目开展中要考虑到QF-PCR方法的上述局限性。在患者来源上主要选择对单纯唐氏高风险和高龄人群的产前诊断上[7-8]。而存在超声异常的胎儿患染色体病的可能性较无超声异常者明显增加,可能存在分子学方法检测不到的染色体异常[9-10]。
随着QF-PCR技术的不断完善和研发,快速产前诊断的不断发展, 临床实践中将会有更多有价值的遗传标记被发掘出来。
[1] Tong D, Sun H, Gao F, et al. Polymorphism analysis of 15 STR loci in a large sample of the Han population in southern China[J]. Forensic Sci Int Genet, 2009, 4(1): 27-29.
[2] Jain S, Panigrahi I, Sheth J, et al. STR markers for detecting heterogeneity in Indian population[J]. Mol Biol Rep, 2012, 39(1):461-465.
[3] Armstrong RN, Colyer HA, Mills KI, et al. Screening for miRNA expression changes using quantitative PCR (Q-PCR) [J]. Methods Mol Biol,2012,863(3): 293-302.
[4] 李红娟, 石 为, 卢翔云, 等. 用高通量实时荧光PCR技术研究低浓度MNNG诱发的细胞基因应答反应[J]. 中国病理生理杂志, 2007, 23( 1): 1-6.
[5] Chen CP, Huang HK, Su YN, et al. Trisomy 7 mosaicism at amniocentesis: interphase FISH, QF-PCR, and aCGH analyses on uncultured amniocytes for rapid distinguishing of true mosaicism from pseudomosaicism[J]. Taiwan J Obstet Gynecol, 2012, 51(1):77-82.
[6] Jain S, Panigrahi I, Gupta R, et al. Multiplex quantitative fluorescent polymerase chain reaction for detection of aneuploidies[J]. Genet Test Mol Biomarkers, 2012, 16(6): 624-627.
[7] Langlois S, Duncan A. Use of a DNA method, QF-PCR, in the prenatal diagnosis of fetal aneuploidies[J].J Obstet Gynaecol Can, 2011, 33(9): 955-960.
[8] McClelland LS, Allen SK, Larkins SA, et al. Implementation and experience of an alternative QF-PCR and MLPA diagnostic strategy to detect chromosomal abnormalities in fetal and neonatal pathology samples[J]. Pediatr Dev Pathol, 2011, 14(6):460-468.
[9] Holgado E, Liddle S, Ballard T, et al. Incidence of placental mosaicism leading to discrepant results between QF-PCR and karyotyping in 22,825 chorionic villus samples[J]. Prenat Diagn, 2011, 31(11):1029-1038.
[10] Atef SH, Hafez SS, Mahmoud NH,et al. Prenatal diagnosis of fetal aneuploidies using QF-PCR: the egyptian study[J].J Prenat Med, 2011, 5(4):83-89.
QuantitativefluorescencePCRforrapidprenataldiagnosisofcommonchromosomeaneuploidies
TENG Ben-qi, ZHANG Jun, LIN Ying, WANG Qing-qing, LIN Jun-wei, YE Yan-chou, HOU Hong-ying
(DepartmentofObstetricsandGynecology,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:tenben@tom.com)
AIM: To evaluate the effectiveness of quantitative fluorescence PCR (QF-PCR) as a method for rapid prenatal diagnosis of common chromosome aneuploidyies.METHODSPolymorphism information contents (PIC) of each short tandem repeat (STR) in 95 cases of amniotic fluid samples were detected by QF-PCR and the data were compared with the results of routine chromosome karyotype analysis.RESULTSThe results of QF-PCR included 63 normal samples and 14 trisomy 21, 4 trisomy 18, 3 (45, X) and 8 (47, XXX). The rapid QF-PCR assay was successful to detect all aneuploidies involving chromosomes 21, 18, 13, X and Y in prenatal diagnosis, which were verified by chromosome karyotype analysis. The results showed that the total coincidence rate between QF-PCR and routine chromosome karyotype analysis was 96.8%.CONCLUSIONThe QF-PCR is a reliable method of detecting common chromosome aneuploidies for rapid prenatal diagnosis.
Aneuploidy; Short tandem repeat; Polymorphism information content
R363
A
10.3969/j.issn.1000-4718.2012.09.019
