肝纤维化病理过程中ZEB1和ZEB2的动态表达变化及意义*
2012-11-06谢汝佳张成俊程明亮
韩 冰, 谢汝佳, 洪 琴, 张成俊, 杨 勤, 程明亮
(贵阳医学院病理生理教研室,贵州 贵阳 550004)
1000-4718(2012)09-1639-05
2012-03-23
2012-07-25
贵州省科技国际合作项目(No.黔科合G字【2011】7013号)
△通讯作者 Tel:0851-6908578;E-mail:hanbing791203@163.com
肝纤维化病理过程中ZEB1和ZEB2的动态表达变化及意义*
韩 冰△, 谢汝佳, 洪 琴, 张成俊, 杨 勤, 程明亮
(贵阳医学院病理生理教研室,贵州 贵阳 550004)
目的观察慢性肝损伤致肝纤维化过程中上皮-间质转化(EMT)调节蛋白锌指E盒结合同源盒蛋白(ZEB)1和ZEB2的动态表达变化并探讨其调节机制。方法雄性Wistar大鼠40只,随机分为正常对照组、2周、4周、6周和8周模型组,每组各8只,模型组按3 mL/kg体重的剂量皮下注射60%CCl4,每隔3 d注射1次,处死大鼠后测定肝脏指数、血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性,观察肝组织病理改变;免疫组织化学法检测肝组织中ZEB1、ZEB2、E-钙黏蛋白(E-cadherin)和α-平滑肌肌动蛋白(α-SMA)的表达情况;real-time RT-PCR方法检测肝脏组织中ZEB1及ZEB2 mRNA的表达变化。结果模型各组大鼠肝脏指数、血清ALT和AST活性显著高于正常对照组(P<0.01),8周模型组肝纤维化明显;随着肝脏损伤逐渐加重,纤维化程度加深,E-cadherin蛋白的表达显著降低,α-SMA蛋白表达显著升高,ZEB1和ZEB2蛋白和mRNA表达量也逐渐增加,8周模型组肝组织中ZEB1和ZEB2蛋白(46.42±14.36和57.71±13.32)与mRNA(189.00±47.39和277.28±48.55)表达较正常组显著增加(P<0.01)。结论ZEB1和ZEB2蛋白及mRNA表达量随纤维化程度的加重而增加,提示EMT可能通过ZEB1和ZEB2参与肝纤维化的发生发展。
肝纤维化; 慢性肝损伤; 锌指E盒结合同源盒蛋白
锌指E盒结合同源盒蛋白(zinc finger E-box binding homeobox protein,ZEB)是一类具有锌指结构的蛋白,包含2个成员ZEB1和ZEB2,ZEB2又称Smad相互作用蛋白1(Smad-interacting protein 1,SIP1),由于都具有相同锌指结构而能与含有CACCT的E-box序列和CACCT(G)的E-box相似序列结合,进而调控靶基因的表达。目前已知ZEB1和ZEB2能与上皮细胞内的E钙黏蛋白(E-cadherin)基因的启动子序列中的E-box(CACCTC/G)序列结合而抑制其转录,从而促进上皮-间质转化(epithelial-mesenchymal transition,EMT)的发生[1]。EMT是指原本紧密排列的上皮细胞在某种因素的作用下转化成间质细胞的过程。近年的研究发现,EMT除与肺纤维化和肾间质纤维化发病机制有关外[2-3],还参与了肝纤维化发生发展。但目前有关EMT通过其调控因子ZEB1和ZEB2参与调控慢性肝损伤及肝纤维化发病机制的研究鲜有报道。因此,本研究通过大鼠慢性肝损伤致肝纤维化模型,观察慢性肝损伤发生致肝纤维化形成过程中,肝组织中ZEB1、ZEB2、E-cadherin和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的动态表达变化,探讨慢性肝损伤及肝纤维化发病过程中肝脏EMT变化特点及其通过ZEB1和ZEB2调控其发生发展的可能机制。
材 料 和 方 法
1材料
1.1动物与主要试剂 清洁级雄性Wistar大鼠40只,体重(200±20)g,购自贵阳医学院动物实验中心, ZEB1、ZEB2、E-cadherin和α-SMA多克隆抗体购自北京博奥森生物试剂公司;免疫组化EnvisionⅡ抗检测试剂盒购自Gene;TRIzol购自Invitrogen,逆转录试剂盒购自Fermentas,SYBR Green购自Applied Biosystems,ZEB1和ZEB2的引物由TaKaRa公司代为设计合成。
1.2模型制备与分组 实验动物适应性喂养1周后,随机分成4组,每组8只,按3 mL/kg体重的剂量皮下注射60%CCl4,每隔3 d注射1次,同时正常饲料喂养,分别于喂养2周、4周、6周、8周后处死;另设正常对照组,共8只大鼠,给予正常饲料喂养,按3 mL/kg体重的剂量皮下注射生理盐水每隔3d注射1次,分别于2周、4周、6周、8周各处死2只;所有处死大鼠收集血液及肝脏标本待测相关指标。
2方法
2.1计算肝脏指数 肝脏指数=肝脏重量(mg)/体重(g)。
2.2血清生化指标检测 血清丙氨酸氨基转移酶 (alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测采用Siemens Advia 1650全自动生化分析仪测定。
2.3病理学观察 取同一部位肝叶,常规石蜡包埋切片,行HE及Van Gieson(VG)染色,光镜下观察肝脏病理变化,参照纤维化分级法[4]进行胶原纤维增生程度半定量分析。
2.4肝组织ZEB1、ZEB2、E-cadherin和α-SMA蛋白表达检测 采用Envision两步法按照试剂盒说明操作。阴性对照以PBS液代替I抗。结果判定:ZEB1、ZEB2和α-SMA光镜下观察胞浆染成棕黄色的细胞为阳性,E-cadherin光镜下观察胞核染成棕黄色的细胞为阳性。400倍下观察不少于5个高倍镜视野,记数阳性细胞个数并计算阳性细胞所占百分比(使用Olympus Image-Pro Plus图像分析软件系统完成:采集400倍视野下5张图片,然后通过软件统计每张图片上的阳性细胞数并计算阳性百分率)。
2.5肝组织ZEB1和ZEB2 mRNA表达量检测 采用实时荧光定量RT-PCR的方法检测,用TRIzol提取大鼠肝脏的总RNA,随后采用紫外分光光度法进行质量控制及确定浓度。各取1μg总RNA为逆转录模板,使用ZEB1、ZEB2特异性逆转录引物进行逆转录反应,反应条件为:25 ℃ 10 min; 48 ℃ 60 min; 95 ℃ 5 min。实时荧光定量PCR反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40 个循环。PCR 反应在实时定量PCR 仪进行检测, 以β-actin作为内参照,2-ΔΔCt为目的基因的相对表达强度,所有样本均重复3孔。具体引物序列如下:β-actin上游引物5’-GAGAGGGAAATCGTGCGTGAC-3’,下游引物5’-CATCTGCTGGAAGGTGGACA-3’;ZEB1 上游引物5’-TGGCAAGACAACGTGAAAGA-3’,下游引物5’-AACTGGGAAAATGCATCTGG-3’;ZEB2 上游引物 5’-TAGCCGGTCCAGAAGAAATG-3’,下游引物5’-GGCCATCTCTTTCCTCCAGT-3’。
3统计学处理

结 果
1各组大鼠肝脏指数、血清ALT和AST活性的变化
模型组2周组大鼠肝脏指数均高于正常组大鼠(P<0.05);4周组、6周组和8周组大鼠肝脏指数均显著高于正常组大鼠(P<0.01);模型各组大鼠血清AST和ALT活性均较正常组大鼠显著增加(P<0.01),见表1。
表1各组大鼠肝脏指数、血清ALT和AST活性

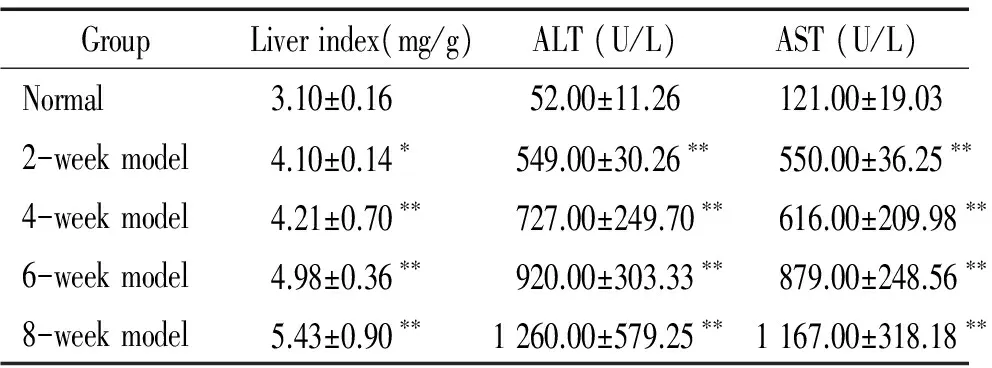
GroupLiverindex(mg/g)ALT(U/L)AST(U/L)Normal3.10±0.1652.00±11.26121.00±19.032-weekmodel4.10±0.14∗549.00±30.26∗∗ 550.00±36.25∗∗4-weekmodel4.21±0.70∗∗727.00±249.70∗∗ 616.00±209.98∗∗6-weekmodel4.98±0.36∗∗920.00±303.33∗∗ 879.00±248.56∗∗8-weekmodel5.43±0.90∗∗1260.00±579.25∗∗ 1167.00±318.18∗∗
*P<0.05,**P<0.01vsnormal group.
2肝脏病理变化
各组大鼠肝组织经HE及VG染色,光镜下可见正常组大鼠肝细胞以中央静脉为中心呈放射状排列,无胶原纤维增生;模型2周组大鼠肝细胞内可见大小不一脂肪滴,部分气球样变,呈脂性肝炎表现;模型4周组大鼠肝细胞脂肪样变明显,可见部分空泡样变,以微泡型为主,少数细胞为大泡型改变,少量汇管区可见纤维结缔组织轻度增生;模型6周组大鼠肝细胞以大泡型脂肪变明显,汇管区可见较多纤维结缔组织增生,少量炎性细胞浸润,假小叶形成不明显;模型8周组大鼠肝细胞脂肪样变严重,呈广泛大泡型改变,肝小叶结构破坏,肝索排列紊乱,汇管区纤维结缔组织大量增生,内有较多炎性细胞浸润,胶原纤维形成纤维间隔,可见假小叶形成。病理学半定量结果显示,模型2周组病理改变与正常组相比差异无统计学意义,模型4周组病理学改变与正常组相比差异有统计学意义(P<0.05),模型6周和8周组病理学改变与正常组相比有明显差异(P<0.01),说明纤维化变明显,见图1、表2。

Figure 1. HE staining of rat hepatic tissues in each group (×400).A:normal group; B:2-week model group; C: 4-week model group; D: 6-week model group; E:8-week model group.
图1各组大鼠肝组织HE染色结果
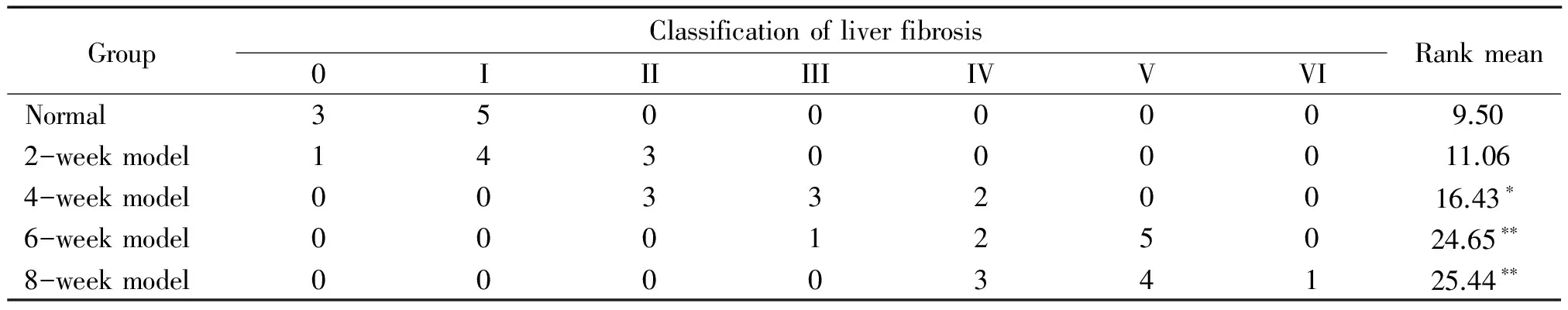
表2 各组大鼠肝纤维化程度分级
*P<0.05,**P<0.01vsnormal group.
3肝组织E-cadherin和α-SMA蛋白表达的变化
正常对照组大鼠肝组织未见α-SMA蛋白阳性表达,而E-cadherin蛋白则广泛表达于正常对照组大鼠肝细胞,光镜下可见细胞核染色棕黄;α-SMA蛋白随着模型组大鼠肝脏肝损伤程度的加重及肝纤维化的发生而表达逐渐增加,在模型4周、6周、8周组大鼠肝组织中α-SMA蛋白表达于部分肝细胞及大量纤维间隔,较空白对照组表达明显增加(P<0.01);E-cadherin蛋白在肝细胞胞核内随着肝损伤及纤维化程度的加重而表达明显减少,模型6周和8周组E-cadherin蛋白仅在组织部分结构相对完好区域的部分肝细胞内见少量表达,较正常对照组显著降低(P<0.01),见图2、表3。
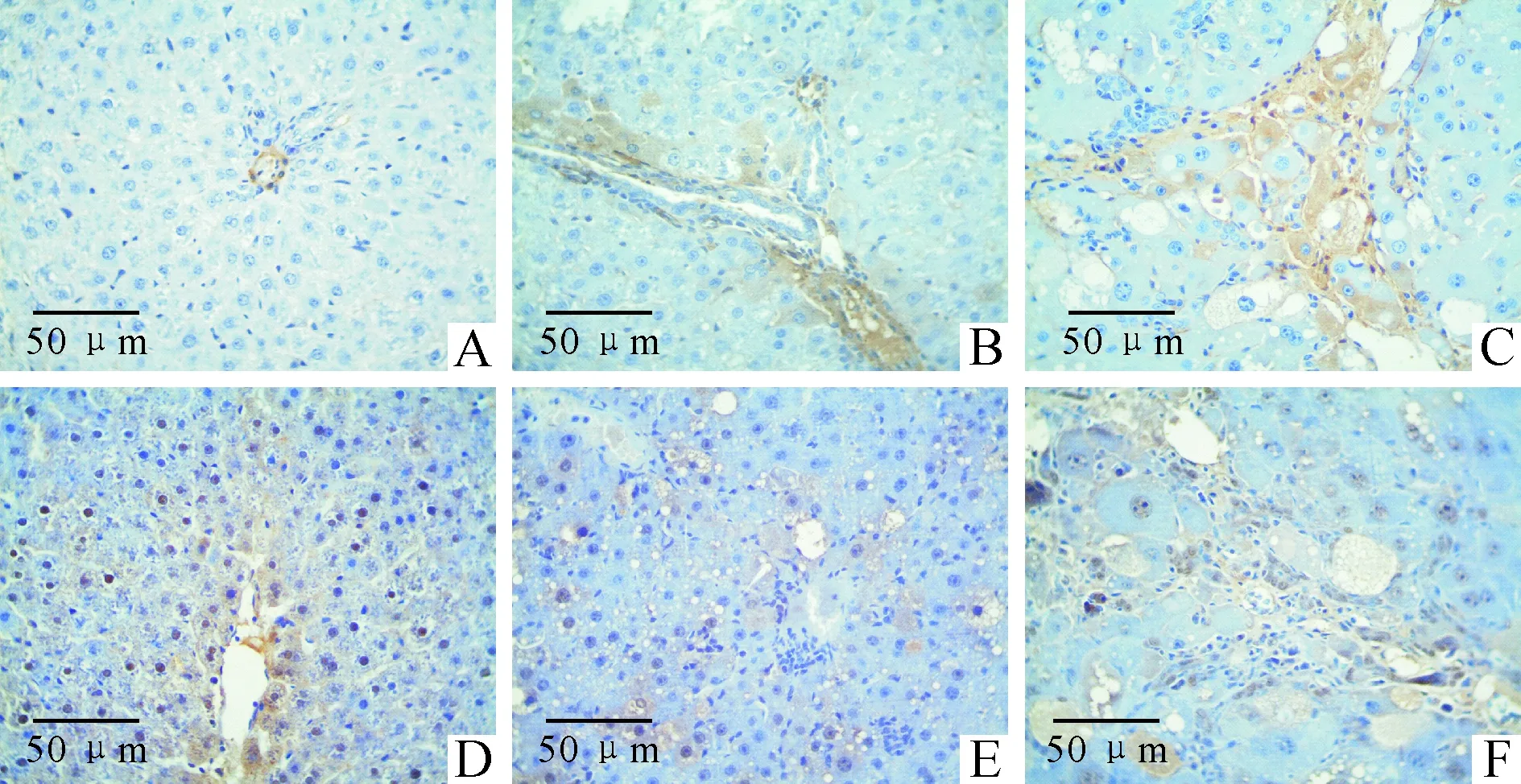
Figure 2. Expression of α-SMA and E-cadherin in rat hepatic tissue of each group.A:normal group(α-SMA); B:4-week model group (α-SMA); C: 8-week model group (α-SMA); D: normal group (E-cadherin); E: 4-week model group (E-cadherin); F: 8-week model group (E-cadherin).
图2各组大鼠肝组织α-SMA和E-cadherin免疫组化结果
表3各组大鼠肝脏中α-SMA和E-cadherin的表达


Groupα-SMAE-cadherinNormal1.72±0.0690.48±4.922-weekmodel2.17±0.1886.28±6.354-weekmodel7.88±0.25∗∗82.11±7.286-weekmodel19.78±4.28∗∗24.37±3.25∗∗8-weekmodel37.84±7.04∗∗19.52±4.25∗∗
**P<0.01vsnormal group.
4各组大鼠肝组织ZEB1和ZEB2蛋白及mRNA表达变化
正常对照组ZEB1/ZEB2蛋白表达较少,模型2周和4周组ZEB1和ZEB2蛋白及mRNA表达量较
正常对照组有所升高,但无显著差异;而模型6周和8周组大鼠肝组织中可见ZEB1/ZEB2蛋白广泛在小叶内气球样变的肝细胞及纤维化的肝细胞胞浆中,呈强阳性表达,色棕黄色,mRNA表达量也相应升高,与正常对照组表达量存在显著差异(P<0.01),见图3、表4。
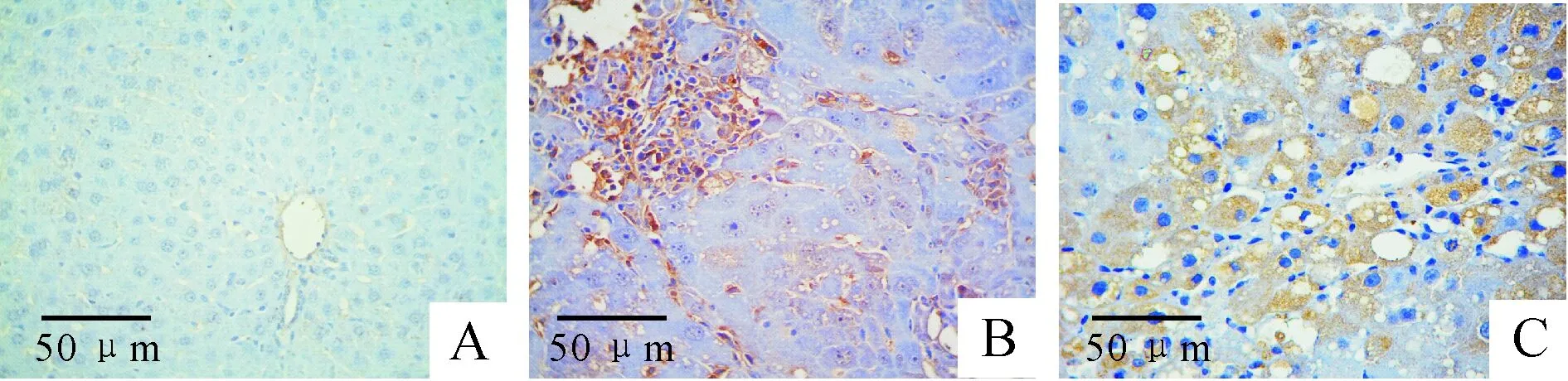
Figure 3. Expression of ZEB1/ZEB2 in rat hepatic tissue of each group. A:normal group; B: 8-week model group (ZEB1); C: 8-week model group (ZEB2).
图3各组大鼠肝组织ZEB1和ZEB2免疫组化结果

表4 各组大鼠肝脏中ZEB1/ZEB2蛋白和mRNA的表达
**P<0.01vsnormal group.
讨 论
EMT是指上皮实质细胞向间质细胞的转化,也就是上皮细胞失去其上皮表型特征而逐渐获得间质细胞表型特征的过程[5]。纤维化被认为是器官受到慢性损伤时的一种创伤愈合过程,在正常生理情况,如果损伤愈合,由于炎症逐渐减弱,EMT也会随之停止,从而完成修复过程;但是如果炎症不断刺激,使EMT持续存在,则可生成过量肌成纤维细胞(MFLC),产生过多细胞外基质,便会导致器官纤维化[5-6]。本研究通过CCl4复制慢性肝损伤致肝纤维化模型,观察病程演变过程中EMT动态变化。通过对上皮标志蛋白E-cadherin及间质标志蛋白α-SMA在各组大鼠肝脏组织中动态变化的观察,发现随着肝损伤及肝纤维化程度的加重,E-cadherin呈表达逐渐减少趋势,α-SMA表达则呈明显增加趋势,特别是模型8周组大鼠肝脏组织中E-cadherin及α-SMA表达皆与正常对照组有显著差异。因此实验结果表明在肝纤维化形成过程中,上皮细胞标志蛋白表达逐渐减少而间质细胞特征蛋白表达逐渐增多,提示EMT参与了慢性肝损伤及肝纤维化的发生发展过程,并且随着损伤程度的加重EMT的作用也相应加强。
虽然有研究表明,人转化生长因子β(transforming growth factor β,TGF-β)和Wnt等信号蛋白可诱导EMT的发生,但是其介导EMT在纤维化中的作用却不甚明了,考虑和具体的组织器官及其所处的微环境有关[7-8]。在肝纤维化研究中发现,静息肝星状细胞转化为肌成纤维细胞的过程类似EMT[9]。有学者研究了不同来源的肌成纤维细胞样肝星状细胞,发现它们均共同表达间质及上皮祖细胞标志[10]。除了肝星状细胞之外,成纤维细胞和上皮细胞的EMT以及骨髓来源的干细胞也发挥了重要作用[9]。Dooley等[11]研究表明肝细胞可被TGF-β1/Smad信号通路激活发生EMT,并表达I型胶原蛋白,提示肝细胞的EMT与肝纤维化密切相关。虽然目前肝纤维化中EMT的正向调控机制尚不清楚,但是由于E-cadherin表达的下降和缺失是EMT最重要的生物学特征,因此通过调解E-cadherin表达而参与EMT的调节机制成为研究热点。ZEB1和ZEB2能通过与E-cadherin基因启动子上的CACCT(G)序列结合抑制其表达,导致上皮细胞失去其表型特征转化成为间质细胞,导致EMT的发生[12]。ZEB1可抑制多种重要的上皮分化和细胞黏附因子,包括细胞极性基因Crumbs3(Crb3)、HUGL2(human lethal giant larvae homologue 2)和Pals1(protein associated with Lin seven 1)相关的紧密连接蛋白,从而抑制E-cadherin,诱发EMT[13]。本研究在观察慢性肝损伤致肝纤维化过程中EMT动态变化的同时,还观察了在各组大鼠肝脏组织中ZEB1、ZEB2蛋白及mRNA表达量的变化,结果提示ZEB1、ZEB2在蛋白和基因水平随着慢性肝损伤的发生及肝纤维化的形成,表达量也相应增加,表达变化趋势与E-cadherin的变化趋势相反,进一步验证ZEB家族可通过抑制E-cadherin的表达而促进EMT的发生发展。本课题组前期的研究已发现CCl4可引发大鼠肝细胞TGF-β/Smad信号通路的激活,而ZEB家族已被证实与如TGF-β/ Smad、MAPK等多条参与肝纤维化发生发展的信号通路存在相互调节关系,因此我们推测在肝纤维化发生过程中,肝细胞EMT发生的可能机制是TGF-β/Smad信号通路激活ZEB1和ZEB2表达,ZEB1和ZEB2进一步抑制肝细胞表达E-cadherin,促进肝细胞发生EMT转化为成纤维细胞,进而表达间质细胞特征蛋白α-SMA等,同时转化产生的肌成纤维细胞表达大量的细胞外基质如Ⅰ型胶原蛋白,导致细胞外基质沉积最终导致肝纤维化发生。因此探明ZEB家族蛋白在肝纤维化发生机制中的作用,对阐明EMT与肝纤维化发生发展及相互调节关系有重要作用,其具体调节机制正在后续研究中。
[1] Naganuma S, Ohashi S, Kimura S,et al.ZEB1 and ZEB2 promote EMT and invasion in esophageal squamous cell carcinoma[J].Cancer Res, 2010, 70(8 Suppl 1): 2293.
[2] 徐西振, 郑常龙, 凃 玲,等. 银杏叶提取物对转化生长因子β1诱导的人肾小管上皮细胞转分化的影响及其机制[J].中国病理生理杂志,2008,24(11):2235-2238.
[3] Park SH,Choi MJ,Song IK,et al. Erythropoietin decreases renal fibrosis in mice with ureteral obstruction: role of inhibiting TGF-β-induced epithelial-to-mesenchymal transition[J].J Am Soc Nephrol, 2007,18(5): 1497-1507.
[4] 温静静,谢汝佳,韩 冰,等.肝纤维化大鼠肝细胞内质网形态及GRP78表达的研究[J]. 中国病理生理杂志,2011,27(11):2210-2213.
[5] Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J].J Clin Invest, 2009, 119(6):1420-1428.
[6] Kalluri R.EMT:when epithelial cells decide to become mesenchymal-like cells[J].J Clin Invest,2009,119(6):1417-1419.
[7] Acloque H, Adarns MS, Fishwick K,et al. Epithelial-mesenchymal transitions:the importance of changing cell state in development and disease[J].J Clin Invest,2009,119(6):1438-1449.
[8] Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions[J].J Clin Invest,2009,119(6):1429-1437.
[9] Choi SS,Omenetti A,Witek RP, et al.Hedgehog pathway activation and epithelial-mesenchymal transitions during myofibroblastic transformation of rat hepatic cells in culture and cirrhosis[J]. Am J Physiol Gastrointest Liver Physiol,2009,297(6):G1093-G1096.
[10]Sicklick JK,Choi SS,Bustamante M,et al.Evidence for epithelial-mesenchymal transitions in adult liver cells[J]. Am J Physiol Gastrointest Liver Physiol, 2006,291(4):G575-G583.
[11]Dooley S, Hamzavi J, Ciuclan L, et al. Hepatocytespecific Smad7 expression attenuates TGF-β-mediated fibrogenesis and protects against liver damage [J]. Gastroenterology, 2008, 135(2):642-659.
[13]Aigner K,Dampier B,Descovich L,et al.The transcription factor ZEBl(δEFl) promotes tumour cell dedifferentiation by repressing master regulators of epithelial polarity[J].Oncogene,2007,26(49):6979-6988.
DynamicchangesofZEB1andZEB2duringdevelopmentofliverfibrosisinducedbychronicliverinjuryinrats
HAN Bing, XIE Ru-jia, HONG Qin, ZHANG Cheng-jun, YANG Qin, CHENG Ming-liang
(DepartmentofPathophysiology,GuiyangMedicalCollege,Guiyang550004,China.E-mail:hanbing791203@163.com)
AIM: To observe the dynamic changes of zinc finger E-box binding homeobox 1 (ZEB1) and zinc finger E-box binding homeobox 2 (ZEB2) during the development of liver fibrosis induced by chronic liver injury in rats.METHODSForty male Wistar rats weighing 180~220 g were divided intonormal control group and 4 model groups. The rats in model groups were induced by hypodermic injection of CCl4at a dose of 3 mL/kg and once per 3 days for 2 weeks, 4 weeks, 6 weeks and 8 weeks, respectively. The liver index and serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were analyzed. The liver fibrosis was observed under microscope. Additionally, the expression of ZEB1, ZEB2, E-cadherin and α-smooth muscle actin(α-SMA) SMA at protein level was determined by immunohistochemistry. The mRNA expression of ZEB1 and ZEB2 was detected by real-time RT-PCR.RESULTSThe liver index and the serum levels of ALT and AST in the 4 model groups were obviously higher than those in normal control group. The apparent liver fibrosis was observed in 8-week model group. The protein levels of α-SMA (37.84±7.04), ZEB1 (46.42±14.36) and ZEB2(57.71±13.32), and mRNA expression of ZEB1 (189.00±47.39) and ZEB2 (277.28±48.55) in the livers of 8-week model rats were obviously higher than those in the control rats (P<0.01). The protein level of E-cadherin in the liver of 8-week model rats was obviously lower than that in the control rats (P<0.01).CONCLUSIONIn the process of liver fibrosis induced by CCl4, the obvious changes of ZEB1/ZEB2 may play an important role in chronic liver injury and liver fibrosis.
Liver fibrosis; Chronic liver injury; Zinc finger E-box binding homeobox protein
R363
A
10.3969/j.issn.1000-4718.2012.09.018
