钙敏感受体通过PI3K 信号通路介导缺氧诱导的大鼠肺动脉平滑肌细胞增殖*
2012-12-23李光伟康美佳徐斐翔邢文婧徐长庆
李光伟, 李 波, 康美佳, 徐斐翔, 邢文婧, 徐长庆,4△
(1齐齐哈尔医学院病理生理教研室,黑龙江 齐齐哈尔161006;2哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨150086;3齐齐哈尔市第一医院胸心外科,黑龙江 齐齐哈尔161006;4黑龙江生物医药工程重点实验室,黑龙江 哈尔滨150081)
肺动脉高压(pulmonary arterial hypertension,PAH)被称为“心血管系统的恶性肿瘤”,其临床症状不典型,误诊率高,一旦丧失早期诊断和治疗的机会,大部分患者将在2 ~3 年内死于心力衰竭[1]。慢性阻塞性肺疾病在我国北方地区十分常见,最终发展成肺源性心脏病,严重影响人们的健康和生存质量。肺动脉高压是导致肺心病的重要机制,因此,肺动脉高压和肺心病的早期诊断和有效防治具有重要的临床意义。但是,肺动脉高压的发生机制迄今尚未完全阐明,需要从新的视角加以探讨。我们以前的研究证实,在大鼠肺动脉平滑肌细胞中有钙敏感受体(calcium-sensing receptor,CaSR)的表达,并且缺氧能够活化CaSR 导致肺动脉平滑肌细胞增殖,促进肺动脉重构[2-3]。其具体的机制如何,CaSR 通过什么信号途径引起肺动脉重构,国内外鲜有报道。本实验将对上述问题展开研究。
材 料 和 方 法
1 材料
1.1 主要试剂 Cyclin D1、protein kinase B (Akt)、p-AktⅠ抗及Ⅱ抗均购自Santa Cruz,细胞周期试剂盒购自Becton Dickinson,BrdU 购自Roche Applied Science,Ⅱ型胶原酶购自Sigma。
1.2 仪器 Beckman 低温离心机;立体显微镜(Nikon);细胞缺氧培养箱和酶标仪(Thermo)。
2 方法
2.1 肺动脉分离和平滑肌细胞培养 肺动脉分离和平滑肌细胞提取、培养参照文献[4]。在立体显微镜下分离大鼠肺动脉,采用Ⅱ型胶原酶消化法提取原代平滑肌细胞,第3 ~5 代生长状态良好的细胞用于实验。
2.2 缺氧模型的复制及分组 对照组(control):细胞去血清培养24 h 后,正常条件培养24 h;缺氧组(H):细胞去血清培养24 h 后,置于细胞缺氧培养箱内培养24 h(93%N2、2%O2、5%CO2);GdCl3干预组(H+ Gd):细胞去血清培养24 h,加入GdCl3(300 μmol/L)后,置于细胞缺氧培养箱内培养24 h;LY294002(PI3K 抑制剂)干预组(H+LY):细胞去血清培养24 h,加入LY294002(10 μmol/L)孵育30 min 后加入GdCl3(300 μmol/L),置于缺氧培养箱内培养24 h。
2.3 Western botting 分析cyclin D1、Akt 和p-Akt蛋白的表达 培养的肺动脉平滑肌细胞刮下后加入蛋白裂解液及苯甲基磺酰氟(phenylmethanesul fonyl fluoride,PMSF),分别在冰上放置40 min,4 ℃下12 000 r/min离心20 min,取上清进行蛋白定量。取20 μg 蛋白样品,10% SDS-PAGE 电泳,100 V 转移1 h 至硝酸纤维素薄膜,封闭1 h;Ⅰ抗分别为anti-cyclin D1 (1∶500),anti-Akt (1∶500),anti-p-Akt(1∶500),anti-GAPDH(1∶500)4 ℃过夜。洗膜后,碱性磷酸酶(alkaline phosphatase,ALP)标记的抗IgG 抗体(1∶1 000)孵育1 h,最后用Western blue stabilized substrate for ALP (Promega)显色,吸光度扫描半定量分析显影条带[5-6]。
2.4 流式细胞术检测细胞增殖周期 分别取各组培养的肺动脉平滑肌细胞,经0.25%胰蛋白酶消化后,用PBS 洗涤2 次,调整细胞密度为1 ×106/L,制成单细胞悬液,2 000 r/min 离心5 min,PBS 洗涤1次2 000 r/min 5 min,加3 mL 预冷的乙醇固定,4 ℃过夜2 000 r/min 离心5 min,加入缓冲液3 mL 洗涤1 次2 000 r/min 离心5 min,加A 液250 μL,室温作用10 min,加B 液200 μL,室温作用10 min,加预冷的C 液200 μL,室温避光10 min,上机检测[7]。
2.5 DNA BrdU 掺入法测定细胞增殖 细胞种在96孔板上,密度为3 500 cells/well。细胞经过处理后每孔分别加入BrdU 标记的溶液(10 μmol/L),细胞固定60 min,然后过氧化物酶标记的抗BrdU 抗体(1∶100)室温孵育90 min,细胞冲洗3 次,底物溶液室温孵育5 min,酶标仪检测[8]。
3 统计学处理
结 果
1 不同处理因素对cyclin D1 表达的影响
缺氧能够导致cyclin D1 蛋白表达增加(P <0.05 vs 对照组);在缺氧基础上GdCl3能上调这种增加(P <0.05 vs 缺氧组);LY294002 则能够抑制cyclin D1 的表达上调(P <0.05 vs 缺氧+GdCl3组),见图1。
2 不同处理因素对细胞周期及细胞增殖指数的影响
与对照组相比,缺氧组G0/G1期细胞比例显著降低,S 和G2/M 期细胞比例均显著增加。细胞增殖指数(proliferation index)PI = (S +G2/M)/ (S +G2/M+G0/G1)计算结果显示,缺氧状态下PI 比对照组增加了约1.67 倍(P <0.05);而缺氧+GdCl3组S 和G2/M 期细胞比例均明显增加,PI 值明显增高,达到19.83,显著高于缺氧组(P <0.05);LY294002可抑制缺氧诱导的肺动脉平滑肌细胞增殖,PI 指数回落到10.3,见图2。

Figure 1. Protein expression of cyclin D1 in rat PASMCs determined by Western blotting. H:hypoxia group;H +Gd:hypoxia+GdCl3 group;H+Gd+LY:hypoxia+GdCl3 +LY294002 group. ± s. n =3. #P <0. 05 vs control group;* P <0.05 vs H group;△P <0.05 vs H+Gd group.图1 不同处理因素对肺动脉平滑肌细胞cyclin D1 蛋白表达的影响
3 不同处理因素对BrdU 掺入量的影响
以对照组BrdU 掺入量作为100%,其它实验组的BrdU 掺入量表示为对照组的百分数。本实验结果显示,与对照组相比,缺氧组BrdU 掺入量增加(P <0.05);而缺氧+ GdCl3组BrdU 掺入量明显增加,显著高于缺氧组(P <0.05);LY294002 可抑制缺氧和GdCl3诱导的肺动脉平滑肌细胞增殖,BrdU掺入量降低(P <0.05 vs 缺氧+GdCl3组),见图3。
4 不同处理因素对p-AKT 表达的影响
Western blotting 检测结果显示,t-Akt 在各组的表达没有显著性差异;和对照组比较,缺氧能够增加p-Akt 蛋白的表达(P <0.05);在此基础上GdCl3能够进一步增加p-Akt 蛋白的表达(P <0.05 vs 缺氧组);缺氧和GdCl3的这种促进效应可以被LY294002 抑制(P <0.05 vs 缺氧+GdCl3),见图4。
讨 论
肺动脉高压是一个多基因和多分子参与的复杂病理过程,这些因素的相互作用,激活相应的细胞内信号途径,最终导致血管重构。血管重构的主要特征是肺动脉平滑肌细胞增殖增加或凋亡减少而导致血管中层肥厚[9-10]。我们前期研究结果显示,缺氧诱导的CaSR 表达增加在缺氧性肺动脉增殖中发挥重要的作用,其机制与CaSR 介导的[Ca2+]i增加有关,但其具体作用机制和信号途径有待于进一步研究[2-3]。
PI3K/Akt 信号通路是调节细胞功能的重要信号通路。包括生长因子在内的多种刺激能够激活血管平滑肌细胞的PI3K,进而提高细胞内IP3含量,然后活化Akt,参与调控细胞的迁移、增殖和凋亡等。LY294002 是PI3K 抑制剂,已被广泛用于PI3K/Akt通路的研究中。
钙敏感受体是细胞膜上的G 蛋白耦联受体,其激动剂分为两型。I 型激动剂(直接激动)为多价阳离子,敏感性依次为La3+>Gd3+> Be2+> Ca2+=Ba2+>Sr2+> Mg2+。它们的强度主要依靠两个方面:电荷的数量和阳离子的离子半径。II 型激动剂(通过变构效应改变受体对Ca2+的敏感性)多为带有芳香族侧链的氨基酸[11]。本研究选用GdCl3作为钙敏感受体有效的激动剂。
本实验从对缺氧肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖指标的评估中观察到:在缺氧组,G0/G1期细胞比例减少,S 和G2/M 期细胞比例均显著增加,提示细胞增殖活跃,由于S 和G2/M 期细胞比例的增加,PI 相应地增加,同时,缺氧还显著上调cyclin D1 表达水平和BrdU 掺入量,说明缺氧能够促进细胞增生。钙敏感受体激动剂GdCl3能够放大缺氧的上述作用。但缺氧加GdCl3促进PASMCs 增殖的效应却可以被LY294002所抑制。因此,我们推断,PI3K/Akt 通路可能参与CaSR 介导的缺氧PASMCs 增殖的细胞信号转导过程。
越来越多的文献报道,PI3K/Akt 信号通路在血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖的发生发展过程中起着非常重要的作用。Duan等[12]发现胰岛素样生长因子I(IGF-I)通过PI3K和PKB/Akt 的磷酸化促进VSMCs 的增殖和迁移,PI3K 两种不同类型的抑制药 Wartmanmin 和LY294002 几乎都能完全抑制IGF-I 引起的增殖。Hayashi 等[13]报道,PI3K/Akt 和ERK/p38 MAPK 信号通路的平衡决定了VSMCs 表型的变化。
本实验Western blotting 检测结果显示,和正常对照组比较,缺氧能够增加Akt 蛋白的磷酸化;并且GdCl3(CaSR 的激动剂)能够显著促进这种增加;但这种促进效应可以被LY294002(PI3K/Akt 通路阻断剂)抑制。该结果进一步支持“PI3K/Akt 通路参与CaSR 激活促进缺氧PASMCs 增殖的信号转导过程”的推论。
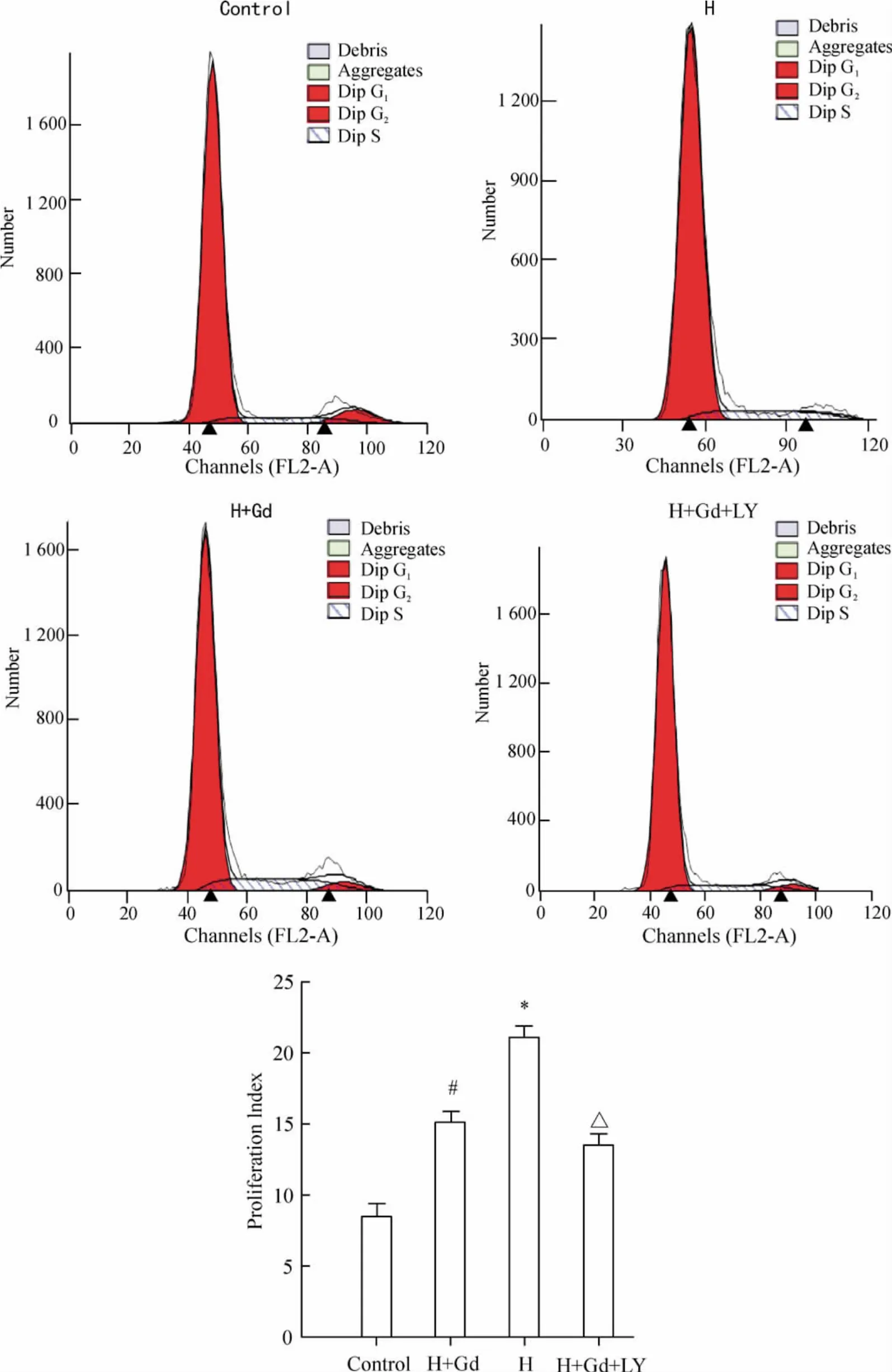
Figure 2. Cell cycle of rat PASMCs determined by flow cytometry. H:hypoxia group;H+Gd:hypoxia+GdCl3 group;H+Gd+LY:hypoxia+GdCl3 +LY294002 group. ±s.n =3. #P <0.05 vs control group;* P <0.05 vs H group;△P <0.05 vs H +Gd group.图2 不同处理因素对肺动脉平滑肌细胞细胞周期的影响
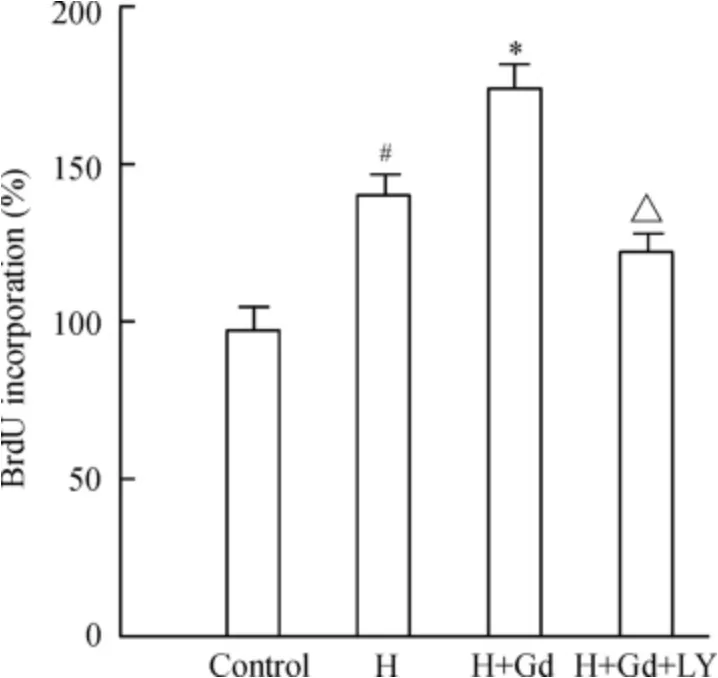
Figure 3. The proliferation of rat PASMCs determined by BrdU incorporation assay. H:hypoxia group;H+Gd:hypoxia+GdCl3 group;H+Gd+LY:hypoxia+GdCl3 +LY294002 group.±s.n=3. #P <0.05 vs control group;* P <0.05 vs H group;△P <0.05 vs H+Gd group.图3 不同处理因素对肺动脉平滑肌细胞BrdU 掺入率的影响
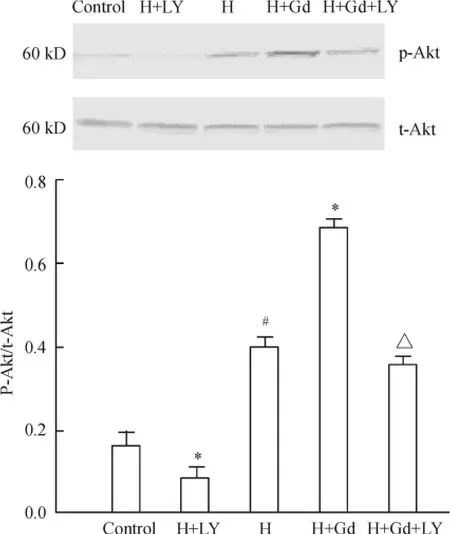
Figure 4. Protein expression of p-Akt in rat PASMCs determined by Western blotting. H:hypoxia group;H +Gd:hypoxia+GdCl3 group;H+Gd+LY:hypoxia+GdCl3 +LY294002 group. ± s. n =3. #P <0.05 vs control group;* P <0.05 vs H group;△P <0.05 vs H+Gd group.图4 不同处理因素对肺动脉平滑肌细胞Akt 磷酸化的影响
[1] Gaine SP,Rubin LJ. Primary pulmonary hypertension[J]. Lancet,1998,352(9129):719-725.
[2] 李光伟,邢文婧,郝静辉,等. 钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志,2010,26(12):2433-2437.
[3] Li GW,Wang QS,Hao JH,et al. The functional expression of extracellular calcium-sensing receptor in rat pulmonary artery smooth muscle cells [J]. J Biomed Sci,2011,18:16.
[4] Zhu DL,Medhora M,Campbell WB,et al. Chronic hypoxia activates lung 15-lipoxygenase,which catalyzes production of 15-HETE and enhances constriction in neonatal rabbit pulmonary arteries[J]. Circ Res,2003,92(9):992-1000.
[5] 李 弘,徐长庆,孙轶华,等. 多巴胺受体蛋白在大鼠心肌肥厚时的表达变化[J].中国病理生理杂志,2006,22(7):1373-1377.
[6] 孙轶华,张 力,徐长庆,等.不同鼠龄大鼠心肌组织中钙敏感受体的表达及与缺氧-再灌注损伤的关系[J].中国病理生理杂志,2006,22(8):1506-1509.
[7] Xiao D,Pinto JT,Soh JW,et al. Induction of apoptosis by the garlic-derived compound s-allylmercaptocysteine(SAMC)is associated with microtubule depolymerization and c-Jun NH2-terminal kinase 1 activation. [J].Cancer Res,2003,63 (20):6825-6837.
[8] Larner-Svensson HM,Williams AE,Tsitsiou E,et al.Research pharmacological studies of the mechanism and function of interleukin-1β-induced miRNA-146a expression in primary human airway smooth muscle[J]. Respir Res,2010,11:68.
[9] Golovina VA. Cell proliferation is associated with enhanced capacitative Ca2+entry in human arterial myocytes[J]. Am J Physiol Cell Physiol,1999,277(2 pt 1):C343-C349.
[10] Landsberg JW,Yuan JX. Calcium and TRP channels in pulmonary vascular smooth muscle cell proliferation. [J].News Physiol Sci,2004,19 (4):44-50.
[11] Handlogten ME,Shiraishi N,Awata H,et al. Extracellular Ca2+-sensing receptor is a promiscuous divalent cation sensor that responds to lead[J]. Am J Physiol Renal Physiol,2000,279(6):F1083-F1091.
[12] Duan C,Bauchat JR,Hsith T. Phosphatidylinositol 3-kinase is required for insulin-like growth factor 1-induced vascular smooth muscle cell proliferati on and migration[J]. Circ Res,2000,86(1):15-23.
[13] Mehran R,Mintz GS,Hong MK,et al.Validati on of the in vivo intravascular ultrasound measurement of instent neointimal hyperplasia volumes [J]. J Am Coll Cardol,1998,32(3):794-799.
