老年药物性肝损伤临床特点分析
2012-12-23王悦之
王悦之 张 玉
复旦大学附属华山医院老年科,上海 200040
药物性肝损伤(durg-induced liver injury,DILI)是指药物在治疗过程中,肝脏由于药物的毒性损害或对药物的过敏反应所致的疾病,也称为药物性肝炎。随着老年人器官功能减退、多种疾病并发、新药的不断开发和临床广泛应用,使越来越多的老年患者面临发生药物性肝损伤的危险。我国老年人群中药物性肝损害占肝病的比例高达20%,老年人因急性肝病人院的患者中40%为药物性肝病[1]。笔者采用回顾性分析方法,对老年人和中青年人DILI的临床资料进行了对比分析,拟探讨老年人DILI特点。现报道如下:
1 资料与方法
1.1 一般资料
收集2006年10月~2011年10月我院住院治疗的药物性肝损伤患者105例。老年组33例,其中,男15例,女18例;年龄60~91岁,其中60~69岁14例(42.4%),70~79岁12例(36.4%),80岁~91岁7例(21.2%)。中青年组72例,其中,男38例,女34例;年龄17~59岁。
1.2 方法
回顾性分析2006年10月~2011年10月我院105例因药物性肝损伤住院患者的临床资料,对老年人和中青年人DILI的临床资料进行了对比分析。
1.3 DILI的诊断标准[2]
①肝脏损害大多数出现在用药后1~4周内,有特异质反应者潜伏期可<5 d,但也可用药数月后出现肝病的表现,少数药物潜伏期可更长;②初发症状可能有发热、皮疹、瘙痒等过敏现象;③周围血液中嗜酸粒细胞>6%;④有肝内胆汁淤积或实质细胞损害等临床和病理征象;⑤淋巴细胞转化试验或吞噬细胞(白细胞)移动抑制试验阳性;⑥肝炎病毒标志,如乙型肝炎病毒表面抗原和核心抗体,甲肝病毒(IgM型)抗体,丙、丁、戊型肝炎病毒抗体等阴性;⑦偶然再次给药后又发生肝损害。凡具备上述条件第1项,加上2~7项中任何2项,并除外酒精性、自身免疫性、遗传性、阻塞性黄疸等其他肝病,再结合临床病程的演变,即可考虑诊断为DILD。
1.4 DILI国际共识分型标准[3]
①肝细胞损伤型:ALT>2倍正常值上限,或ALT活动度/ALP活动度≥5;②胆汁淤积型:ALP>2倍正常值上限,或ALT活动度/ALP活动度≤2;③混合型:ALT或ALP均>2倍正常值上限,且ALT活动度/ALP活动度介于2~5之间;其中,ALT(ALP)活动度=ALT(ALP)实际值/ALT(ALP)正常值上限。
1.5 疗效评定标准[4]
①治愈:临床症状、体征完全消失或明显改善,胆红素、丙氨酸氨基转移酶、r-谷氨酸转移酶、碱性磷酸酶等肝功能指标降至正常范围;②好转:临床症状好转,肝功能等指标较治疗前下降50%以上;③未愈:症状体征无改善,肝功能指标改善不明显或病情加重;④死亡。
1.6 统计学方法
采用SPSS 18.0软件对数据进行处理,计量资料以均数±标准差表示,采用t检验,计数资料以百分率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 潜伏期
本研究中所有老年患者出现DILI临床表现或发现肝功能异常均发生在用药之后。老年组用药至发病的潜伏期为3 d~4个月,其中8例潜伏期≤7 d,占24.2%,8例潜伏期在8到30 d,占27.3%,8例潜伏期>30 d,占24.2%,9例潜伏期不详,占27.3%。老年组潜伏期>30 d的比例高于60岁以下中青年组(P=0.02),潜伏期≤7 d的比例两组差异无统计学意义。见表1。

表1 DILI潜伏期[n(%)]
2.2 致DILI药物种类
将抗菌素、抗真菌药、抗病毒药、抗寄生虫药均归为抗微生物用药。但抗结核药的治疗因在临床有较强专科特点且本身病例数多,故单列一组。中药分类和应用在机制上完全不同于西药,故认为单列一组。其他按西药药理学分类统计。在所有病例中,引起药物性肝损伤的药物依次为:中药或中成药29例(27.62%),抗微生物药16例(15.24%),抗肿瘤药物15例(14.29%),免疫抑制剂10例(9.52%),神经及精神类药物7例(6.67%),降血脂药物5例(4.76%),其他心血管药物5例(4.76%),抗甲状腺功能亢进类药5例(4.76%),解热镇痛药4例(3.81%),抗结核药物3例(2.87%),其他药物4例,不详2例。其他药物分别指西替利嗪1例,二甲双胍1例,雌激素1例,保健品1例。老年组心血管系统用药导致DILI的比例明显高于中青年组(P<0.01),两组都有较多病例存在合并用药情况,见表2。
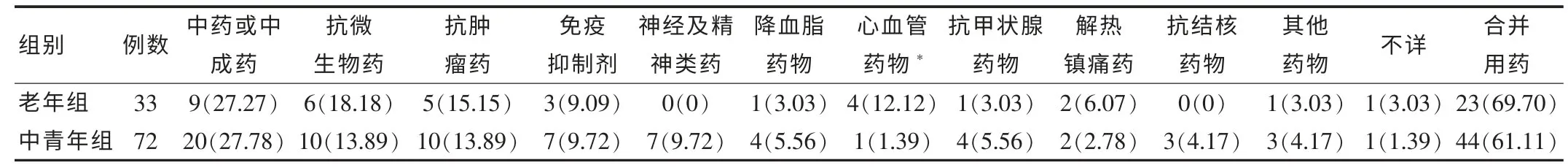
表2 导致药物性肝损伤的药物[n(%)]
2.3 实验室检查
表3 两组实验室检查结果比较(±s)

表3 两组实验室检查结果比较(±s)
注:与中青年组比较,*P=0.013、**P<0.01
组别 例数 ALT(U/L)AST(U/L)ALP(U/L)GGT(U/L)嗜酸性粒细胞比例增高[n(%)] ANA阳性[%(n1/n2)]老年组中青年组33 72 265.39±52.37*423.13±58.72 178.94±35.53 252.80±39.59 137.87±16.23 176.96±23.98 177.23±26.39 191.89±28.65 5(15.15)6(8.33)60.00(12/20)**23.68(9/38)
老年组ALT水平明显低于中青年组(P=0.013),共有58例患者行ANA检查,其中共有21例ANA阳性,按照自身免疫性肝炎(AIH)诊断标准,均未达到达到疑诊或确诊AIH的标准。老年组的ANA阳性比例明显高于中青年组(P<0.01),其中AST、ALP、GGT水平及嗜酸性粒细胞比例增高者两组差异无统计学意义。见表3。
2.4 急性DILI分型
将105例DILI患者按急性DILI国际共识分型,其中老年组肝细胞型为20例(60.61%)、胆汁淤积型9例(27.27%)和混合型4例(12.12%),中青年组分别为43例(59.72%)、12例(16.67%)和17例(23.61%)。两组临床分型差异无统计学意义(P>0.05)。
2.5 预后
所有患者被诊断为药物性肝损后,均给予停药或保肝治疗。共治愈71例,好转21例,未愈或恶化11例,死亡0例,不详2例,见表4。老年组与60岁以下中青年组预后差异无统计学意义(P>0.05)。见表4。

表4 药物性肝损的预后[n(%)]
3 讨论
老年人由于对药物的吸收、代谢、分布的特点,更易发生药物性肝病,可能与以下因素相关[1]:①药物吸收:老年人因胃酸分泌量逐渐减少,将影响某些药物在胃液中的溶解与解离。因吸收延缓,血药浓度达峰值时间推迟。②药物分布:老年人水分占体质量比减少,脂肪含量增加,血浆蛋白含量随着年龄增长而趋于降低,特别是白蛋白浓度较低,如长期或大量应用与蛋白结合率高的药物,易发生中毒反应。③肝脏代谢:老年人的肝脏体积和血流量减少,药物代谢P450酶系活性也均降低,致使药物的氧化与结合代谢均低下,若长期常规用药,易发生药物不良反应。④肾脏排泄:老年人肾血流量减少、肾小球滤过率、肾小管重吸收能力减退,肾小球滤过率下降是影响药物代谢的最主要因素,其变化在老年人之间存在很大的个体差异。另外,老年人通常同时存在几种疾病,多种药物同时使用,相互作用,竞争或抑制药物代谢酶,可能增加药物的肝毒性。并且老年人用药疗程过长、配伍不当、重复用药等,均可能导致药物性肝损害。
本研究结果显示,老年患者药物性肝损伤的潜伏期大于30 d的比例较多。这与国内外的研究结果相似[4-5]。一方面,老年患者本身的生理因素导致患者潜伏期延长,另一方面,也可能是因为老年患者往往临床症状不典型,从而延误了看病的时间,导致计算出的潜伏期延长。故老年人用药须格外谨慎,并定期监测肝功能。
目前已知有1 000余种药物可引起肝损害。各类药物引起的急性DILI的发生率国内外报道不一致,国外报道以抗生素为主,国内以中药类为主,这可能与疾病的用药习惯不同有关。本研究结果显示,居于前2位的是中药类和抗生素类药物。老年组心血管用药导致的急性DILI明显高于中青年组,考虑老年患者心血管疾病发病率高,故应用相关药物的几率较大。由于中药受安全和无毒性传统观念的影响,许多老年人根据广告宣传自行选择各种中草药治疗,引起肝脏损伤者不断增多。中药成分复杂,对肝脏的损害机制不清。目前国内报道的引起肝脏损伤的单味中药有50种之多,如黄药子、马兜铃、贯众、黄芩、首乌、泽泻、蛇毒草等。由此可见,建立药物性肝病的报道制度,特别是中药引起药物性肝病的数据库的建立刻不容缓[6]。老年人免疫力低下,卧床时间多,易合并感染(以呼吸道为主),抗微生物类药在药物性肝损害中一直占很大比重[7]。它们可诱发免疫过敏反应,可引起胆汁郁滞型或肝炎型或混合型的肝损害,有的药物甚至可诱发几种不同病型的任何一种。本研究发现,老年患者合并用药的比例较多,然而,用药数越多越难确定是何种药物引起的肝损伤。最近有研究显示,特异性药物性肝损伤与药物代谢相关的酶如P450酶的基因多态性改变有关,在这种类型的肝损伤中,由于多种药物通过同一种酶代谢,故药物代谢时间延长,毒性反应增加,最终导致肝功能损伤[8-9]。
本研究中,老年组的ANA阳性比例明显高于中青年组。这可能与老年患者本身的自身抗体阳性比例较高有关,但是否老年药物性肝损伤与自身免疫有关,还有待进一步的研究证实。
在临床分型中,本文统计显示肝细胞型最为常见,这与国外报道在药物性肝损伤患者中肝细胞型最多一致。
在预后上,老年药物性肝损伤的转归与患者原来的一般状况及肝脏是否合并有其他疾病密切相关[10]。若及时停用肝毒性药物预后良好。因此,临床上对于老年人主要器官功能不良,患有基础肝病如病毒性肝炎、糖尿病、非酒精性脂肪肝、酒精性肝病者,选用药物需更加小心谨慎,以免发生严重不良后果。
[1]刘玉兰,王晶桐.老年人药物性肝损害的诊治[J].中华老年医学杂志,2009,28(4):274-275.
[2]王吉耀.现代肝病诊断与治疗[M].上海:复旦大学出版社,2007:176-196.
[3]Benichou C.Criteria of drug-induced liver disorders.Report of an international consensus meeting[J].J Hepatol,1990,11:272-276.
[4]卢璐,石虹,张顺财.30例老年药物性肝病的临床分析[J].老年医学与保健,2010,16(2):88-93.
[4]Masahiro Onji,Shinichi Fujioka,Yasuto Takeuchi,et al.Clinical characteristics of drug-induced liver injury in the elderly[J].Hepatology Research,2009,39:546-552.
[5]林静,王亚丽,王海燕.老年人急性药物性肝病临床分析30例[J].世界华人消化杂志,2007,15(18):2059-2062.
[6]林星.老年人药物性肝损害43例临床分析[J].海峡药学,2008,20(11):138-140.
[7]Russmann S,Jetter A,Kullak Ublick GA.Pharmacogenetics of drug-induced liver injury[J].Hepatoiogy,2010,52:748-761.
[8]Taranitino G,Di Minno MN,Capone D.Drug-induced liver injury:is it somehow foreseeable?[J].World J Gastroenterol,2009,15:2817-2833.
[9]费中明,赵旭宏,郑临.慢性HBV感染人群与药物肝损害的研究进展[J].浙江医学,2008,30:531-532.
