Toll样受体4、核转录因子-κB p65在小鼠溃疡性结肠炎中的表达及意义
2012-12-23王群茹蒋明德吴晓玲胡晓松
王群茹 蒋明德 吴晓玲 黄 丽 胡晓松 刘 静
1.成都军区总医院消化内科,四川成都 610083;2.四川省绵阳市第三人民医院消化内科,四川绵阳 621000;3.成都医学院形态学教研室,四川成都 610083;4.成都医学院第一附属医院普外科,四川成都 610500
溃疡性结肠炎(ulcerative colitis,UC)属于炎症性肠病的一种,是一种由多因素导致的肠道慢性炎症性疾病,其病因和发病的分子机制尚未完全阐明,故目前对于该病药物保守治疗尚存在分歧,且缺乏有效的预防复发的措施,被世界卫生组织(WHO)确认为现代难治性疾病之一。Toll样受体在基因水平上调控着众多炎症因子的转录,而TLR4-NF-κB介导的信号转导通路在炎症性疾病的发生发展中起着重要作用,本实验采用葡聚糖硫酸钠(DSS)诱导UC模型,观察Toll样受体4(TLR4)及核转录因子-κB(NF-κB)的表达,探讨UC可能的发病机制。
1 材料与方法
1.1 实验动物与分组
健康雌性Balb/c小鼠20只,6~7周龄,体重16~22 g,购自四川实验动物研究所,合格证号SCDY(川)2010-06,称重编号后查随机数字表分为两组:生理盐水对照组(N组)、溃疡性结肠炎模型组(M组),每组各10只,清洁级实验室饲养。
1.2 主要试剂
DSS:美国Sigma公司;兔抗鼠(人)NF-κB p65多克隆抗体,购于美国Abcom公司;兔抗鼠(人)TLR4多克隆抗体,购自北京中杉金桥生物技术有限公司;PV-9001兔超敏二步法免疫组化检测试剂、PV-9003山羊超敏二步法免疫组化检测试剂、DAB显色试剂盒,均为武汉博士德生物工程有限公司产品。将葡聚糖硫酸钠(DSS)溶于三蒸水中,配成5%DSS溶液。
1.3 方法
1.3.1 UC动物模型的制备 M组:Balb/c小鼠自由饮用5%DSS溶液7 d,复制小鼠UC模型[1-2],造模之日起,每天观察小鼠大便性状和便血情况(联苯胺法检测大便隐血),活动、体重等,模型建立成功的判定标准根据半稀便、腹泻、大便隐血(+)和肉眼血便等症状和形态学改变确定。N组:自由饮用生理盐水7 d。造模7 d后取与M组同水平段的结肠组织。1.3.2结肠组织形态学检测 肉眼观察结肠组织黏膜及浆膜面的变化。取新鲜结肠组织一块,修整后大小约1.0 cm×1.0 cm×0.2 cm,置于包埋盒于4%多聚甲醛固定24 h,石蜡包埋,5μm厚切片,HE染色光镜观察组织形态学变化并由两位病理医师进行双盲法评分[3]。
1.3.3 TLR4、NF-κB活性测定 采用免疫组织化学方法检测NF-κB p65、TLR4的原位表达水平。一抗工作浓均为1∶50,按照SP法免疫组化说明书严格操作。显微镜观察染色情况:细胞质或细胞核染为棕黄色为阳性细胞。采用Axioplan 2 imaging显微图象分析系统对每张切片任意取五个高倍视野,测定阳性细胞表达水平。
1.4 统计学方法
应用SPSS 12.0统计软件分析,计量资料采用均数±标准差表示,组间比较采用两独立样本t检验,指标间的相关性分析采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠的一般状况
给药后第3天有4只小鼠出现黄绿色和黄色稀便,体重下降,毛发无光泽、饮水和进食下降等,其中4只大便隐血阳性,第4天3只小鼠出现肉眼血便,且有肛门血染,之后体重明显下降、毛发松散脱落、懒动、精神萎靡。症状逐渐加重,观察时均至少有3只小鼠肛门带血,证明造模成功。N组小鼠大便、体重、毛发、饮食、活动等一般状况均正常,未出现死亡现象。
2.2 两组病理改变及评分[3]
N组:小鼠结肠黏膜完整,光滑,腺体层次清楚、清晰可见,未见糜烂、溃疡及中性粒细胞浸润等。M组:结肠黏膜缺如,可见大小及深浅各异的多发性溃疡;出现黏膜脱落,腺体结构不清,排列不规则,腺跑腔消失,伴有大量炎细胞浸润,以中性粒细胞为主,炎症部位主要位于黏膜和黏膜肌层,少数侵及浆膜层;黏膜下水肿明显,淋巴滤泡存在;在病变相对较轻的组织,溃疡与部分完整腺体并存。M组小鼠结肠远端损伤较近端严重(图1)。与N组相比,M组形态学评分显著增高,差异有统计学意义(P<0.05)。见表1。

图1 N组与M组结肠组织HE染色(HE,×400)
表1 各组小鼠形态学评分(±s,分)
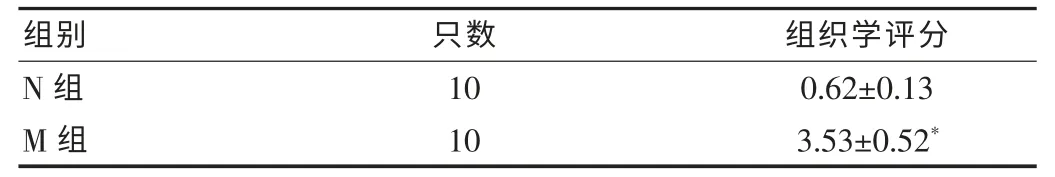
表1 各组小鼠形态学评分(±s,分)
注:与N组相比,*P<0.05
组别 只数 组织学评分N组M组10 10 0.62±0.13 3.53±0.52*
2.3 两组免疫组化染色结果
N组NF-κB为弱阳性表达,与N组相比,M组小鼠于结肠组织黏膜上皮及黏膜下呈强阳性表达,主要表达于细胞质和细胞核,以细胞核为著,且结肠炎症黏膜区NF-κB表达远高于非炎症黏膜区。与N组比较差异有统计学意义(P<0.05)。
N组小鼠TLR4偶见表达,且不均一。M组小鼠主要表达于结肠上皮,黏膜下及炎症细胞中,呈颗粒状表达于胞浆。M组小鼠结肠上皮和炎症细胞中的表达高于N组,差异有统计学意义(P<0.05)(见表2、图2)。且M组小鼠在结肠的表达呈现炎症区远高于非炎症区,表达部位与炎症细胞聚集的部位相一致,表达越强,炎症越重,且TLR4的表达与NF-κB p65的表达呈正相关(Pearson相关系数r为0.816)。
表2 各组小鼠结肠组织中NF-κB、TLR4表达光密度值(OD值)比较(±s)
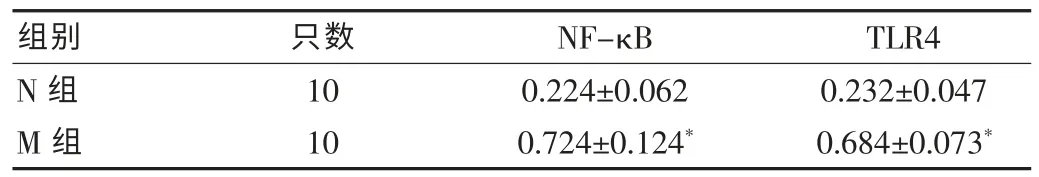
表2 各组小鼠结肠组织中NF-κB、TLR4表达光密度值(OD值)比较(±s)
注:与N组相比,r=0.816,*P<0.05
组别 只数 NF-κB TLR4 N组M组10 10 0.224±0.062 0.724±0.124*0.232±0.047 0.684±0.073*
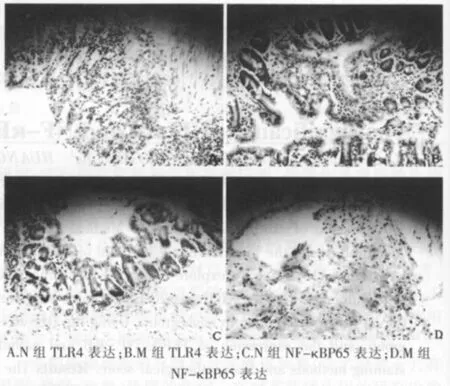
图2 两组免疫组化染色(SP,×400)
3 讨论
Toll样受体属于Ⅰ型跨膜蛋白,目前已发现13个TLRs成员。TLRs与其相应配体识别、结合,继而激活相应的信号传导通路,从而对不同的外界刺激产生特定的生物学功能。多项研究证实TLRs是肠道免疫反应的一类关键介质,在机体发挥的免疫反应中发挥着重要作用,对于维持肠道黏膜稳态也起着重要作用[4]。TLR4是第一个被发现的Toll样受体,其介导的信号通路被激活后可非特异性的与相应的病原相关分子模式(PAMPs)结合,活化该条信号转导通路,然后NF-κB激活,继而激发相关促炎因子的转录,炎症因子大量产生释放,引发炎症[5]。相关研究发现在UC患者中,NF-κB表达明显增高[6-7],炎性因子释放增多,提示TLR4参与UC发病,且发挥重要作用。
本实验发现M组小鼠TLR4、NF-κB在黏膜下层及固有层的表达较N组显著增强,且表达水平与形态学评分一致,提示TLR4、NF-κB表达越广泛、越强,病变越重,这与国内外的报道相符[8-10]。其可能机制为小鼠肠道内出现革兰阳性、阴性细菌等危险信号刺激时,TLR4、NF-κB信号通路激活,导致结肠组织内经由TLRs/NF-κB信号通路激活各种炎症介质的释放,如白介素1(IL-1)、肿瘤坏死因子-α(TNF-α)、黏附分子和干扰素(interferon,IFN)等,从而引发结肠组织过强的免疫反应,从而损伤结肠黏膜组织。李鹃等[11]研究发现采用TLR4单克隆抗体可下调小鼠结肠黏膜干扰素等炎症因子mRNA的表达而发挥干预作用。同时TLR4、NF-κB在N组小鼠结肠组织及炎性细胞低表达,这可能与肠道形成免疫耐受有关。正常肠道黏膜对TLRs配体如脂多糖处于持续刺激耐受状态,对外界刺激反应较低,保持着亚激活状态[12-17],可能与结肠组织为了维持肠道黏膜平衡状态,在必要时产生适当的免疫反应,即与结肠组织内环境稳态等有关。除此外也有报道[18]在UC的发生中TLR4的高表达可能与细菌入侵肠黏膜上皮后导致免疫失衡有关。
本实验揭示TLR4和NF-κB在溃疡性结肠炎结肠组织中的高表达提示该信号传导通路激活且导致下游炎症因子的释放可能是UC发生、发展的机制之一,但其具体分子靶点尚有待于进一步深入研究。
[1]Murano M,Maemura K,Hirata I,et al.Therapeutic effect of intraeolonieally adlninistered nuelear faetor kappaB(p65)antisense oligonueleotide on mouse dextran sulphate sodium(DSS)-indueed eolitis[J].Clin Exp Immunol JT,2000,(120):51-58.
[2]胡仁伟,欧阳钦,陈代云.右旋葡聚糖硫酸钠小鼠溃疡性结肠炎动物模型建立方法探讨[J].胃肠病学,2002,11(7):331-334.
[3]MV Herias,JFJG Koninkx,JG Vos,et al.Probiotic effects of Lactobacillus casei on DSS-induced ulcerative colitis in mice[J].International Journal of Food Mierobiology,2005,10(3):143-155.
[4]Elke Cario MD.Toll-like receptors in inflammatory bowel diseases:a decade later[J].Inflamm Bowel Dis,2010,16:1583-1597.
[5]Hemmi H,Takeuchi O,Kawai T,et al.A Toll like receptor recongnizes Baxterial DNA[J].Nature,2000,408(7):740-745.
[6]陈胜,邹开芳,杨天.Toll样受体2、4、9在大鼠结肠炎模型结肠组织中的表达及意义[J].胃肠病学,2007,12(6):339-343.
[7]Zhang K.NF-κB and inflammatory bowel[J].The Fascicule of Foreign Medicine Digest System,2003,23(2):94-96.
[8]Titus AR,Alex CC,Charles AP.Neutrophil transepithelial migrati on:role of toll-like receptors in mucosal inflammation[J].Mem Inst Oswaldo Cruz,2005,100(SuppⅡ):191-198.
[9]Cario E,Podolsky DK.Differential alteration in intestinal epithelial cell expression of toll-like receptor 3(TLR3)and TLR4 in inflammatory bowel disease[J].Infect Immun,2000,6(8):7010-7017.
[10]Hausmann M,Kiessling S,Mestermann S,et al.Toll-like receptors 2 and 4 are upregulated during intestinal inflammation[J].Gastroenterology,2002,12(2):1987-2000.
[11]李鹃,刘懿,董乐,等.TLR2mAb和TLR4mAb对急性期溃疡性结肠炎小鼠结肠黏膜炎症因子IFN-γ、IL-4及IL-17表达的影响[J].复旦学报:医学版,2010,37(3):253-258.
[12]Cario E,Podolsky DK.Differential alteration in intestinal epithelial cell expression of toll like receptor3(TLR3)and TLR4 in inflammatory bowel disease[J].Infect Immun,2000,68:7010-7017.
[13]Abreu MT,Vora P,Faure E,et al.Decreased expression of Toll like receptor4 and MD-2 correlates with intestinal epithelial cell protection against dysregulated proinflammatory gene expression in response to bacterial lipopolysaccharide[J].J Immunol,2001,1(7):1609-1616.
[14]Ortega Cava CF,Ishihara S,Runi MA,et al.Strategic compartmentalization of Toll-like receptor4 in the mouse gut[J].J Immunol,2003,17(10):3977-3985.
[15]Otte JM,Cario E,Podolsky DK.Mechanisms of cross hyporesponsiveness to Toll-like receptor bacterial ligands in intestinal epithelial cells[J].Gastroenterology,2004,12(6):1054-1070.
[16]Singh JC,Cruickshank SM,Newton DJ,et al.Toll-like receptor mediated responses of primary intestinal epithelial cells during the development of colitis[J].Am J Physiol Gastrointest Liver Physiol,2005,28(8):514-524.
[17]Hausmann M,kiessling S,Mestermann S,et al.Toll-like receptors 2 and 4 are upregulated during intestinal inflammation[J].Gastroenterology,2002,12(2):1987-2000.
[18]陈曦,欧阳钦,张文燕.溃疡性结肠炎结肠上皮TLR4和HBD2表达的研究[J].胃肠病学和肝病学杂志,2010,19(5):385-389.
