微型测定法测定白醋中的总酸度
2012-12-21卓玉国胡艳芬
刘 军,卓玉国,胡艳芬
(1.中国环境管理干部学院,河北秦皇岛066004;2.阿拉善盟阿左旗环保局,内蒙古阿拉善盟750306)
微型测定法测定白醋中的总酸度
刘 军1,卓玉国1,胡艳芬2
(1.中国环境管理干部学院,河北秦皇岛066004;2.阿拉善盟阿左旗环保局,内蒙古阿拉善盟750306)
利用微型滴定法测定白醋中的总酸度,并对常量实验和微型实验的测定结果进行了比较分析。结果两种方法无显著性差异,F检验、t检验均在允许范围内,微型实验的准确度和精密度均达到常量实验的测定水平,完全满足化学分析要求,并且有效地节省了实验试剂,大大降低了实验成本。
微型滴定;总酸度;微型实验;测定
食用白醋是人们日常生活常用的调味品之一,白醋的质量安全与人们的日常生活息息相关。总酸度是测定食醋品质的主要指标,基于减少实验试剂使用、减少污染和节约实验时间的目的,通过采用微型滴定的方法,设计完成白醋中总酸度测定的微型实验。
1 实验原理
食醋的主要成分是醋酸,此外还含有少量弱酸,如乳酸等。用氢氧化钠标准溶液滴定,选用酚酞作指示剂,测得总酸度,以醋酸的质量浓度( g·L-1) 表示[1]。
2 实验试剂
酚酞指示剂(1%):称取0.2 g的酚酞溶于20ml 95%的乙醇中。
邻苯二甲酸氢钾(工作基准试剂):基准物质,110~120℃烘干恒重。
氢氧化钠标准滴定溶液 (0.1 mol·L-1) :在天平上迅速称取2 g NaOH固体于500 ml烧杯中,立即用适量新煮沸冷却的蒸馏水溶解,溶解完全后,加水至500 ml,配制成溶液,搅匀,贮于聚乙烯塑料瓶中,备用,即得0.1 mol·L-1氢氧化钠标准滴定溶液。置橡皮塞的细口瓶中,充分摇匀。
白醋试样的配置(2 g·L-1):用移液管准确移取白醋原液 ( 40 g·L-1) 25.00 ml于 500 ml容量瓶中,以新煮沸并冷却的蒸馏水稀释定容至刻度线,摇匀。
3 测定步骤
3.1 氢氧化钠的标定 [2~3]
3.1.1 常规滴定法
0.1mol·L-1邻苯二甲酸氢钾标准溶液的配制: 将一份邻苯二甲酸氢钾 (KHC8H4O4) 在(105±5) ℃干燥2 h,冷却至室温再放于干燥器中保存,称取8.983 0 g KHC8H4O4于100 ml烧杯中,用新煮沸并冷却的蒸馏水溶解并定量转入500 ml的容量瓶中,再用蒸馏水定容至刻度,摇匀,即得0.087 97 mol·L-1的邻苯二甲酸氢钾标准溶液。
标定过程:用移液管移取25ml的邻苯二甲酸氢钾标准溶液于150ml的锥形瓶中,加入2~3滴酚酞,再用氢氧化钠溶液滴定,颜色由无色变为微红色即为滴定终点,并记录消耗氢氧化钠溶液的体积,平行测定8次。然后根据所消耗的氢氧化钠溶液的量计算氢氧化钠溶液的标准浓度。结果详见表1。
3.1.2 微型滴定法
0.025mol·L-1邻苯二甲酸氢钾标准溶液的配制:将一份邻苯二甲酸氢钾在(105±5) ℃干燥2 h,冷却至室温再放于干燥器中保存,称取0.514 2 g KHC8H4O4于25 m l烧杯中,用新煮沸并冷却的蒸馏水溶解并定量转入100 ml的容量瓶中,再用蒸馏水定容至刻度线,摇匀,即得0.025 18mol·L-1邻苯二甲酸氢钾标准溶液。
标定过程:用移液管移取5ml的邻苯二甲酸氢钾标准溶液于25ml的锥形瓶中,加入1滴酚酞,再用氢氧化钠溶液滴定,颜色由无色变为微红色即为滴定终点,并记录消耗氢氧化钠溶液的体积,平行测定8次。然后根据所消耗的氢氧化钠溶液的量计算氢氧化钠溶液的标准浓度。结果详见表1。
3.2 食醋含量的测定
3.2.1 常规实验
用移液管移取25.00 ml白醋试液于250 ml锥形瓶中[4~6],加入2~3滴酚酞指示剂,用氢氧化钠标准溶液滴定至溶液刚好由无色变为微红色,并保持30 s不褪色即为终点。根据氢氧化钠溶液的用量,计算食醋的总酸度(平行测定8次)。结果详见表1。
3.2.2 微型实验
用移液管移取2.000ml白醋试液于25ml锥形瓶中,加入1滴酚酞指示剂,用氢氧化钠标准溶液滴定至溶液刚好由无色变为微红色,并保持30 s不褪色即为终点。根据氢氧化钠溶液的用量,计算食醋的总酸度(平行测定8次)。结果详见表1。
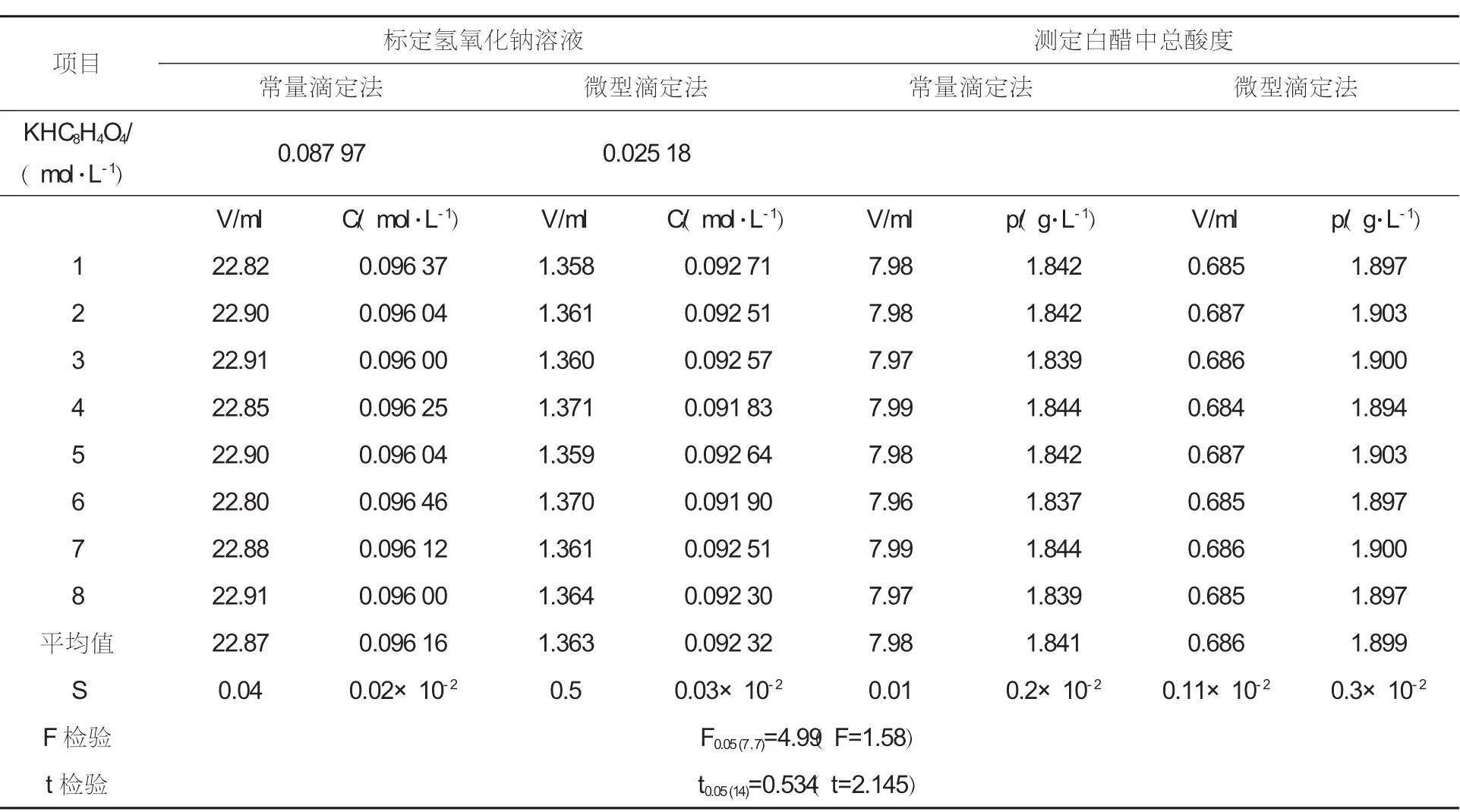
表1 常量滴定和微型滴定测定白醋中总酸度实验结果比对
4 数据处理
按公式(1)计算食醋的含量:
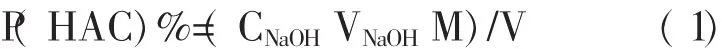
式中:CNaOH—NaOH标准溶液的浓度,mol·L-1。
5 结果与讨论
(1) 从常规滴定法和微型滴定法标定NaOH溶液的浓度及测定白醋中总酸度的结果比较可知,常规滴定法和微型滴定法的实验结果基本吻合,不存在显著性差异,结果准确可靠,均符合滴定分析的要求。
(2) 测定醋酸含量时,所用的蒸馏水不能含有CO2,否则CO2溶于水生成H2CO3,将同时被滴定。食醋中醋酸的浓度较大,必须稀释后再滴定。在稀释后的食醋中加入新煮沸并冷却的蒸馏水,使被滴定体积与NaOH标准溶液标定时溶液体积一致,减小由体积变化引起的指示剂终点误差。
(3) 指示剂的影响。HAc与NaOH的反应产物为弱酸强碱盐NaAc,化学计量点时pH≈8.7,滴定突跃在碱性范围内 (如:0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc突跃范围为pH值7.74~9.70),在此若使用在酸性范围内变色的指示剂如甲基橙,将引起很大的滴定误差(该反应化学计量点时溶液呈弱碱性,酸性范围内变色的指示剂变色时,溶液呈弱酸性,则滴定不完全)。因此应选择在碱性范围内变色的指示剂酚酞(pH值8.0~9.6)。指示剂的选择主要以滴定突跃范围为依据,指示剂的变色范围应全部或一部分在滴定突跃范围内,则终点误差小于0.1%,因此可选用酚酞作指示剂。
[1]高职高专化学教材编写组.分析化学[M].3版.北京:高等教育出版社,2008.
[2]万平,周贤爵.微型化学实验[M].北京:中国石化出版社,2008.
[3]陈晓红.微型滴定法测定饮品中的总酸度[J].内蒙古民族大学学报:自然科学版,2007,22( 1):38-39.
[4]李艳霞,谢东坡,任凯.自动电位滴定法在果蔬汁饮料总酸度测定 中 的 应 用[J].安 徽 农 业 科 学 ,2009, 37( 36):18155-18156,18261.
[5]李琼芳,钟智竑.酱油中总酸度、氨基酸态氮和氯化物连续测定法的研究[J].中国酿造,2004( 7):33-34.
[6]尤生萍,肖华志,孙亚培,等.市售酱油常用理化指标的检测分析[J].中国调味品,2011( 4):99-101.
Determination of Total Acid Quantity in White Vinegar by Microscale Experiment
Liu Jun1,Zhuo Yuguo1,Hu Yanfen2
(1.Environmental Management College of China,Qinhuangdao Hebei066004,China;2.Environmental Protection Bureau of Left Banner of Alxa,Alxa Inner Mongolia 750306, China)
Total acid quantity in white vinegar was determined by micro titration and conventional titration.The results showed that two methods had no significant difference,and F examination and t examination were all in the appropriate scope.The accuracy and precision of determining total acid quantity by microscale experiment met with the chemical analysis requirements,experiment reagents were effectively saved,and experiment costwas reduced greatly.
micro titration;total acid quantity;microscale experiment;determination
X836
A
1008-813X(2012)02-0059-03
10.3969/j.issn.1008-813X.2012.02.016
2011-12-10
河北省科技厅科技计划项目《高等学校化学实验节能减排微型化的研究》(11206746D)
刘军(1980-),女,河北省衡水市人,毕业于燕山大学材料学专业,硕士,讲师,主要从事环境学、材料学的教学与研究工作。
