红树林种植对大型底栖动物群落结构及功能群的影响*
2012-12-17魏德重项长友鲍毅新李良峰章书声
魏德重, 项长友, 鲍毅新, 李良峰, 章书声
(1.浙江师范大学 生态研究所,浙江金华 321004;2.玉环县环保局,浙江玉环 317600)
红树林(Mangrove)是沿海潮间带特有的木本植物,在我国主要分布于广西、广东、海南、台湾、福建和浙江南部沿岸[1].红树林除了本身的利用价值外,还具有增加生物多样性、保堤护塘、吸收分解海洋污染、净化空气和海水等作用,因而具有较高的经济价值和生态价值.近年来由于沿海地区的开发造成对红树林的严重破坏,导致海岸湿地生物多样性减少,因此恢复红树林以保护海岸湿地生物多样性的工作受到广泛重视[2].但应用于红树林湿地的恢复生态学理论极少[3].许多地方开展了红树林的人工种植,以改善当地的生态环境,而这些往往都是尝试性的[4].
关于红树林内大型底栖动物的研究已在许多地方开展,如海南东寨港[3]、香港[5]、深圳福田[6-9]、广西北海[10]和浙江乐清湾[11]等,这些研究主要集中于红树林内大型底栖动物的种类组成、生物多样性、垂直分布及与光滩的比较等方面,对红树林和其他生境类型之间、红树林不同种植年限之间与大型底栖动物的关系极少涉及.
本文研究了人工红树林、光滩和互花米草(Spartina alterniflora)草滩3种不同生境及不同种植年限人工红树林中底栖动物的群落结构和功能群,探讨了红树林种植是否具有改善底栖动物多样性的作用、不同种植年限的人工红树林在改善底栖动物多样性方面是否具有明显的差异,为人工红树林的生态效益研究提供依据.
1 研究方法
1.1 研究地域概况
茅埏岛位于浙江省乐清湾的中心地带,为台州市玉环县海山乡政府所在地.近年来茅埏岛大面积自然滩涂被互花米草所侵占,为改善当地的生态环境,海山乡政府自2005年起从福建省龙海市引进最能抗寒的秋茄(Kandelia candel)红树林,在原来的互花米草切割迹地种植.截止2010年在茅埏岛滩涂形成3批红树林,分别是1年红树林、3年红树林和5年红树林.
1.2 取样方法
2009年11月及2010年1月、5月和8月,在茅埏岛上的虹田村东塘(28°14'03.61″N,121°10'33.86″E),按照红树林种植情况选择样地,设置的具体调查生境为:光滩(A)、互花米草草滩(B)、人工红树林(C),其中人工红树林又分为1年红树林(C1)、3年红树林(C2)和5年红树林(C3).每次在各个生境中选取5个样点(用GPS定位),每个样点之间的距离为100 m;每个样点采集5个样方,用33 cm×30 cm×20 cm的自制0.1 m2采样器采集泥样,取样深度为20 cm.所采泥样用1 mm孔径的分样筛淘洗,获取大型底栖动物标本.将所获标本洗净后用10%甲醛溶液固定,带回研究室内进行分类鉴定、生物量称重及种群密度计数,之后把标本保存在70%乙醇溶液中.此外,在每种生境中进行定性取样.标本处理和分析均按文献[12]第7篇“岸带生物调查方法”进行.
1.3 底栖动物功能群划分
根据底栖动物功能群的一般分类方法及现有文献[13]报道,将底栖动物功能群分为以下5类:
1)浮游生物食者(Planktophagous group,Pl):依靠各种过滤器官滤取水体中微小的浮游生物,在生态系统中属于消费者,如许多双壳类、甲壳类等.
2)植食者(Phytophagous group,Ph):主要以维管束植物和海藻为食物,在生态系统中属于消费者,如某些腹足纲、双壳纲和蟹类等.
3)肉食者(Camivorous group,Ca):食小型动物和动物幼体,在生态系统中属于消费者,如某些环节动物、十足类等.
4)杂食者(Omnivorous group,Om):依靠皮肤或鳃的表皮,直接吸收溶解在水中的有机物,也可取食植物腐叶和小型双壳类、甲壳类,在生态系统中属于消费者,如某些腹足纲、双壳纲和蟹类等.
5)碎屑食者(Detritivorous group,De):摄食底表的有机碎屑,吞食沉积物,在消化道内摄取其中的有机物质,在生态系统中属于分解者,如某些线虫、双壳类等.
1.4 数据分析
参照以下公式,用MS-Excel计算不同样地底栖动物的种类组成、密度和生物量、物种多样性指数、生态位宽度及群落相似度等,并且对不同季节各位点物种多样性指数进行生境-季节间无重复双因素方差分析.
Margalef种类丰度指数:d=(S-1)/lnN;
Shannon-Wiener多样性指数:

欧氏距离(Euclidean distance):
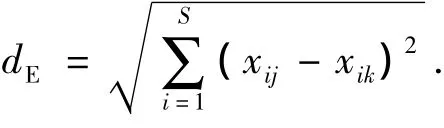
其中:S和N分别为群落定量取样获得的物种数和密度;Pi=Ni/N为调查群落中种i的个体数的比例;Xij和Xik分别为i功能群在j,k样地中密度的4次方根.
利用DPS和 PRIMER[14]等数据处理软件对各位点大型底栖动物群落进行成对t检验、聚类和排序,分析各位点大型底栖动物群落的相似性或相异性.
2 结果
2.1 大型底栖动物的种类组成和分布
共发现大型底栖动物17种,隶属5门9纲14科(见表1),其中软体动物门10种,节肢动物门甲壳类4种,环节动物门、星虫动物门和脊索动物门各1种,分别占总物种数的58.82%,23.53%,5.88%,5.88%和 5.88%.
表2是在不同生境和不同种植年限红树林中大型底栖动物的分布情况.光滩(A)14种,互花米草草滩(B)12种,红树林(C)17种,1年生红树林(C1)14种,3年生红树林(C2)13种,5年生红树林(C3)13种.短拟沼螺、绯拟沼螺、尖锥拟蟹守螺、西格织纹螺、光滑狭口螺、缢蛏、焦河蓝蛤、彩虹明樱蛤、日本沙蚕和可口革囊星虫在光滩、互花米草草滩和红树林中都有分布;在光滩和红树林中分布的有泥蚶、伍氏厚蟹、日本大眼蟹;在互花米草草滩和红树林中分布的有红带织纹螺和日本鼓虾;只在红树林中分布的为弧边招潮蟹和青弹涂鱼.
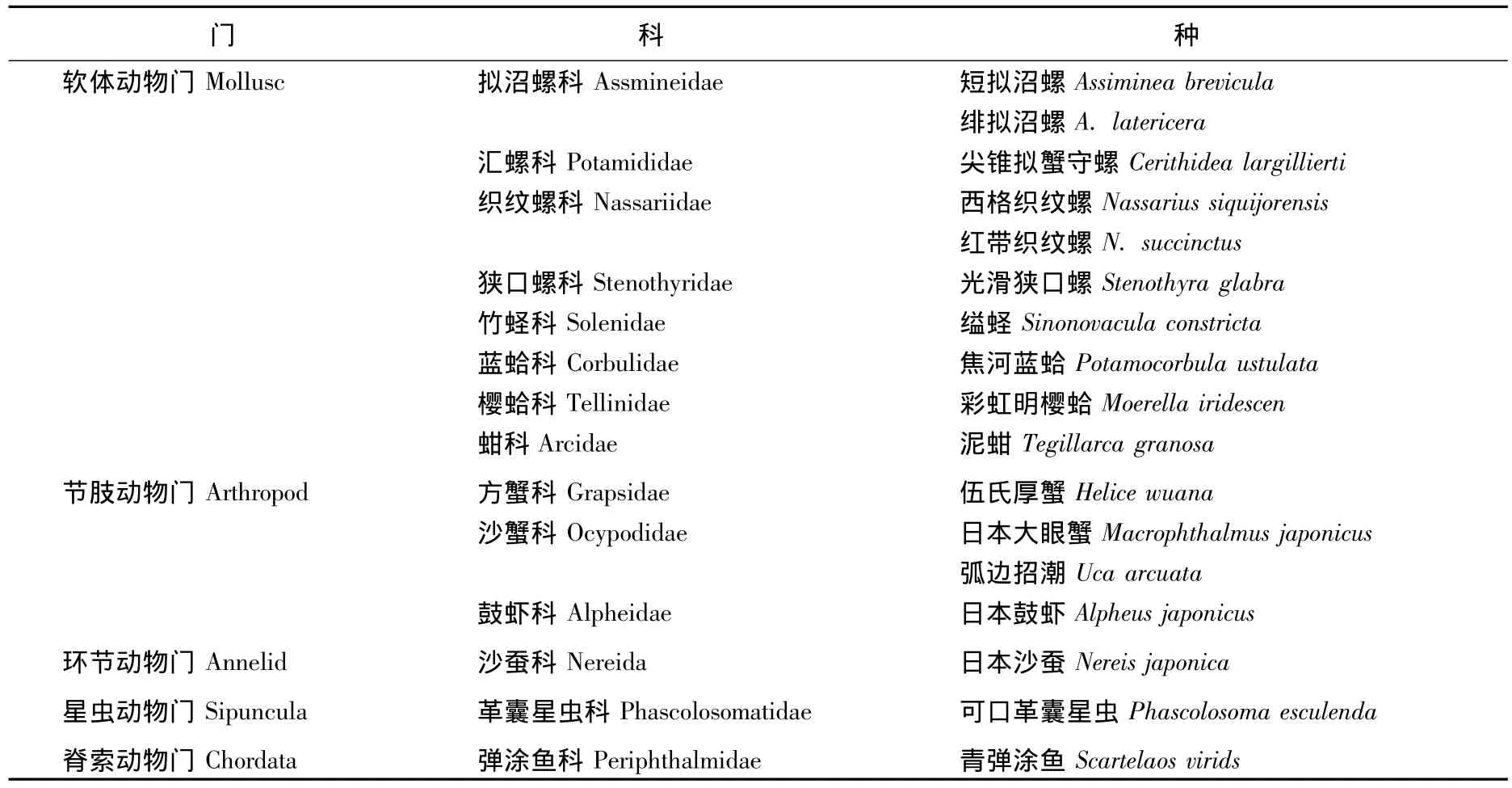
表1 调查发现的大型底栖动物
光滩中以绯拟沼螺、光滑狭口螺、短拟沼螺和尖锥拟蟹守螺为优势种;互花米草草滩中以尖锥拟蟹守螺、绯拟沼螺和光滑狭口螺为优势种;红树林中以尖锥拟蟹守螺和绯拟沼螺为优势种,但在1年生红树林(C1)中除了尖锥拟蟹守螺和绯拟沼螺外,彩虹明樱蛤也成为优势种.

表2 不同生境中大型底栖动物的数量组成%

表3 大型底栖动物各物种在不同生境中的数量组成 %
同一物种在不同生境中的数量组成见表3.互花米草草滩中有11种底栖动物的数量是各生境中最少的,光滩中有10种底栖动物数量比互花米草草滩中的多,红树林中有16种底栖动物达到最多分布.同一物种数量在不同生境中呈现草滩<光滩<红树林的规律;在不同种植年限红树林中,有6种底栖动物数量呈现明显的逐年递增的趋势.
2.2 大型底栖动物群落结构的季节变化
大型底栖动物群落密度和物种数的季节变化见图1和图2.密度和物种数的生境-季节间无重复双因素方差分析结果表明:1)大型底栖动物密度在光滩、互花米草草滩和红树林生境间差异显著(F2,6=10.53,P < 0.05),季节间差异极显著(F3,6=10.01,P <0.01);在不同种植年限红树林中,生境间差异极显著(F2,6=5.25,P <0.05),季节间差异极显著(F3,6=6.27,P <0.05).2)物种数在光滩、互花米草草滩和红树林生境间差异显著(F2,6=6.18,P < 0.05),季节间差异不显著(F3,6=4.42,P >0.05);在不同种植年限红树林中,生境间差异不显著(F2,6=1.91,P >0.05),季节间差异极显著(F3,6=14.98,P <0.01).

图1 各生境大型底栖动物密度的季节变化

图2 各生境大型底栖动物物种数的季节变化
2.3 大型底栖动物的物种多样性
大型底栖动物各生境不同季节的物种多样性指数:Margalef种类丰度(d)、Shannon-Wiener指数(H')、Pielou均匀度指数(J)和Simpson优势度指数(D)分别见表4和表5.对这4个物种多样性指数进行季节-生境间无重复双因素方差分析,结果如下:1)Margalef种类丰度(d)在光滩、互花米草草滩和红树林生境间差异显著(F2,6=8.34,P <0.05),季节间差异极显著(F3,6=9.96,P <0.01);在不同种植年限红树林中,生境间差异极显著(F2,6=16.55,P <0.01),季节间差异极显著(F3,6=34.42,P <0.01);2)Shannon-Wiener指数(H')在光滩、互花米草草滩和红树林生境间差异极显著(F2,6=11.64,P <0.01),季节间差异不显著(F3,6=1.68,P > 0.05);在不同种植年限红树林中,生境间差异显著(F2,6=5.22,P <0.05),季节间差异极显著(F3,6=23.59,P < 0.01);3)Pielou均匀度指数(J)在光滩、互花米草草滩和红树林生境间差异不显著(F2,6=2.64,P >0.05),季节间差异不显著(F3,6=2.99,P >0.05);在不同种植年限红树林中,生境间差异极显著(F2,6=14.18,P < 0.01),季节间差异显著(F3,6=8.00,P<0.05);4)Simpson优势度指数(D)在光滩、互花米草草滩和红树林生境间差异显著(F2,6=6.25,P < 0.05),季节间差 异极显著 (F3,6=23.04,P <0.01);在不同种植年限红树林中,生境间差异显著(F2,6=7.49,P < 0.05),季节间差异极显著(F3,6=49.70,P <0.01).
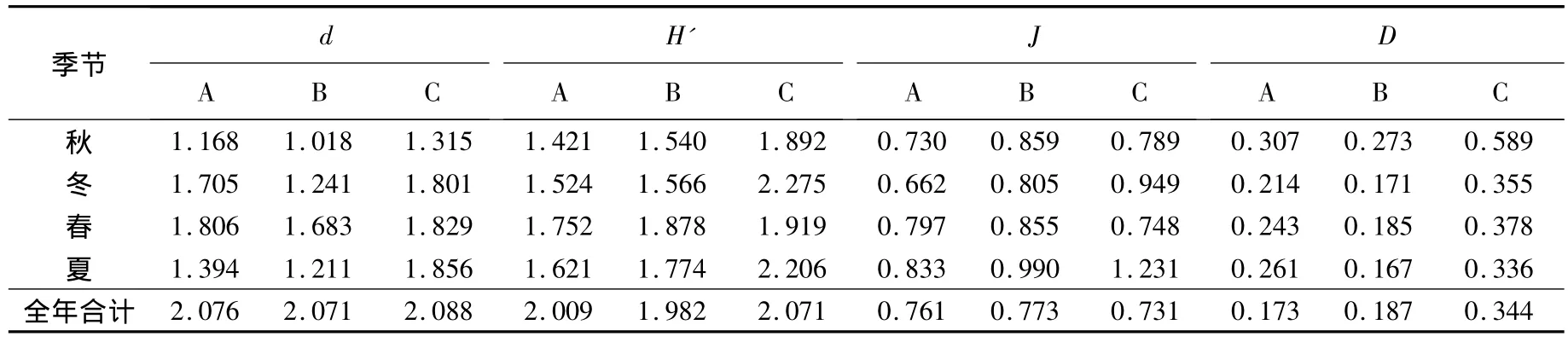
表4 不同生境中大型底栖动物群落的生物多样性指数
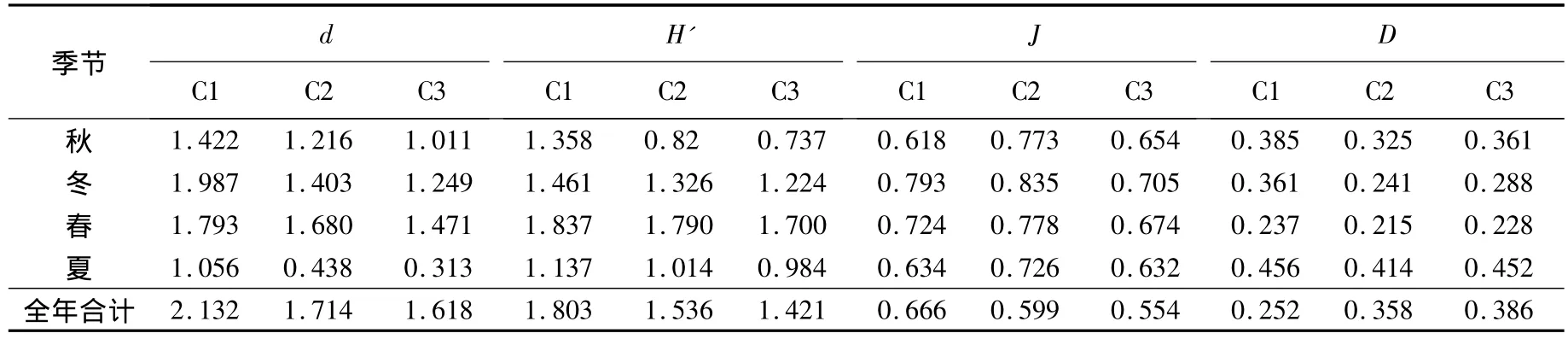
表5 不同种植年限红树林中大型底栖动物群落的生物多样性指数
2.4 功能群及其多元分析
浮游生物食者包括短拟沼螺、绯拟沼螺、缢蛏、焦河蓝蛤、彩虹明樱蛤和泥蚶6种;植食者有尖锥拟蟹守螺、光滑狭口螺、伍氏厚蟹、日本大眼蟹和弧边招潮5种;肉食者有西格织纹螺、红带织纹螺、日本鼓虾和日本沙蚕4种;杂食者有青弹涂鱼;碎屑食者有可口革囊星虫.
表6是不同功能群大型底栖动物在各生境的分布,包括物种数和密度2个参数.同时,利用种间欧氏距离进行系统聚类(见图3)和排序(见图4.胁强系数 Stress为0.002 35 <0.01,表明结果完全可信).在定量取样得到的大型底栖动物样本中,植食者密度最大;在大多数生境中,浮游生物食者密度也较高.物种数最多、分布最广的功能群是浮游生物食者、植食者和肉食者,它们在各个生境都有分布.碎屑食者的密度和物种数相对较少,分布的生境也较少.聚类和排序的结果表明,可以将这5种生境分为3组:第1组是光滩生境(A);第2组是互花米草草滩生境(B);第3组包括C1,C2和C3,均属红树林生境.

表6 定量取样获得的大型底栖动物功能群数据
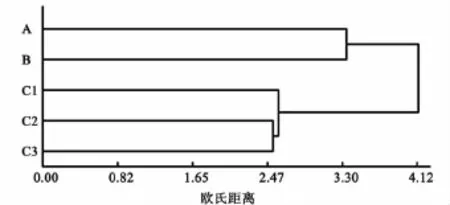
图3 以欧氏距离为基础的功能群系统聚类图

图4 群落非度量多位标度排序图
3 讨论
3.1 生境与大型底栖动物群落
茅埏岛红树林滩涂大型底栖动物的物种组成与我国其他红树林地区如深圳福田[15]、福建九龙江口[16]和海南东寨港[3]比较,物种数量较低,优势种类也不同.茅埏岛各生境中大型底栖动物均以热带性种类为主,其中:软体动物和节肢动物几乎占了物种总数的82.3%,软体动物的绯拟沼螺、尖锥拟蟹守螺和光滑狭口螺属于优势种类;而星虫动物、脊索动物、环节动物,无论在互花米草滩涂、红树林滩涂还是光滩,种类均较少.从所获物种看,底内底栖动物种类显得少些,尤其是多毛类仅1种.乐清湾周围河流较多,大量泥沙沉积形成了大片滩涂,受到互花米草入侵后,地下被密集的根系占据,中心区甚至成为黑色无氧层,底栖动物无法生活在底层,因此分布在底层内的多毛类底栖动物种类和数量就较少.红树林是铲除互花米草后人工种植的,其底部仍存留互花米草根系,不利于底栖动物的生长.因此,在所有生境中,底栖动物以分布在表层和浅层的种类为主.
红树林中底栖动物的物种组成和分布也呈现出一定的季节差异.如海南东寨港红树林滩涂大型底栖动物多样性的研究表明,其生物量、栖息密度、物种多样性和均匀度指数大都有季节变化,一般夏季明显高于冬季,而且优势种也有变化[3].从本文研究结果看,红树林内外的大型底栖动物群落在水平空间格局上的变化都较为明显,不同生境的群落结构有明显的差异,不同生境间大型底栖动物群落的季节变化也较为明显.
在不同季节中,光滩中底栖动物的整体密度、种类和单个物种的密度多于互花米草草滩;互花米草草滩中底栖动物整体密度、种类和单个物种的密度少于红树林.
互花米草草滩生境与邻近的光滩生境相比,其大型底栖动物群落的Margalef和Simpson优势度指数都较小,而Shannon-Wiener指数和Pielou均匀度指数却较大,表明互花米草的入侵改变了盐沼生境,使滩涂底质发生了改变,底栖动物群落发生了相应的变化,在一定程度上降低了该生境的生物多样性.互花米草草滩生境与相邻的红树林生境相比,其大型底栖动物群落的Margalef指数、Shannon-Wiener指数、Pielou均匀度指数和Simpson优势度指数都较相邻的红树林生境小.
通过对光滩、互花米草草滩和红树林的比较,发现后者底栖动物的整体密度、种类和单个物种的密度等指标都比前两者高,组成也有较大的变化,表明红树林在一定程度上改善了滩涂的环境,恢复了生境的生物多样性.
3.2 生境与大型底栖动物功能群
底栖动物功能群是具有相同生态功能的底栖动物的组合[17].一些研究结果表明,物种多样性和功能群组成是影响群落生产力和稳定性的主要因子[18-20];功能群组成及功能群间的相互作用对群落生产力及其稳定性具有很重要的作用[21-22].有报道称,生境与大型底栖动物功能群的组成结构存在一定的关系[23].本文结果显示各生境底栖动物功能群的相似性与生境的相似性有关.如第3组(见图3和图4)C1,C2和C3都属于红树林生境,功能群的种类是最丰富的,表明C1,C2和C3的生境相似性较高,在功能群聚类和排序图上也最接近,且与其他生境间相距较远,说明这3个生境功能群组成的特异性与它们所处的生境关系很大.而光滩和互花米草草滩,生境特征与其他生境间存在较大的差异,其功能群结构与其他生境的差异也较大,在排序和聚类图上都单独划为一组,与其他生境间距较远.
3.3 红树林种植年限对大型底栖动物群落的影响
滩涂湿地大型底栖动物群落结构的影响因子有非生物因子和生物因子两大类.非生物因子主要包括温度、盐度、pH、水动力特征、气候条件、底质条件、溶氧量及一些无机元素(如N、P、金属离子)的含量等;而影响底栖动物群落的生物因子主要为植被、物种间的竞争和捕食、人为干扰(如工程建设、围垦、工业污染、水产养殖)等[24].从本文研究结果来看,随着红树林种植年限的增加,红树林与互花米草生境中底栖动物群落的差异越来越大,表明人工红树林在一定程度上改造了互花米草生境,并且随着时间的增加影响也在加大.
通过对不同季节不同种植年限红树林中大型底栖动物群落的比较,发现随着生长时间的增加,红树林生境中底栖动物的数量呈现C1<C2<C3的关系,而底栖动物的种类、Margalef指数、Shannon-Wiener指数和Pielou均匀度指数都随时间呈现明显的递减趋势.这种现象的原因是:在红树林生长初期,由于铲除了互花米草,而人工红树林在幼林阶段是脆弱的生态系统,底栖动物除了对逆境环境、人为干扰抗性较差外,亦易遭受病虫危害,但对底上和底内动物的影响不大,其物种多样性与光滩相近;随着红树林成长和固土的同时,人工幼林与互花米草进行强烈的竞争,这个阶段滩涂环境发生剧烈变化,外界干扰较大,个别物种(如短拟沼螺、绯拟沼螺和尖锥拟蟹守螺)数量会急剧增多,个别红树林树枝甚至会有少量藤壶附着,从而影响了底栖动物的群落结构,生物多样性变得丰富;随着红树林的生长,环境条件趋于稳定,外界干扰程度降低,生物多样性降低趋于稳
定,底栖动物的数量则逐年提高.
从本文研究结果来看,红树林内外滩涂大型底栖动物的群落结构存在着一定的差别,主要表现在以下几个方面:1)生境不同造成了群落的物种组成、密度和各种多样性指数不同.无论是定性还是定量,光滩中物种数都多于互花米草草滩;互花米草草滩中底栖动物无论密度、种类还是各项多样性指数,均小于红树林中,表明红树林对底栖动物群落的恢复起到了作用.2)随着红树林种植年限的增加,虽然底栖动物群落的多样性有所下降,但总的生物量在不断地提高,这种恢复作用随着时间的增加而不断提高.表明海山乡茅埏岛红树林引种抑制了互花米草的入侵,改善了生态环境,增强了湿地生态平衡能力.
致谢:感谢 University of Califonia,San Diego的Lisa Levin教授对英文部分的润色.
[1]国家海洋局.2002 年海洋环境质量公报[R/OL].[2010-10-28].http://www.soa.gov.cn/soa/hygb/hjgb/webinfo/2003/01/1271382648954620.htm.
[2]叶勇,翁劲,卢昌义,等.红树林生物多样性恢复[J].生态学报,2006,26(4):1243-1250.
[3]邹发生,宋晓军,陈伟,等.海南东寨港红树林滩涂大型底栖动物多样性的初步研究[J].生物多样性,1999,7(3):175-180.
[4]Elster C.Reasons for reforestation success and failure with three mangrove species in Colombia[J].Forest Ecology and Management,2000,131(1/2/3):201-214.
[5]蔡立哲,谭风仪,黄玉山.香港东部红树林区大型底栖动物种类组成与数量分布特点[J].厦门大学学报:自然科学版,1998,37(1):115-145.
[6]高阳,蔡立哲,马丽,等.深圳湾福田红树林潮滩大型底栖动物的垂直分布[J].台湾海峡,2004,23(1):76-81.
[7]刘玉,余日清,陈桂珠.红树林区硅藻丰度和生物量构成及与底栖动物的关系[J].海洋环境科学,2001,20(3):24-28.
[8]余日清,陈贵珠,蓝崇钰.深圳福田红树林大型底栖动物的种类组成研究[M]//范航清,梁士楚.中国红树林研究与管理.北京:科学出版社,1995:136-145.
[9]范航清,何斌源,韦受庆.海岸红树林地沙丘移动对林内大型底栖动物的影响[J].生态学报,2000,20(5):722-727.
[10]高爱根,陈全震,曾江宁,等.西门岛红树林区大型底栖动物的群落结构[J].海洋学研究,2005,23(2):33-40.
[11]郑荣泉,葛宝明,张永普,等.乐清湾红树林和光滩大型底栖动物群落比较研究[J].生态科学,2006,25(4):299-302.
[12]全国海岸带和海涂资源综合调查简明规程编写组.全国海岸带和海涂资源综合调查简明规程[M].北京:海洋出版社,1986.
[13]胡知渊,李欢欢,鲍毅新,等.灵昆岛围垦区内外滩涂大型底栖动物生物多样性[J].生态学报,2008,28(4):1498-1507.
[14]黄睿婧,蔡立哲,叶洁琼,等.广州南沙十四涌潮间带三种生境的大型底栖动物群落比较[J].生态学杂志,2010,29(6):1187-1192.
[15]徐华林,金亮,蔡立哲,等.深圳湾福田红树林潮滩奇异稚齿虫的富有机质效应[J].生态科学,2006,25(5):437-439.
[16]李蓉,叶勇,陈光程,等.九龙江口桐花树红树林恢复对大型底栖动物的影响[J].厦门大学学报:自然科学版,2007,46(1):109-114.
[17]葛宝明,鲍毅新,郑祥,等.灵昆岛潮间带大型底栖动物群落结构与生态位分析[J].生态学报,2005,25(11):3037-3043.
[18]Fauchald K,Jumars P A.The diet of worms:a study of polychaete feeding guilds[J].Oceangr Marine Biological,Annual Review,1979,17:193-284.
[19]Anderson A N.A classification of Australian ant communities,based on functional groups which parallel plant life-forms in relation to stress and disturbance[J].Journal of Biogeography,1995,22(1):15-29.
[20]Grime J P.Biodiversity and ecosystem function:the debate deepens[J].Science,1997,277(5330):1260-1261.
[21]Naeem S,Li Shibin.Biodiversity enhances ecosystem reliability[J].Nature,1997,390(6659):507-509.
[22]Chung C H.Thirty years of ecological engineering with Spartina plantations in China[J].Ecological Engineering,1993,2(3):261-289.
[23]朱晓佳,钦佩.外来种互花米草及米草生态工程[J].海洋科学,2003,27(12):14-19.
[24]陈中义,付萃长,王海毅,等.互花米草入侵东滩盐沼对大型底栖无脊椎动物群落的影响[J].湿地科学,2005,3(1):1-7.
