梅氏新贝尼登虫热休克蛋白60基因的克隆、序列分析及应激表达分析
2012-12-17史雨红陆新江李明云
王 芳, 陈 炯, 史雨红, 陆新江, 李明云
(宁波大学 应用海洋生物技术教育部重点实室, 浙江 宁波 315211)
梅氏新贝尼登虫(Neobenedenia melleni)是一种海水鱼类体表寄生虫, 其宿主专一性低,且分布范围广, 寄生于高体鰤(Seriola dumerili)、大黄鱼(Pseudosciaena crocea)及日本黄姑鱼(Argyrosomus japonicus)等百余种海水鱼类的体表、眼、鳍、鳃和鼻等部位(Stephen et al, 2002; Whittington & Horton,1996; Zhang et al, 2002), 以宿主的表皮细胞和血液为食, 导致寄主寄生部位溃烂, 继发细菌感染而死。梅氏新贝尼登虫生活史可简单划分为3个典型的生理发育时期, 带壳虫卵需5~7 d孵化成钩毛蚴;钩毛蚴逸出6 h后感染性大幅降低, 寄生于鱼体表后钩毛蚴发育为成虫; 成虫存活周期一般为14~16 d (Jahn & Kuhn, 1932; Li et al, 2002)。我国东南沿海梅氏新贝尼登虫病的流行和爆发有典型的季节特征, 夏秋季感染率最高, 冬季不感染。研究表明鱼类贝尼登虫的感染与海水温度关系最大, 其次为降水量(Yang et al, 2004), 可见海水表层温度和盐度是影响梅氏新贝尼登虫生存的重要环境因素。
热休克蛋白(heat shock proteins, HSPs)能够阻止蛋白变性, 参与蛋白质的运输、折叠、解折叠、多聚体的组装和拆解以及错误折叠或聚集蛋白的降解(Sörensen et al, 2003), 在应激状态下, HSPs占细胞内总蛋白的百分比能够从常态时的 5%升高至15%或更高(Srivastava, 2002), 这类蛋白可能在保护寄生虫免受应激损伤时发挥重要作用(Salem et al,2001)。其中热休克蛋白60 (HSP60)是一类主要分布于线粒体且在进化上高度保守的蛋白质。它能够与原核和真核生物细胞内的大部分蛋白相连接(Borges & Ramos, 2005), 协助多肽或蛋白质正确转位、折叠和装配。研究表明, HSP60是自身防御系统的预警信号(Ohashi et al, 2000), 其表达量可用于海洋无脊椎动物的应激检测 (Choresh et al, 2001)。鉴于HSP60在生命活动中的重要功能, 本文克隆获得梅氏新贝尼登虫HSP60 (NmHSP60)全长基因, 选择梅氏新贝尼登虫生活史中持续时间较长的虫卵和成虫阶段, 分别用RT-qPCR和Western blot技术分析该基因 mRNA及蛋白表达与温度应激和盐度胁迫的相关性, 为 NmHSP60功能的深入研究奠定基础。
1 材料与方法
1.1 实验材料与主要试剂
于浙江省宁波市象山黄避岙港湾采集大黄鱼样本并分离体表梅氏新贝尼登虫。成虫和虫卵分别置于盐度24温度为18、25及32 ℃的过滤海水中, 2 h后收集并液氮速冻保存, 各温度样品单独重复取样3次。取成虫与虫卵分别置于25 ℃盐度为18、24及30的过滤海水中, 5 h后收集, 液氮速冻后−70℃保存, 各盐度样品单独重复取样3次。
RNAiso 试剂、AMV逆转录酶、Ex Taq DNA聚合酶、DNA Ligation Kit Ver.2.0及SYBR Premix Ex Taq试剂盒均购自TaKaRa公司; Gel Extraction Kit购自Omega公司; BL21 pLys E和原核表达载体pET-28a(+)由本实验室保存; 辣根过氧化物酶标记羊抗鼠 IgG 购自北京中山金桥生物技术有限公司;ECL化学发光试剂盒和显、定影试剂盒购自碧云天生物技术研究所; 引物合成及序列测定由上海英骏生物工程公司完成。
1.2 梅氏新贝尼登虫NmHSP60基因cDNA全序列的获得及分析
根据已知 HSP60的保守序列合成简并引物HSP60-3F: 5'-GGNATGAARTTYGAYCGHGG-3'(N=A, C, G or T; R=A or G; Y=C or T; H=A, C or T), 以梅氏新贝尼登虫混合样cDNA为模板, 3'-RACE获得NmHSP60基因cDNA的3'-端序列, 随后根据测序结果设计特异性引物 NmHSP60-5R: 5'-CGAAA GCGAAGCCCTGAC-3', 5'-RACE获得NmHSP60基因cDNA的5'-端序列。测序结果经过拼接及验证重叠序列同一性后作 BLASTX (http://www.ncbi.nlm.nih.gov/)分析。信号肽序列预测采用SignalP 4.0程序(http://www.cbs.dtu.dk/services/SignalP/), 蛋白质结构域分析采用InterProScan程序(http://www.ebi.ac.uk/Tools/InterProScan/), 蛋白三维结构预测采用SWISSMODEL程序(http://swissmodel.expasy.org/repository), 多重序列比对和系统进化树分析采用MEGA 4.0 软件(Tamura et al, 2007)。
1.3 梅氏新贝尼登虫应激虫卵与成虫中NmHSP60基因mRNA的表达分析
用RNAiso试剂分别提取梅氏新贝尼登虫各样品的总 RNA, 加入 DNase I (RNase-free)处理, 在AMV逆转录酶作用下以总RNA 为模板合成cDNA第一链, 20 µL合成体系包括0.5 µg总RNA、4 µL的5× 逆转录酶缓冲液、2 µL的dNTP混合物(每种10 mmol/L)、20 U的 RNase抑制剂、50 pmol的Oligo(dT)18引物和10 U的AMV逆转录酶。根据已知的NmHSP60基因cDNA序列设计RT-qPCR引物为NmHSP60F: 5'-CCGACGCTCTTAATGCTAC-3'和NmHSP60R: 5'-GGGCTTTCTTGACAATCTC-3',预期扩增片段大小为150 bp; 根据梅氏新贝尼登虫内参基因β-actin cDNA序列设计引物为Nm-actinF:5'-CTTTAGATTTCAACCAGGAG-3'和Nm-actinR:5'-TGCCACAGTATTCCCTTT-3', 预期扩增片段大小为 162 bp。RT-qPCR反应体系和反应条件同Huang et al (2011)。采用 2-∆∆Ct法(Livak & Schmittgen,2001)对定量结果进行分析, 获得 NmHSP60基因mRNA的相对表达量。
1.4 梅氏新贝尼登虫 NmHSP60原核表达载体的构建、诱导表达和抗血清制备
根据 NmHSP60基因的 ORF序列设计引物对pET-NmHSP60F:'(下划线为添加的限制性内切酶NdeⅠ和XhoⅠ的识别序列), 以梅氏新贝尼登虫cDNA为模板扩增出NmHSP60基因ORF序列,PCR产物切胶纯化后经双酶切插入pET-28a(+)载体,构建重组质粒pET-28a-NmHSP60。转化有重组质粒的大肠杆菌BL21 pLys E菌经IPTG诱导表达, 12%SDS-PAGE和5%~20%梯度SDS-PAGE电泳分离,切胶纯化预期大小的目的条带, 免疫ICR小鼠制备抗血清, −70 ℃保存备用。
1.5 梅氏新贝尼登虫应激虫卵与成虫中NmHSP60蛋白表达变化分析
蛋白样品经SDS-PAGE电泳分离后湿转法转移至硝酸纤维素膜上, 将NC膜浸入含5%脱脂奶粉的PBS-T中4 ℃封闭过夜; 一抗37 ℃摇床孵育2 h,PBS-T摇洗5次; 加入辣根过氧化物酶标记的山羊抗小鼠IgG, 37 ℃摇床孵育1 h, PBS-T摇洗5次;ECL发光法进行显影, 胶片扫描后用Quantity One进行灰度统计。
1.6 数据分析
实验结果表示为 mean±SD, 采用 SPSS软件(13.0)中的单因素方差分析(one-way ANOVA)进行统计, P<0.05为显著差异。
2 结 果
2.1 梅氏新贝尼登虫 NmHSP60基因序列及结构分析
NmHSP60 基因全长cDNA序列(EMBL登录号FN908505)包含1 882个核苷酸, 起始密码子ATG位于第38~40位, 终止密码子TAA位于第1 766~1 768位, 推测编码一个由576个氨基酸组成的分子量为 6.15×104的蛋白, N-端无信号肽, 其理论等电点为 5.23。NmHSP60基因氨基酸序列包含一个伴侣素HSP60家族标记性位点(AAVEEGIVPGGG, aa 426—437)和一个位于 C端的 GGM 重复区域(GG MGGMGGMGGMGGMGGMGGMM, aa 555—576)。三维结构分析表明, NmHSP60含有顶端结构域(apical domain)、中间结构域(intermediate domain)和赤道结构域(equatorial domain)等3个典型HSP60蛋白结构域, 其中赤道结构域包含ATP结合位点及K+、Mg2+结合位点(Simons et al, 2004; Arnold et al,2006; Schwede et al, 2003; Guex et al, 1997)。
全长氨基酸序列比对结果表明, NmHSP60与曼氏血吸虫HSP60的同一性最高, 达79%。氨基酸序列的系统进化树分析揭示, NmHSP60与曼氏血吸虫、日本血吸虫HSP60紧密成簇, 与其他物种进化关系较远(图 1)。
2.2 梅氏新贝尼登虫应激虫卵与成虫中NmHSP60基因mRNA的表达分析
梅氏新贝尼登虫病爆发期采样海区水温通常为~25 ℃ , 本文以25 ℃为对照温度对虫卵和成虫阶段分别进行冷刺激(18 ℃ )和热刺激(32 ℃ )处理。RT-qPCR结果显示, 虫卵阶段 NmHSP60基因mRNA表达量在冷刺激下降低至对照温度时表达量的 0.25, 在热刺激下其表达量无显著变化,而成虫阶段NmHSP60基因mRNA表达量在冷刺激下降低为对照温度时的 0.45, 在热刺激下则升高至对照温度的1.3倍(图2A)。
梅氏新贝尼登虫病爆发期采样海区海水盐度通常为24左右。本文以盐度24为对照, 选择梅氏新贝尼登虫虫卵和成虫做低盐(盐度 18)和高盐(盐度30) 胁迫。RT-qPCR结果显示, 在低盐胁迫下虫卵阶段NmHSP60基因 mRNA表达量无显著变化,在高盐胁迫下其表达量显著上调为对照盐度时的3.19倍; 成虫阶段NmHSP60基因mRNA在低盐胁迫下表达量显著降低, 约为对照盐度时表达量的0.41, 在高盐胁迫下无显著变化(图2B)。
2.3 梅氏新贝尼登虫 NmHSP60基因的原核表达和其抗血清特异性Western blot检测
经 IPTG诱导的 pET28a-NmHSP60在 E.coli BL21 pLys E中融合表达 (图3A)。Quantity One软件分析表明, 该融合蛋白的相对分子质量为6.4×104, 与预期的 6.38×104(包含 6.15×104的NmHSP60和0.23×104融合肽段部分)相符。Western blot分析表明(图3B), 原核表达融合蛋白能够与抗体发生特异性反应, 证实该表达产物为预期产物,在成虫总蛋白中检测到的条带比融合表达蛋白略小, Quantity One软件分析其相对分子质量为6.15×104, 与理论计算分子量一致。
2.4 梅氏新贝尼登虫应激虫卵与成虫中NmHSP60蛋白表达变化分析
Western blot检测结果显示(图 4), 虫卵阶段NmHSP60含量经冷刺激处理后下调为对照温度时的 0.49, 经热刺激处理后无显著变化; 成虫中NmHSP60含量经冷刺激处理后下调至对照温度时的0.60, 经热刺激处理后上调至对照温度时的1.24倍。虫卵阶段NmHSP60蛋白量在低盐胁迫下无显著变化, 在高盐胁迫下上调至对照盐度时的1.54倍;成虫中NmHSP60蛋白量在低盐胁迫下降低为对照盐度时的0.69, 在高盐胁迫下无显著变化。Western blot检测结果表明, NmHSP60蛋白表达变化与上述mRNA的表达变化一致。
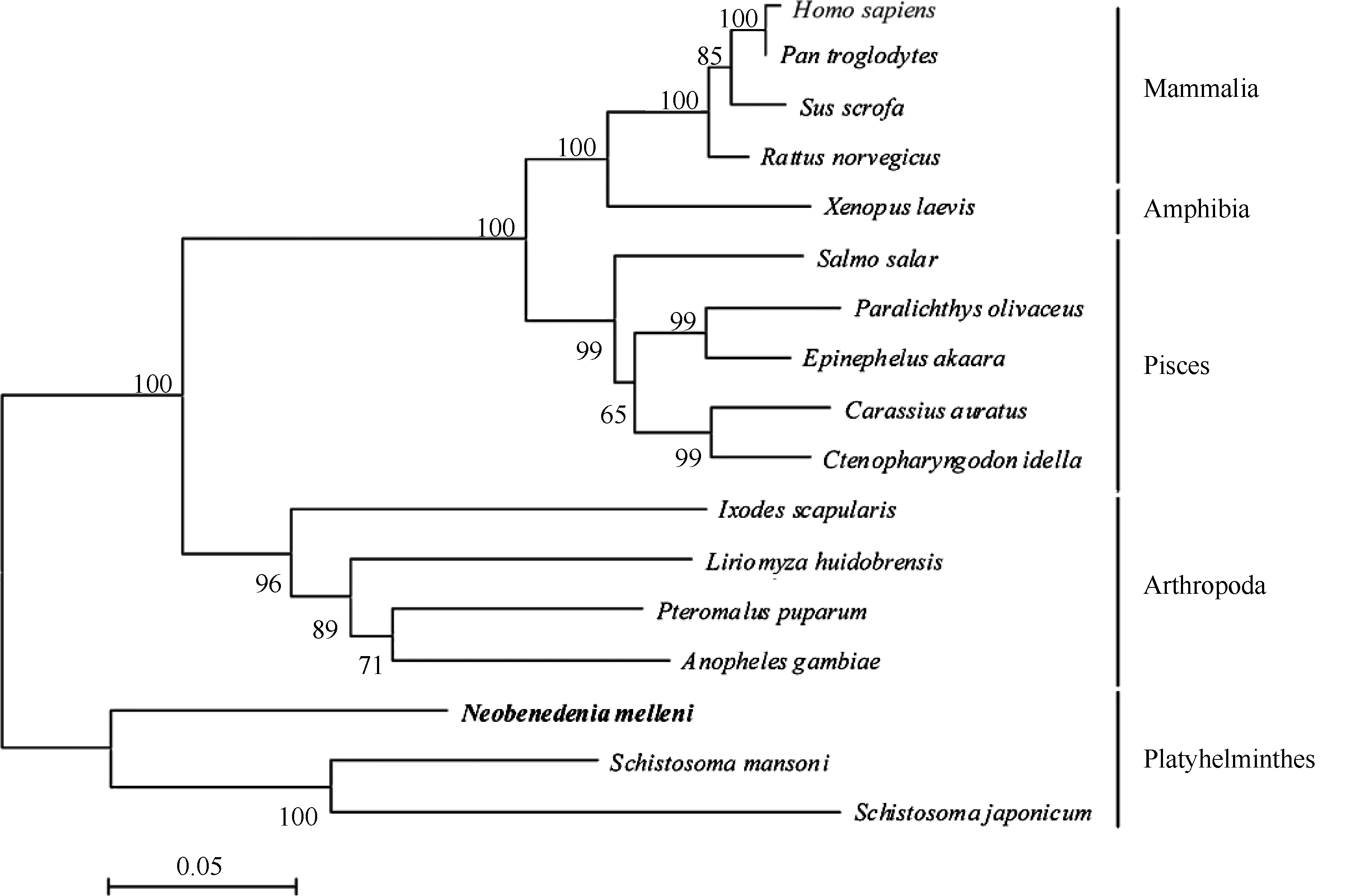
图1 基于NJ法构建的动物HSP60全长氨基酸序列的系统进化树Fig. 1 Phylogenetic tree of amino acid sequences of animal HSP60, based on neighbor-joining methodGenBank登录号:人, HUMHSP60A; 黑猩猩, AK305549; 猪, JN007377; 大鼠, RNU68562; 非洲爪蟾, BC072058; 大西洋鲑, BT059657; 牙鲆,DQ250130; 赤点石斑鱼, HQ141338; 金鱼, DQ872653; 草鱼, HQ153829; 黑脚硬蜱, XM_002433677; 南美斑潜蝇, AY845949; 蝶蛹金小蜂, FJ798092;冈比亚按蚊, XM_318461; 梅氏新贝尼登虫, FN908505; 曼氏血吸虫, XM_002572286; 日本血吸虫, AY813151。GenBank Accession numbers: Homo sapiens, HUMHSP60A; Pan troglodytes, AK305549; Sus scrofa, JN007377; Rattus norvegicus, RNU68562; Xenopus laevis, BC072058; Salmo salar, BT059657; Paralichthys olivaceus, DQ250130; Epinephelus akaara, HQ141338; Carassius auratus, DQ872653;Ctenopharyngodon idella, HQ153829; Ixodes scapularis, XM_002433677; Liriomyza huidobrensis, AY845949; Pteromalus puparum, FJ798092; Anopheles gambiae, XM_318461; Neobenedenia melleni, FN908505; Schistosoma mansoni, XM_002572286; Schistosoma japonicum, AY813151.
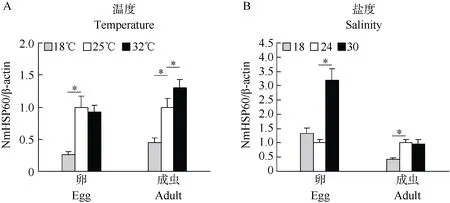
图2 实时荧光定量PCR检测NmHSP60基因mRNA表达变化Fig. 2 Expression changes analysis of NmHSP60 mRNA by RT-qPCRA:温度胁迫; B:盐度胁迫。A: Thermal stress challenge; B: Salinity stress challenge. *P<0.05 (n=3).
3 讨 论
本文测定了 NmHSP60基因全长 cDNA序列,推测编码一个由576个氨基酸组成的分子量为6.15×104的蛋白, 该预测蛋白具有线粒体分子伴侣蛋白的典型特征。氨基酸序列同源性比较和系统进化树分析揭示, NmHSP60与曼氏血吸虫HSP60较相似。
梅氏新贝尼登虫在加勒比海、西大西洋、太平洋东部和中部以及红海海域均有分布(Whittington& Horton, 1996), 在水温为 19 ℃(Deveney et al,2001)和30 ℃(Li et al, 2002)时均有报道, 但迄今为止在寒带海域未有发现, 其虫卵在 25 ℃时孵化率最高, 低水温(18 ℃)和高水温(32 ℃)时孵化率均骤减 (Lin et al, 2008)。本文研究表明, 18 ℃时虫卵NmHSP60的表达显著低于 25 ℃时, 32 ℃时表达略低于 25 ℃时, 但两者无显著差异; 成虫NmHSP60的温度应激表达模式与虫卵中的略有差异, 它随温度的升高表达显著上升, 32 ℃时表达量显著高于25℃时, 揭示NmHSP60表达与环境温度应激相关。前人研究表明, 正常条件下HSP60以稳定状态存在于细胞质和线粒体基质中, 当机体受到胁迫时, HSP60表达量增加, 以修复线粒体基质中的变性蛋白(Langer & Neupert, 1991; Itoh et al,2002), 而 HSP60表达量的骤减会导致部分变性及不可溶的凝聚蛋白无法重新恢复天然构象, 从而影响机体的正常生命活动(Gong & Yu, 2004), 当应激过强引起 HSP60生理缺失时, 酵母会停止生长(Hallberg et al, 1993)。因此, 结合梅氏新贝尼登虫的分布和发病规律, 我们认为 NmHSP60可能参与梅氏新贝尼登虫在高温下生理功能的维持。

图3 NmHSP60基因的原核表达和抗血清Western blot检测Fig. 3 Prokaryotic expression and Western blot analysis ofNmHSP60A:重组NmHSP60的SDS-PAGE分析; B:Western blot 分析。M:低分子量蛋白Marker(×103); 1-2:重组质粒pET28a-NmHSP60在BL21 pLys E中诱导0 h、3 h的表达; 3:切胶纯化蛋白; 4:阴性对照; 5:原核表达纯化产物; 6:成虫总蛋白。A: SDS-PAGE analysis of recombinant NmHSP60; B: Western blot analysis.M: protein molecular weight standards; 1-2: total protein of BL21 pLys E/pET28a-NmHSP60- induced for 0 h, 3 h; 3: purified recombinant NmHSP60; 4: negative control; 5: purified recombinant NmHSP60; 6: total protein of adult N. melleni.
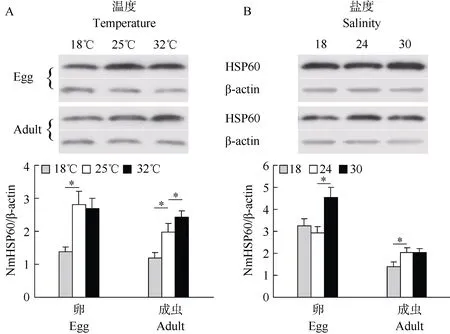
图4 Western blot检测NmHSP60蛋白表达变化Fig. 4 Expression changes analysis of NmHSP60 by Western blotA: 温度胁迫; B: 盐度胁迫。A:Thermal stress challenge; B:Salinity stress challenge. *P<0.05 (n=3).
水生生物会面临渗透胁迫问题, 前人对梅氏新贝尼登虫虫卵和成虫对环境盐度的适应性也做了一些研究, 发现海水盐度为17.6~56.9时对虫卵发育没有显著影响(Lin et al, 2008), 但成虫对盐度的变化敏感, 暴雨等造成的盐度暂时性改变能导致成虫从宿主体表脱落(Lin et al, 2008; Yang et al,2004)。新近研究表明, HSP60可能参与调节梭子蟹(Portunus trituberculatus)在盐度胁迫下的应激响应(Xu & Qin, 2012)。本文研究表明, 虫卵NmHSP60在盐度18和24时表达无显著性差异, 但盐度升至30时, 表达量显著增加, HSP60高表达与盐度胁迫相关(Xu & Qin, 2012), 所以虽然表观上盐度为18~30是对虫卵发育无显著性影响(Lin et al, 2008),但较高的环境盐度可能对虫卵仍有胁迫作用,NmHSP60的高表达可能是虫卵适应高盐环境的保护机制之一; 成虫NmHSP60在盐度18时表达显著低于盐度24时, 而盐度升至30时表达与盐度24时无显著变化, 揭示成虫 NmHSP60表达量与成虫对低盐敏感及高盐耐受的表征具有一定的关联性。
综上所述, NmHSP60是梅氏新贝尼登虫一个重要的应激相关因子。它在寄生虫温度和盐度等环境应激中的作用分子机制将有待进一步研究。
