注射用水飞蓟宾葡甲胺盐在大鼠体内药动学及组织分布的研究
2012-12-17李秋红杨柳吴莹葛越李天英
李秋红,杨柳,吴莹,葛越,李天英
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
水飞蓟宾(silibinin)来源于菊科植物水飞蓟(Silybum marianum)果实,为黄酮木脂素类化合物,具有明显抗氧化、抗炎、保护肝细胞、促进肝细胞再生的作用,临床上作为保肝药物长期应用[1-2]。在临床上主要应用片剂、胶囊剂,但其具有难溶性,且生物利用度低,吸收不稳定,从而影响临床疗效,故近年来提高水飞蓟宾生物利用度的制剂研究较多[3],不断有新的剂型推出[4-6]。水飞薊宾葡甲胺盐冻干粉末作为水飞薊宾注射剂处于研制阶段[7],做为注射剂使用可以提高其生物利用度。
水飞薊宾葡甲胺盐作为注射剂在犬体内有研究[8],但其药物动力学研究尚未见报道。本文针对静脉注射水飞薊宾葡甲胺盐后大鼠体内的药动学过程及其在组织中的分布进行研究,为水飞薊宾葡甲胺盐注射剂的进一步研究提供参考依据。
1 材料与方法
1.1 仪器与试药
高效液相色谱仪(LC-2010,日本岛津,UV检测器,Class-vp色谱工作站);氮吹仪(KL512型,北京);旋涡混合器(XW-80A,上海);高速冷冻离心机(TGL16M,长沙);超滤离心管(Millipore,美国);水飞薊宾对照品(常州龙腾生物科技有限公司,批号20051103);水飞蓟宾葡甲胺盐(常州龙腾生物科技有限公司,批号20030201);其它试剂均为市售色谱纯、分析纯;水为超纯水。
1.2 色谱条件
色谱柱:Diamonsil(R)C18柱(250mm ×4.6mm,北京迪马公司),流动相:乙腈:0.3%磷酸水(47∶53,v:v),流速:0.8mL/min,柱温:30℃,检测波长:288nm。
1.3 动物实验
清洁级雄性 Wistar大鼠,12~14周龄,体质量370~420g(由黑龙江中医药大学实验动物中心提供,SYXK(黑)2008-001提供)。大鼠麻醉后,施行静脉插管,快速静脉注射水飞薊宾葡甲胺盐注射液(按照人体高、中、低剂量等效量折算相应剂量为6.25、12.5、25mg/kg,由于水飞蓟宾葡甲胺盐注射剂并未在临床上应用,无市售。故使用前需配制),给药后于3、5、10、20、30、40、60、80、100、120min 采集血液样品200μL,立即离心分离得血浆。整个实验过程中,用电热毯保持大鼠体温,直至实验结束。另取鼠,在高剂量给药后,分别于 30、60、90、120、180、240min 断头处死动物,取心、肝、脾、肺、肾,剔除结缔组织,称重。
1.4 标准溶液的配制
精密称取水飞蓟宾葡甲胺盐对照品,加甲醇溶解,配制成1.0mg/mL标准储备液,于-20℃下保存待用。临用时以甲醇为溶剂逐级稀释,得到所需浓度的标准溶液。
1.5 样品的处理
1.5.1 血浆样品的处理
精密移取各个采集时间点的含药血浆100μL,向每只试管中加入叔丁基甲醚1mL,涡旋混合1min,离心10min(3000r/min),取上清液0.7mL,50℃水浴下氮气吹干,用200μL的流动相溶解混合,取20μL进样分析。
另取500μL血浆样品置于超滤离心管中,冷冻离心40min(10000r/min),取滤液,加入甲醇1mL后按上述方法进行操作,进样20μL,HPLC分析。
1.5.2 组织样品处理
取大鼠心、肝、脾、肺、肾称量约0.5g,剪碎,加入1mL生理盐水,用匀浆机以5000r/min制成均匀的组织匀浆。取上清液400μL,加入2mL叔丁基甲醚,涡旋混合5 min后,4000r/min离心10min。取上层液,40℃氮气吹干,残渣加200μL甲醇使其溶解,再次涡旋,冷冻离心10min后,取上清液20μL进样分析。
1.6 数据分析
以测得血药浓度绘制药时曲线,根据AIC法判别隔室模型,血浆浓度(C)-时间(t)数据依下公式解析:
Cp=Ae-at+Be-βt,A、B、α 及 β 为混杂参数。
用药动学软件3P97程序进行主要药动学参数A、B,α、β、AUC、CL、K10等的计算,用下列公式计算药物与血浆的蛋白结合率。各实验结果数据以(±s)表示。

2 结果
2.1 方法学考察结果
2.1.1 标准曲线的制备
精密加入水飞蓟宾葡甲胺盐标准溶液于100μL空白血浆及400μL组织匀浆中,配制浓度分别为10.0、50.0、100.0、300.0、500.0、700.0μg/mL 的血浆标准系列及浓度分别为 0.1,0.5,1,2,5,10μg/mL 的各组织标准系列,按样品处理方法操作,在HPLC测定条件下,测水飞蓟宾葡甲胺盐峰面积,对峰面积的值(y)和浓度(x)进行回归,得到水飞蓟宾葡甲胺盐标准曲线方程分别为:血浆 y=5364x-6080.6,r=0.9992;心 y=29501x+6407,r=0.9989;肝 y=29359x+7194.7,r=0.9998;脾 y=29259x+24820,r=0.9971;肺 y=28166x+5571.2,r=0.9992;肾 y=29028x+11746,r=0.9990。分别在10~700μg/mL浓度范围内及0.1~10μg/mL浓度范围内线性关系良好,最低定量限分别为10μg/mL及0.1μg/mL。
2.1.2 方法特异性考察
按照上述色谱条件和血样处理方法,分别将空白血浆、样品血浆和空白血浆加对照品经血样处理步骤操作后进样分析,所得色谱图如图1所示。
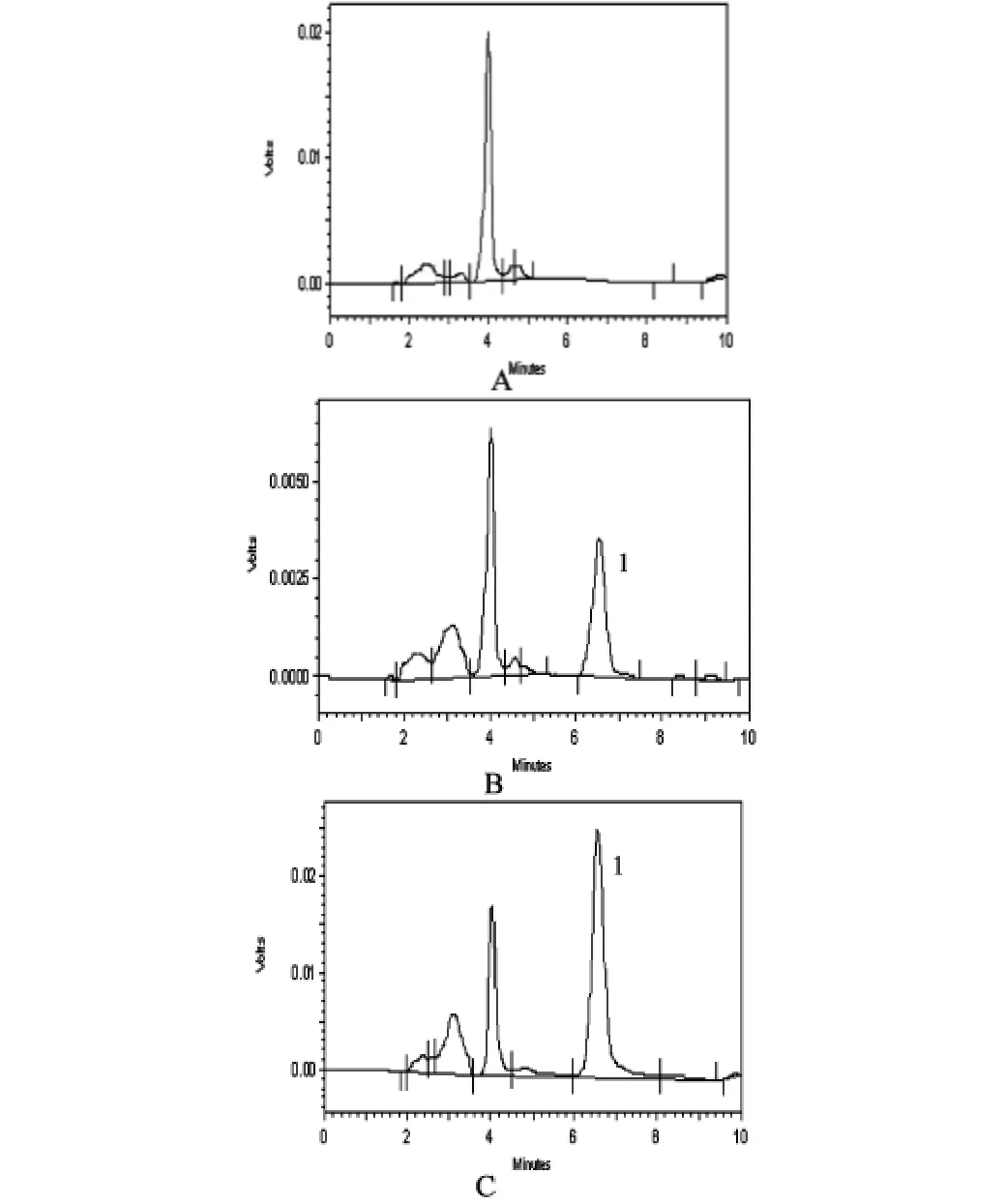
图1 样品色谱图
由图1可见,在上述色谱条件下,空白血浆中的内源性物质对水飞蓟宾葡甲胺盐的测定在出峰位置没有干扰,因此本方法具有良好的专属性。在各组织样品中,水飞蓟宾葡甲胺峰处无杂峰干扰,特异性好。
2.1.3 精密度和回收率实验
精密移取一定体积的水飞蓟宾葡甲胺盐标准溶液于100μL空白血浆和组织匀浆中,配成低、中、高三个浓度(血浆浓度为 10,100,700μg/mL,组织浓度为0.1,1,10μg/mL)的血浆样品和各组织样品,按样品处理方法进行处理,进样分析,用当日标准曲线计算回收率。低、中、高三种浓度的血浆及组织样品中方法回收率分别在97.94%~104.19%和91.23% ~105.91%之间,日内和日间精密度的RSD均小于10%。
2.1.4 稳定性考察
取低、中、高三个浓度的标准样品,进行稳定性的考察。实验结果表明,样品处理流动相复溶及样品放置在-20℃冷冻保存后反复融化、冷冻,稳定性均良好(RSD<5%)。
2.2 药动学结果
静脉注射高、中、低剂量水飞蓟宾葡甲胺盐后,水飞蓟宾葡甲胺盐血药浓度-时间曲线(见图2);根据药时曲线结果,经3P97软件计算,得出主要药动学参数(见表1)。
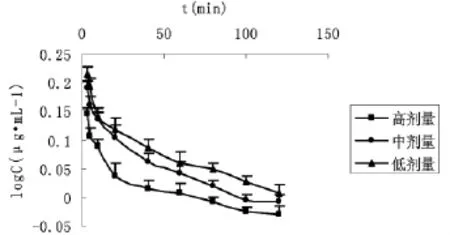
图2 高、中、低剂量给药后水飞蓟宾葡甲胺盐血药浓度-时间曲线
表1 水飞薊宾葡甲胺盐表药动学参数(n=5,±s)

表1 水飞薊宾葡甲胺盐表药动学参数(n=5,±s)
0.314 ±0.03 0.42 ±0.05 0.588 ±0.07 β(min-1)0.025 ±0.001 0.050 ±0.002 0.050 ±0.007 t1/2α(min)2.201 ±0.091 0.877 ±0.090 1.177 ±0.031 t1/2β(min)27.110 ±0.50013.829 ±0.21211.526 ±0.901 AUC(μg/mL/min)1868.671 ±25 1427.284 ±16 452.248 ±152 K10(min -1)0.018 ±0.01 0.0286 ±0.02 0.033 ±0.037 CL(mL/min)0.026 ±0.001 0.041 ±0.002 0.037 ±0.004 t1/2(min)ParametersHigh-doseMedium-doseLow-dose α(min-1)38.06103 ±0.524.14802 ±0.3 20.6409 ±0.8
通过中、低剂量给药后水飞薊宾葡甲胺盐药动学参数对比发现,AUC随剂量增加而成比例增加,t1/2无显著性差异,说明在此剂量范围内水飞蓟宾葡甲胺盐的消除为线性消除;而高、中剂量给药后AUC不成比例将使血药浓度与之不成比例的升高或下降。t1/2显著延长,表明水飞薊宾葡甲胺盐在高剂量范围内大鼠体内消除过程呈现非线性动力学特征,剂量微小变化。
2.3 血浆蛋白结合率测定结果
经超滤法测定高、中、低剂量静脉注射给药后水飞蓟宾葡甲胺盐的蛋白结合率,结果分别为:高剂量:(70.53±0.01)%;中剂量:(72.02±0.02)%;低剂量:(73.43±0.01)%,测定结果不随剂量的变化而变化(P>0.05)。
2.4 组织分布结果
由实验结果可知,高剂量的注射用水飞蓟宾葡甲胺在大鼠体内的各个组织都有一定量的分布,在体内分布的最高浓度的大小顺序为肺、肝、心、肾、脾。由实验结果可以看出,注射用水飞蓟宾葡甲胺盐在各组织中的浓度在肺内的浓度较大,并且在60min附近药物浓度达到最大值(1.46μg/mL);其次是肝脏,是在60min达到最高的药物浓度。而肾脏与脾脏均是在90min达到药物浓度最高点,心脏是在30min达到最高的药物浓度。随着时间的推移,各个组织器官中水飞蓟宾葡甲胺盐的含量迅速下降,到180min后,水飞蓟宾葡甲胺盐在各个组织器官的含量比较低,并且各个组织中水飞蓟宾葡甲胺盐含量没有明显的差别。
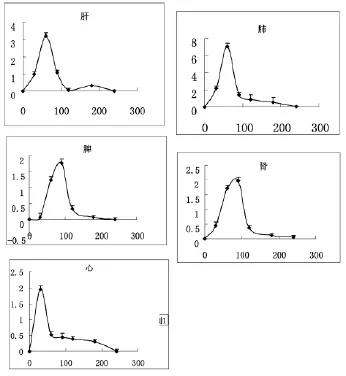
图3 高剂量给药后水飞蓟宾葡甲胺盐组织分布曲线(n=5,±s)横坐标为t/min,纵坐标为logC(μg/mL)
3 讨论
3.1 由于水飞薊宾葡甲胺盐其水溶性仍然很差,所以注射剂的制备过程中加入增溶剂[8]。本实验尝试使用了丙二醇、无水乙醇、PEG400来增加水飞薊宾葡甲胺盐的水溶性。结果显示,使用丙二醇的的增溶效果要好于无水乙醇、PEG400,所以本实验应用丙二醇增溶。
3.2 高、中、低剂量下的AUC除以其相应剂量所得的比值(84.72、114.16、72.32)经数理统计t检验具有显著差异(P<0.05),这表明注射用水飞蓟宾葡甲胺盐在大鼠体内的消除过程呈非线性动力学特点。非线性速度过程的产生,通常是由于药物的体内过程有酶和载体的参与,或是药物与血浆蛋白结合达饱和。本实验中,高、中、低剂量下血浆蛋白结合率均在70%左右(是一种蛋白结合率非剂量依赖性药物),推断非线性药动学过程不是由结合蛋白饱和引起的,产生非线性药动学过程的具体机制尚不明确,有待进一步研究。
3.3 由图3可知,心脏、肝脏与肺脏的药-时曲线比较尖锐,而脾脏与肾脏的药时曲线比较平缓。以肾脏的药时曲线可以看到,在60min和90min的药物浓度比较接近,证明水飞蓟宾葡甲胺盐在肾脏的代谢是比较缓慢的。并且肝脏的药-时曲线在180min时,出现一个比较小的药物浓度峰,分析原因可能是肝中的某种代谢酶致使肝脏中代谢产物转化所致,但具体机制有待进一步研究。由以上实验结果可知,水飞薊宾葡甲胺盐在肺脏中分布较多,在剂型研究过程中应考虑通过某些方式来改变其体内分布,使药物在肝脏中有更多的分布,使药物发挥更强大的药理作用。
本实验首次应用HPLC法来研究注射用水飞蓟宾葡甲胺盐在大鼠体内的药动学过程,通过不同剂量给药后药动学参数的比较,明确水飞蓟宾葡甲胺盐在大鼠体内的药动学过程。与以往的口服给药相比较,静脉注射给药克服了其吸收差、生物利用度低的缺点,可见该剂型具有很大的研究价值及市场潜力。
[1] 孙东,胡仕琦,王宇明.水飞蓟药理作用及其在肝病中的应用[J].中国全科医学,2007,10(11):1891-1893.
[2] 崔仁海,李宏亮,杨红玉.注射用水飞薊宾的制剂研究[J].哈尔滨商业大学学报,2008,5(10):521-523.
[3] Zhong YQ,Liu SK,Chen GS,et al.The current study about bioavailability preparations of silymarin[J].J Pham Pract,2003,21(3):139-140.
[4] 汤秀珍,侯世祥,贺英菊,等.水飞蓟素增溶方法的比较研究[J].华西药学杂志,2001,16(3):193.
[5] 林建广,周忠,王超,等.水飞蓟素水飞蓟宾葡甲胺盐的结构与水溶性[J].天然药物研究与开发,2009,21(2):214-216.
[6] 徐希明,朱源,李强,等.水飞蓟宾纳米胶束的制备及其鼠体内的药动学研究[J].中国药学杂志,2005,40(12):1874-1876.
[7] 王宵,尹莉芳,周建平,等.HPLC法测定犬血浆中的水飞薊宾葡甲胺[J].中国天然药物,2006,4(5):208-209.
[8] Martinelli EM,Morazzoni P,Livio S,et al.Liquid chromatographic assay of silybin in human plasma and urine[J].Liq Chromatogr,1991,147,14(7):128.
