10种蟾蜍甾烯类化合物对宫颈癌细胞Hela的细胞毒性及构效关系分析
2012-12-17王剑马宏跃丁安伟张军峰詹瑧唐于平
王剑,马宏跃,丁安伟,张军峰,詹瑧,唐于平
(1.南京中医药大学药学院江苏省方剂高技术研究重点实验室,江苏 南京 210046;2.南京中医药大学基础医学院,江苏 南京 210046)
蟾酥为蟾蜍科动物中华大蟾蜍(Bufo bufo gargarizan Cantor)或黑眶蟾蜍(Bufo melanostietus Schneider)耳后腺及皮脂腺分泌的白色浆液干燥物[1]。现代研究表明,中药蟾酥单用或经适当配伍具有强心、抗炎、抗感染和抗肿瘤等作用[2-3]。蟾酥中的蟾蜍甾烯类化合物是蟾酥发挥抗肿瘤以及镇痛功效的主要药效活性物质[4-5],尤其是日蟾毒它灵(gamabufotalin)、沙蟾毒精(arenobufagin)、远华蟾毒精(telocinobufagin)、蟾毒它灵(bufotalin)、蟾毒灵(bufalin)、华蟾毒灵(cinobufagin)、去乙酰蟾毒它灵(desacety-bufotalin)、嚏根草苷元(hellebrigenin)、脂蟾毒配基(resibufogenin)、羟基华蟾毒配基(cinobufotalin)等甾烯类化合物成分[6-7]。本研究以Hela细胞株为研究对象,考察蟾蜍甾烯类化合物(Bul、Btl、Arg、Hel、Tel、Deb、Ctl、Gtl、Cbg、Rbg)对其生长抑制作用,比较10种成分对Hela细胞的毒性差异,并结合各化合物化学结构,探讨其构效关系。
1 材料与方法
1.1 材料
1.1.1 仪器
PowerWave X 340型酶标仪(美国BIO-TEKINSTRUMENTS,INS.公司);CO2培养箱(Thermo 公司);实验室级超纯水器(南京易普易达科技发展有限公司);超净工作台(苏净集团安泰公司)。
1.1.2 试药和试剂
日蟾毒它灵(gamabufotalin,Gtl);沙蟾毒精(arenobufagin,Arg);远华蟾毒精 (telocinobufagin,Tel);蟾毒它灵(bufotalin,Btl);蟾毒灵(bufalin,Bul);华蟾毒灵(cinobufagin,Cbgl);去乙酰蟾毒它灵(desacety-bufotalin,Deb);嚏根草苷元(hellebrigenin,Hel);脂蟾毒配基(resibufogenin,Rbg);华蟾毒它灵(cinobufotalin,Ctl)均由本实验室自制,经波谱鉴定,纯度均大于95%。阳性对照药:拉帕替尼。
RPMI 1640培养基(美国Gibco公司);胎牛血清(杭州四季清生物工程材料有限公司);二甲亚砜(DMSO,国药集团化学试剂有限公司);噻唑蓝(MTT,美国Amresco公司,0793);青霉素钠、硫酸链霉素、胰蛋白酶(美国Amresco公司)。
1.1.3 细胞株及细胞培养
细胞株:宫颈癌Hela细胞株(北京协和药物研究所细胞库提供)。
1.2 方法
1.2.1 样品制备 精密称取10种蟾酥甾烯类化合物(Gtl、Arg、Tel、Btl、Bul、Cbg、Deb、Hel、Rbg、Ctl)以及阳性对照药拉帕替尼适量,溶于二甲亚砜(DMSO)中配制。用含0.1%DMSO的RPMI 1640将10个样品按等比分别稀释成 10-5、10-6、10-7、10-8g/ml(μg/ml)四个浓度,使样品中溶媒DMSO的浓度均为0.1%;同样方法配制拉帕替尼。
1.2.2 改良MTT法测样品对人肿瘤细胞的细胞毒活性
取对数生长期细胞,密度调整为4×104个/ml,100μl/孔接种于96孔培养板中。加样组每孔分别加入100μl不同浓度的样品(10-5~10-8g/ml),阴性对照为等体积的含0.1%DMSO的RPMI 1640培养液,阳性对照为等体积的10-5~10-8g/ml(μg/ml)四个浓度的拉帕替尼。加样组及对照组均设6个复孔,每块板均设有12个空白对照孔(仅加培养基)。在37℃、5%CO2培养箱中分别孵育72h后,加入10μl/孔的MTT(5mg/ml)。继续培养4h后,吸出上清液,加入150μl DMSO溶液,涡旋振荡,用酶标仪在570nm、620nm双波长下测定各孔的OD值。以各复孔的平均值作为该组细胞的OD值,并按下列公式计算细胞生长抑制率。实验重复3遍,结果取其平均值,并计算IC50。
抑制率(%)=[1-(加药组平均OD570nm值-加药组平均OD620nm值)/(对照组平均OD570nm值-对照组平均OD620nm值)]×100%
1.2.3 10种蟾酥甾烯类化合物化学结构式
Pubchem数据库采集蟾蜍甾烯Bu的10种分子化学结构,具体见图1。
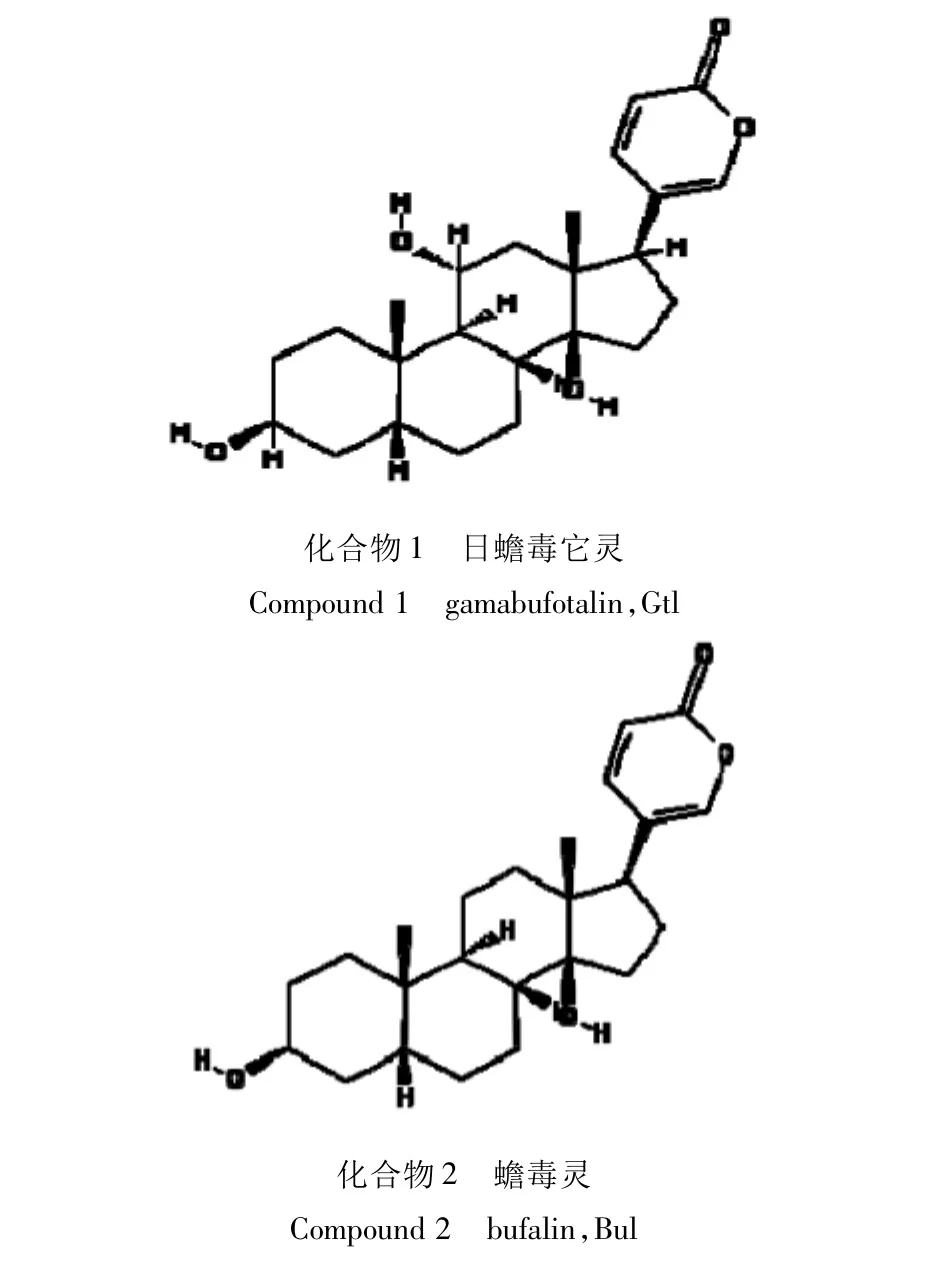

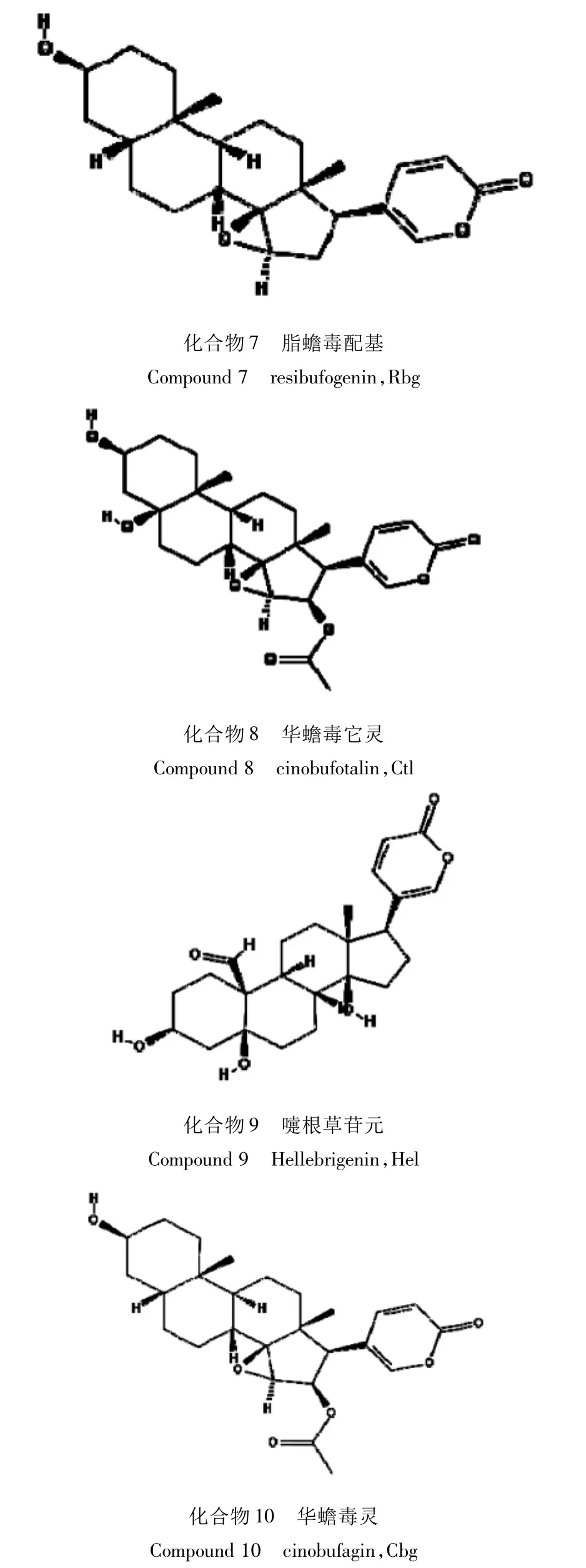
图1 10种蟾酥甾烯类化合物化学结构式
2 结果
2.1 10种蟾蜍甾烯(Bu)类化合物对Hela细胞的增殖抑制作用
如表1所示,10种Bu抑制Hela细胞增殖的效果不同,其活性顺序为Bul>Btl>Arg>Hel>Tel>Deb>Ctl>Cbg>Gtl>Rbg。
2.2 10种蟾酥甾烯类化合物构效关系分析
蟾酥甾烯类化合物为强心甾体类化合物,基本母核由24个碳原子组成。母核部分的C-17位上连有一个不饱和内酯环α-吡喃酮(α-pyrone)基,为β-构型,在母核的其它位置出现羰基、羟基、环氧基等取代基。蟾毒配基类化合物的化学结构见图2、图3和表2。
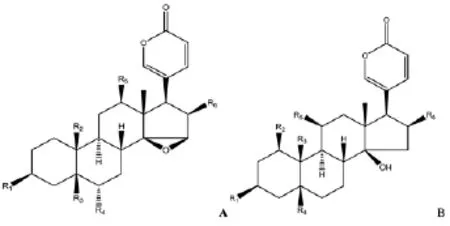
图2 蟾蜍内酯类化合物A-B的结构母核

表1 10种蟾蜍甾烯类化合物对Hela细胞的IC50μg/ml(n=6)

表2 蟾蜍甾烯类化合物
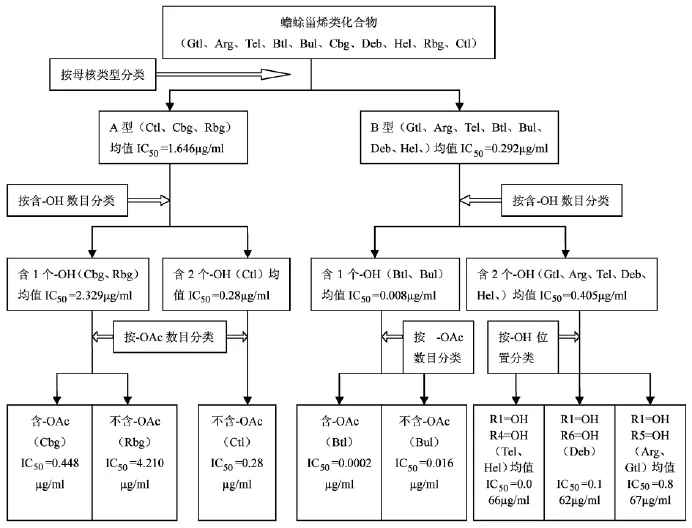
图3 蟾蜍甾烯类化合物构效关系分类树状图
图3所示,先根据甾体母核将10种化合物分为A、B型两大类,并分别求出各类的 IC50平均值,IC50A=1.646μg/ml,IC50B=0.292μg/ml,B 型结构化合物(Gtl、Arg、Tel、Btl、Bul、Deb、Hel)细胞毒性较强一些,A型化合物(Ctl、Cbg、Rbg)抗肿瘤活性比较弱。
从羟基数目来分类,A型结构母核中,比较IC50数值(2.329μg/ml与0.28μg/ml),显示羟基数目多的化合物对Hela细胞毒性强一些;而在B型母核中,IC50数值(0.008μg/ml与0.405μg/ml)显示的是羟基数目少的化合物对Hela细胞毒性强。
以羟基取代位置来分类,同型结构母核以及相同羟基数目的化合物,比较IC50数值,显示化合物在母核上的羟基取代位置不同,对Hela细胞毒性也完全不同,如图中的 Gtl、Arg、Deb、Tel、Hel,对 Hela 细胞毒性强到弱,羟基取代位置依次在母核部分的C-5位、C-16位、C-11位上。
在两类母核中,数值IC50=0.448μg/ml(Cbg)与IC50=4.210μg/ml(Rbg)、IC50=0.0002μg/ml(Btl)与IC50=0.016μg/ml(Bul),显示含有乙酰基的化合物对Hela细胞毒性强。
3 讨论
蟾蜍甾烯类化合物的抗肿瘤活性存在差异[8-10],这可能与其化学结构不同有一定的关系[11-13]。本研究以宫颈癌细胞株Hela作为细胞模型,研究比较了蟾蜍甾烯类 10种化合物(Gtl、Arg、Tel、Btl、Bul、Cbg、Deb、Hel、Rbg、Ctl)细胞毒性作用。结果表明,10种化合物均能有效抑制细胞生长,且抑制作用随浓度的增高而增强。通过比较发现,其细胞增殖抑制作用强度依次是Bul>Btl>Arg>Hel>Tel>Deb>Ctl>Cbg>Gtl>Rbg,由此结果结合化学结构进行构效关系分析。
首先将上述化合物分成两种母核类型。然后在同类母核中,进一步以羟基数目、乙酰基数目、羟基在母核上的取代位置为标准将两类化合物进行分类,计算其IC50平均值,以此表示不同化学结构下的细胞毒性大小。结果表明,B型结构的蟾蜍甾烯类化合物整体活性优于A型母核,说明14-OH成为氧环后,活性明显下降。在A、B母核中,羟基的数量对活性的影响趋势不同。在相同母核中,对仅含一个羟基的化合物,存在乙酰基使化合物对Hela的细胞毒性增强。可见,蟾蜍甾烯类化合物化学结构中的母核部分、取代基羟基数目、羟基取代位置以及乙酰化与否,均与化合物对Hela细胞毒性有相关性。
[1] 李强.蟾酥中蟾毒配基类化合物的抗肿瘤研究进展[J].实用药物与临床,2009,12(2):132-134.
[2] 蒋洁君,马宏跃,尤奋强,等.细胞连续亲和-HPLC测定8种蟾蜍甾烯与MGC-803细胞亲和量及抗肿瘤活性相关分析[J].中国中药杂志,2011,36(2):21-24.
[3] 蒋洁君,周婧,马宏跃,等.蟾酥对豚鼠心脏电生理的影响[J].中国药理学与毒理学杂志,2011,25(3):307-309.
[4] 马宏跃,段金廒,周婧,等.基于人体等效剂量的蟾酥量-效关系探讨[J].中国临床药理学与治疗学,2009,14(6):655-658.
[5] 苏永华,尹西才,谢觉民,等.三种蟾毒单体对SMMC-7721和BEL-7402人肝癌细胞生长的抑制作用[J].第二军医大学学报,2003,24(4):393-395.
[6] Min Ye,Hui Guo,Hongzhu Guo,et al.Simultaneous determination of cytotoxic bufadienolides in the Chinesemedicine ChanSu by highperformance liquid chromatography coupled with photodiode array and mass spectrometry detections[J].J Chromatogr B,2006,838:86-95.
[7] Kurosawa M,Numazawa S,Tani Y,et al.ERK signalingmediates the induction of inflammatory cytokines by bufalin in human monocytic cells[J].Am JPhysiolCellPhysiol,2000,278(3):500-508.
[8] 吴兴新,孙洋,周晓斌,等.蟾毒它灵对人胃癌BGC-823细胞的促凋亡作用[J].中药新药与临床药药理,2007,18(2):117-11.
[9] 范钰,郑树,赵刚.蟾蜍灵对结肠癌 SW-480细胞 pololikekinase-1表达及细胞凋亡的影响[J].中国病理生理杂志,2006,22(3):491-494.
[10] 王鹂,吴军,李敏,等.华蟾毒精抑制HeLa细胞增殖作用机制的探讨[J].中华肿瘤杂志,2005,27(12):717-720.
[11] 黄应申,肖军军,王传社.脂蟾毒配基通过线粒体途径诱导人肝癌Bel-7402细胞调亡的研究[J].中国肿瘤临床,2006,33(20):1141-1145.
[12] 马宏跃,周婧,段金廒,等.分子对接虚拟筛选蟾毒灵结合蛋白[J].南京中医药大学学报,2009,25(5):370-372.
[13] Li Z,Cai T,Tian J,et al.NaKtide,a Na/K-ATPase-derived peptide Src inhibitor,antagonizes ouabain-activated signal transduction in cultured cells[J].J Biol Chem,2009,284:21066-21076.
