替米沙坦对大鼠心肌肥厚组织中RASSF1A表达的影响
2012-12-17王伯乐赵玉兰
王伯乐,赵玉兰,张 强,董 静
郑州大学第二附属医院心内科 郑州450014
#通讯作者,女,1956年7月生,主任医师,教授,研究方向:心力衰竭、冠心病及其相关疾病,E-mail:zyl6616@126.com
心肌肥厚是心肌对各种致肥厚因素的代偿性反应,是心力衰竭、心律失常和心脏猝死的独立危险因素[1]。肾素-血管紧张素-醛固酮系统(RAAS)过度激活参与了心肌肥厚进程,其机制与Ras 信号通路激活有关[2],因此抑制Ras 信号通路激活可抑制心肌肥厚的发生发展。RASSF1A 是RAS 相关结构域家族基因1 的成员之一,研究[3]表明RASSF1A 可能是Ras 信号通路中一个重要的负性调节因子。替米沙坦作为一种血管紧张素受体抑制剂(ARB)类药物,可抑制RAAS 系统的激活,从而起到抗心肌肥厚的作用[4]。作者观察了替米沙坦干预下大鼠肥厚心肌组织中RASSF1A 的表达,探讨RASSF1A 与心肌肥厚的关系,为逆转心肌肥厚提供新的分子靶点。
1 材料与方法
1.1 主要仪器及试剂 ASB240U 生物信号采集分析系统(成都遨生电子有限公司)、Biosens Digital Imaging System v1.6(上海山富科学仪器有限公司)、异丙肾上腺素(上海禾丰制药有限公司,批号101104)、Bio Rad PCR 仪、逆转录试剂盒及PCR 扩增试剂盒(Fermentas 公司)、兔抗大鼠RASSFA1A抗体(BioBasic 公司)。
1.2 实验分组 8~10 周龄清洁雌性SD 大鼠30 只,购自河南省实验动物中心,体质量200~220 g。将动物按随机数字表法随机分为3组:对照组、模型组和干预组,每组10 只。对照组背部皮下注射生理盐水6 mL/(kg·d),模型组和干预组背部皮下注射异丙肾上腺素3 mg/(kg·d),连续10 d。在给予异丙肾上腺素的同时,干预组给予替米沙坦8.33 mg/(kg·d)灌胃,对照组和模型组给予等量生理盐水灌胃。
1.3 血流动力学测定 造模结束,动物禁食禁水24 h 后称体质量,腹腔注射水合氯醛麻醉后常规剪毛,消毒后分离出右侧颈总动脉,行插管,进行血流动力学测定。应用ASB240U 生物信号采集分析系统,稳定5 mim 后,记录连续5 个周期的下列指标,计算平均值进行分析:左室收缩压(LVSP)、左室舒张末期压(LVEDP)、压力最大变化速率(±dP/dt)max。
1.4 心肌肥厚指数测定 血流动力学测定结束后,开胸取心脏,用4℃生理盐水冲洗,滤纸吸干,用天平称全心湿质量和左室湿质量(包括室间隔),计算心脏指数和左室指数。
1.5 心肌病理学检查 每只大鼠分别取左室心肌1 块(约0.3 mg)迅速放入液氮中保存,剩余左心室组织经福尔马林固定,常规石蜡包埋制片,HE 染色,在光镜(×200)下观察心肌组织形态学变化。
1.6 心肌组织中RASSF1A mRNA 的检测 取Trizol 法提取左室心肌总RNA。取2.5 μg 总RNA,在M-MVL 酶作用下逆转录得cDNA,以cDNA 为模板进行PCR 扩增。内参β-actin 上游引物序列5’-CCCATCTATGAGGGTTACGC-3’,下游引物序列5’-TTTAATGTCACGCACGATTTC-3’,扩增产物大小为150 bp; RASSF1A 上游引物序列5’-GAGACACCT GATCTTTCCCAAG-3 ’,下游引物序列5 ’-AGAACGTGCAGATGCTTAACAG-3’,扩增产物大小为481 bp。反应条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,30 个循环;72℃延伸10 min。取PCR 产物10 μL,行琼脂糖凝胶电泳,用Gel-Pro 凝胶扫描成像仪采集图像并分析,以RASSF1A 与β-actin 条带灰度值的比值表示RASSF1A mRNA 的相对表达量。
1.7 心肌组织中RASSF1A 蛋白的检测 心肌组织切片脱蜡,根据SP 试剂盒说明进行操作,修复抗原山羊血清封闭,加入兔抗大鼠RASSF1A 抗体(按1∶300 稀释)4℃孵育过夜,DAB 显色,在光镜下观察RASSF1A 蛋白表达,并采用Biosens Digital Imaging System v1.6 图像分析系统采集图像行半定量分析。RASSF1A 蛋白阳性反应信号呈棕黄色,以阳性区平均积分光密度表示RASSF1A 蛋白的相对表达量。
1.8 统计学处理 采用SPSS 17.0 处理数据。3组间血流动力学参数、心肌肥厚指数及心肌组织中RASSF1A mRNA 和蛋白表达的比较应用单因素方差分析及LSD-t 检验,检验水准α=0.05。
2 结果
2.1 3组大鼠血流动力学参数的比较 见表1。与对照组相比,模型组和干预组LVEDP 升高,LVSP 和(±dP/dt)max下降;与模型组相比,干预组上述指标变化小于模型组。
2.2 3组大鼠心肌肥厚指数比较 见表2。与对照组相比,模型组和干预组的心脏指数、左室指数均明显增加,但干预组的变化幅度小于模型组。
2.3 3组大鼠心肌组织病理学表现 见图1。对照组心肌细胞排列规律整齐; 模型组心肌细胞排列紊乱,有大量的心肌纤维增生并伴有炎性渗出;干预组病理学表现介于对照组和模型组之间。
2.4 3组大鼠心肌组织RASSF1A mRNA 和蛋白的表达 见图2、3 和表3。与对照组相比,模型组和干预组RASSF1A mRNA 和蛋白表达降低;与模型组相比,干预组RASSF1A mRNA 和蛋白的表达增高。
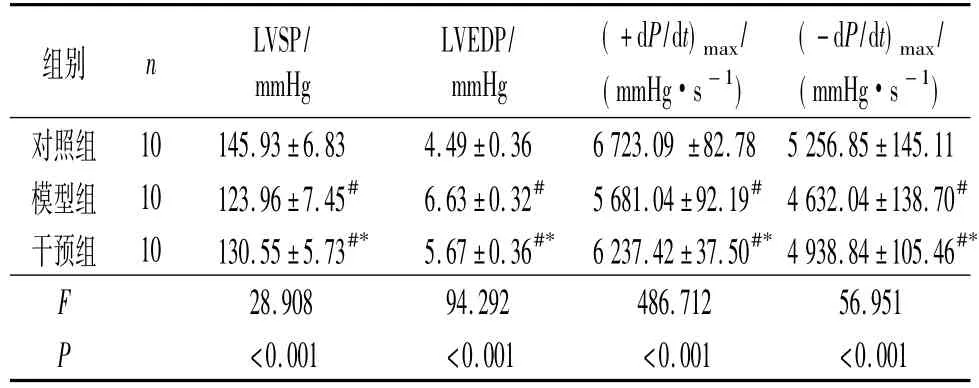
表1 3组血流动力学参数的比较
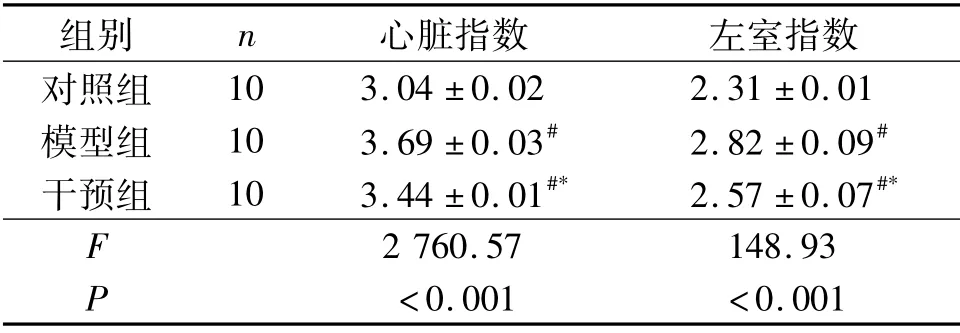
表2 3组大鼠心肌肥厚指数的比较
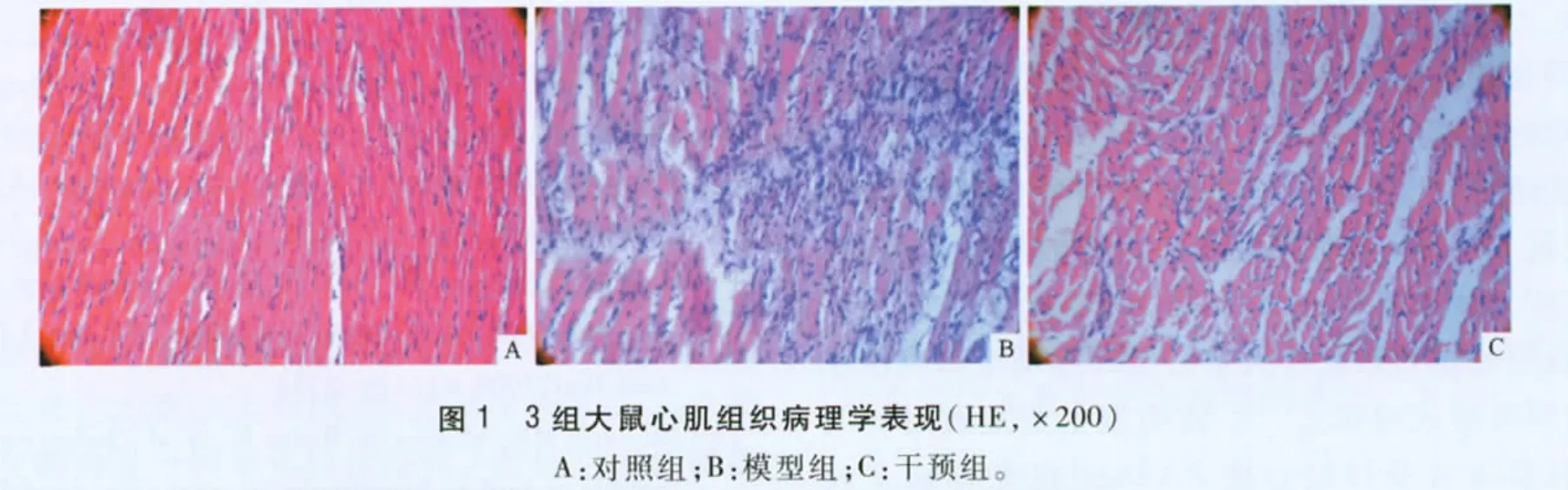
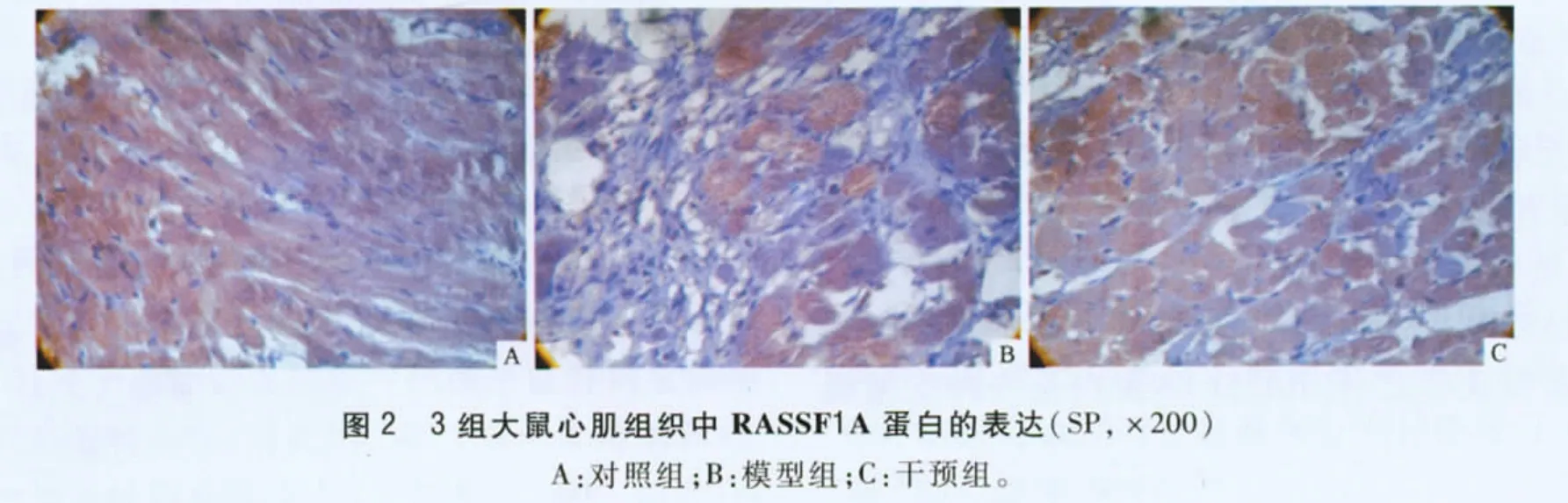
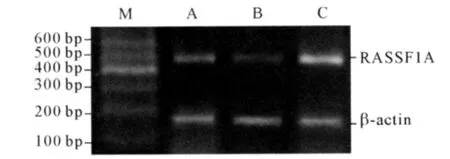
图3 3组大鼠心肌组织RASSF1A mRNA 的表达

表3 3组大鼠RASSF1A mRNA 和蛋白的表达
3 讨论
RAAS 的过度激活主要与Ras 信号通路有关。Ras 信号通路涉及多种疾病的发生,如肿瘤和心肌肥厚,该通路被激活后首先使位于细胞膜内侧的Ras 蛋白活化为Ras-GTP,Ras-GTP 可以使下游Raf磷酸化,磷酸化的Raf 以级联反应的方式调节涉及心肌肥厚发生的相关靶蛋白如转录因子、细胞骨架蛋白、蛋白激酶调节因子等,同时磷酸化的Raf 又可以活化Ras 蛋白,使其保持Ras-GTP 状态,维持Ras信号通路不断激活,最终使心脏由心肌肥厚逐渐发展至心力衰竭[5]。因此阻断Ras-GTP 与磷酸化Raf之间的这种正反馈作用将是阻遏心肌肥厚发展至心力衰竭的关键。
该研究中,连续皮下注射异丙肾上腺素10 d后,大鼠LVEDP、心脏指数及左室指数均显著增高,而LVSP、(±dP/dt)max均下降,病理检查亦显示大鼠心肌细胞排列紊乱伴大量心肌纤维增生和炎性渗出,表明模型成功建立[6]。该模型主要是通过异丙肾上腺素与β 受体结合使RAAS 过度激活而实现的。在造模同时给予替米沙坦干预后,大鼠LVEDP、心脏指数及左室指数趋于正常,LVSP、(±dP/dt)max无明显异常,心肌细胞排列较规整,说明替米沙坦能有效防止心肌肥厚的发生,该作用与抑制RAAS 的过度激活有关[4]。
RASSF1A 是在肺癌和乳癌中发现的一种抑癌基因家族成员之一。RASSF1A蛋白是一种支架蛋白,本身不具有酶的活性,通过蛋白-蛋白之间的相互作用参与各种生物代谢途径如基因转录、信号传导、细胞黏附和凋亡等一系列生物效应。有研究[7]表明RASSF1A 蛋白作为Nore1α 异二聚体可以与Ras-GTP 结合,调节Ras-GTP 的结构和功能。该研究发现,与正常心肌组织相比,RASSF1A mRNA 和蛋白在肥厚心肌组织中的表达明显减少,说明RASSF1A 可能是心肌肥厚的负性调节因子,其机制可能与调节Ras-GTP 的结构和功能有关。同时,该实验还发现,在替米沙坦干预下,大鼠肥厚心肌组织中RASSF1A mRNA 和蛋白表达增多,说明替米沙坦能够上调RASSF1A mRNA 和蛋白表达,这可能是其抗心肌肥厚的机制之一。
综上所述,替米沙坦抗心肌肥厚的机制可能与调节RASSF1A 的表达有关,但具体机制仍需进一步研究。
[1]Milani RV,Drazner MH,Lavie CJ,et al.Progression from concentric left ventricular hypertrophy and normal ejection fraction to left ventricular dysfunction[J].Am J Cardiol,2011,108(7):992
[2]Zhang P,Mende U.Regulators of G-protein signaling in the heart and their potential as therapeutic targets[J].Circ Res,2011,109(3):320
[3]Oceandy D,Pickard A,Prehar S,et al.Tumor suppressor Ras-association domain family 1 isoform A is a novel regulator of cardiac hypertrophy[J].Circulation,2009,120(7):607
[4]Mantziari L,Guha K,Khalique Z,et al.Relation of dosing of the renin-angiotensin system inhibitors after cardiac resynchronization therapy to long-term prognosis[J].Am J Cardiol,2012,109(11):1691
[5]Lorenz K,Schmitt JP,Vidal M,et al.Cardiac hypertrophy:targeting Raf/MEK/ERK1/2-signaling[J].Int J Biochem Cell Biol,2009,41(12):2351
[6]Barbosa ME,Alenina N,Bader M,et al.Induction and analysis of cardiac hypertrophy in transgenic animal models[J].Methods Mol Med,2005,112:339
[7]Avruch J,Xavier R,Bardeesy N,et al.Rassf family of tumor suppressor polypeptides[J].J Biol Chem,2009,284(17):11001
