人胎盘羊膜包裹的脱细胞同种异体神经移植修复犬坐骨神经缺损
2012-12-17张雁儒姚俊娜周明武李月白王义生
张雁儒 ,姚俊娜,周明武,李月白,王义生
1)郑州大学第一附属医院骨科郑州450052 2)郑州大学基础医学院人体解剖学教研室郑州450001 3)洛阳白马寺正骨医院骨科洛阳471002 4)中国人民解放军第153 中心医院创伤骨科郑州450042 5)郑州大学基础医学院生物化学教研室郑州450001
△男,1970年8月生,硕士,副教授,研究方向:周围神经损伤,E-mail:zhangyanru818@yahoo.com.cn
周围神经缺损是临床上常见的创伤,脱细胞同种异体神经可为缺损神经修复再生提供神经基质管和雪旺细胞基底板层等良好的再生支架物质而成为研究的热点[1-3]。羊膜为母体与胎儿间的一层生物膜,具有免疫赦免性和良好的生物兼容性,且来源广泛,用其包裹神经后可形成假鞘进而发挥基底膜的作用,可为神经纤维的再生构建一个良好的微环境[4-6]。作者采用人胎盘羊膜包裹的脱细胞同种异体神经移植修复犬坐骨神经缺损,探讨胎盘羊膜包裹的脱细胞同种异体神经移植技术的可行性。
1 材料与方法
1.1 实验动物及主要试剂、仪器 健康杂种犬15只,由河南省实验动物中心提供,体质量(20±4)kg,雌雄不拘,分笼饲养,每笼饲养1 只,自由摄食、饮水。EC 耳脑胶(广州白云医用胶有限公司),ASX-1 手术显微镜(上海安信光学仪器制造有限公司),Wi3554 双极电凝器(北京东西仪科技有限公司),八通道肌电仪(合肥旭宁科技有限公司),RD-201V 型冷冻离心机(日本岛津公司)。
1.2 胎盘羊膜的制备 健康顺产胎儿的羊膜由洛阳市中心医院妇产科提供,参考陈有刚等[6]的方法制备,反复清洗羊膜组织直至在光镜下观察清洁、透亮为止,然后投入1 g/L NH4OH 溶液中,稍后取出并放入250 mL 磷酸缓冲液中,将其分割成宽2~4 cm、长4~9 cm 的条块样,并保存在-40℃冰箱中。
1.3 犬脱细胞神经的制备 取3 只犬麻醉后在右股内侧作长约10 cm 纵行切口,自股内侧肌间隙暴露并切断股动脉,放血处死动物,向内后方牵开后股二头肌,暴露坐骨神经,两侧均切取7~11 cm 坐骨神经干,按照Sondell 等[7]的方法萃取,得到犬脱细胞坐骨神经,灭菌处理后备用。
1.4 实验分组和坐骨神经缺损动物模型制备 12只犬按照随机数字表法分为同种异体神经移植(A)组和羊膜包裹的脱细胞同种异体神经移植(B)组,每组6 只。麻醉犬后行右后肢体后侧纵行切口,牵开股二头肌,暴露并切除一段坐骨神经,造成长约6.0 cm 长的神经缺损。A组取相应长度同种异体脱细胞神经,在显微镜(×10)下用8/0 无损伤缝合线行神经外膜缝合。B组行取相应长度的同种异体脱细胞神经远断端剪去2 mm,用8/0 无损伤缝合线在显微镜下行端端对合,神经断端与移植神经两端长度及直径匹配对合后,吻合口采用胎盘羊膜涂抹耳脑胶,黏合固定(羊膜需分别超出断端远、近端吻合口1.5 cm),注意避免耳脑胶污染吻合口。2组均采用肌肉覆盖保护移植的坐骨神经,彻底止血后,缝合关闭伤口,创面纱布覆盖,绷带固定。
1.5 观测指标
1.5.1 一般情况 术后犬分笼饲养,8 周内详细观察并记录其精神状态、肢体活动、伤口情况和患肢运动功能。术后16 周内详细观察并记录患足溃疡形成及愈合情况、患肢功能的恢复情况及并发症的发生情况。
1.5.2 形态学观察 术后16 周,取坐骨神经移植段,取材分别包含神经近端吻合口以近及远端吻合口以远1 cm,大体形态观察后固定、常规石蜡包埋,切片范围为包含神经吻合口远近端2 mm,采用连续切片法,吻合口处行纵切片,其他部位行横切片。常规HE 染色、髓鞘染色,计数神经束内轴突,计算轴突密度。
1.5.3 肌电图和神经电生理检测 术后16 周时暴露并游离术侧移植段及对侧坐骨神经,将刺激电极置于近端神经吻合口处,记录电极刺入比目鱼肌,记录比目鱼肌诱发电位的波幅和时限、双侧坐骨神经的运动神经传导速度(MNCV)和感觉神经传导速度(SNCV)。
1.6 统计学处理 采用SPSS 13.0 处理数据,2组犬术后16 周轴突密度、比目鱼肌诱发电位的波幅和时限以及神经传导速度比较的应用两独立样本t 检验,检验水准α=0.05。
2 结果
2.1 2组犬术后一般情况 术后2~6 周,2组犬术侧足部红肿、溃疡及跛行,小腿三头肌力量较差,行走时踝关节不能完全直立。术后7 周,2组犬运动功能均有不同程度的恢复,A组足部溃疡愈合较B组慢。术后16 周,A组犬足部及小腿红肿; B组犬神经功能恢复,小腿肌肉肌力恢复,犬右后肢能够站立。
2.2 2组移植段神经大体观察 16 周时,A组移植段神经连续性好,与周围组织粘连严重,周围局部组织增生形成疤痕,吻合口可触及硬结,局部呈梨形改变,神经表面血管化程度差,移植段远近端坐骨神经干变细变硬。B组移植段神经连续性好,无移植段神经的脱落及分离,与周围组织没有硬化性瘢痕粘连,移植段神经周围炎症反应不明显,神经表面有明显毛细血管网,吻合口略膨大,未触及硬结及卡压性梨形改变,移植段远近端神经干外观基本正常。
2.3 2组神经移植体组织形态学观察结果 术后16 周,2组均可见有髓神经纤维,密度分布欠规则不均匀。见图1、表1。B组可见大量再生的神经纤维和雪旺细胞。
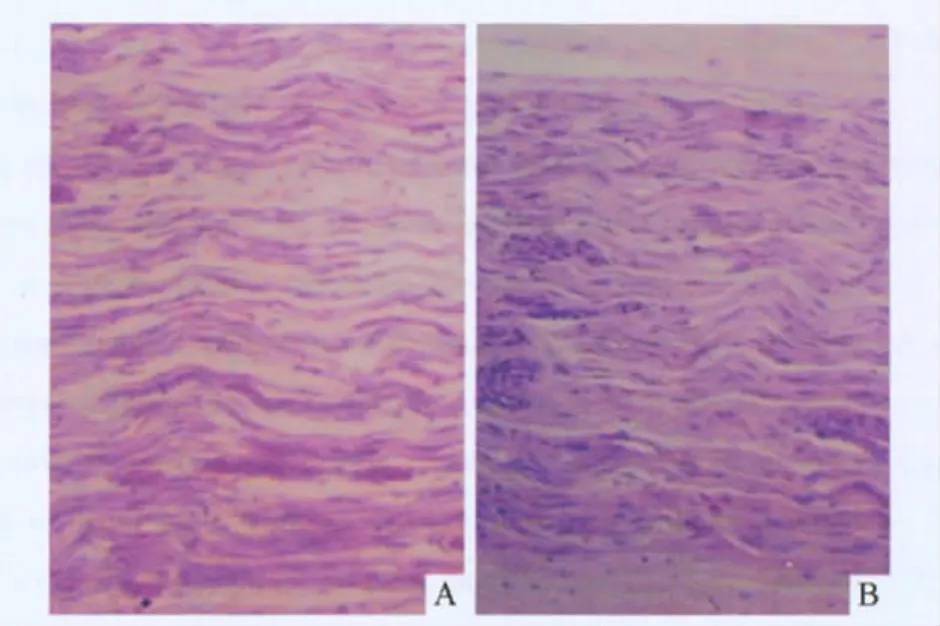
图1 A组(A)和B组(B)神经移植体组织形态学表现(HE,×400)
2.4 2组术后16 周肌电图和神经电生理测量结果见表1。
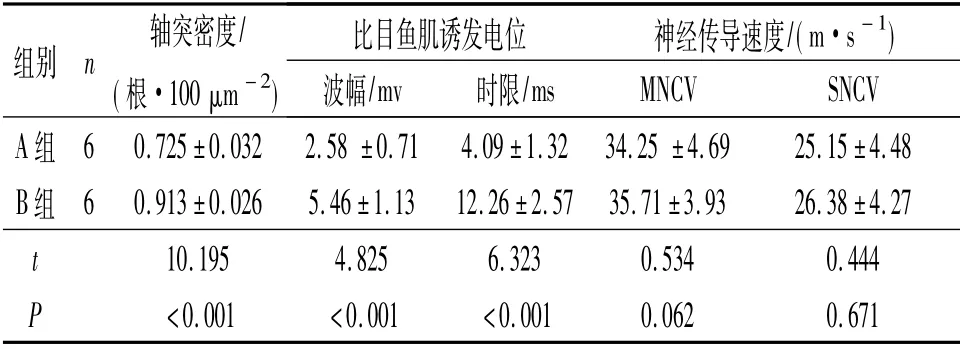
表1 2组术后16 周轴突密度、比目鱼肌肌电图和神经传导速度比较
3 讨论
周围神经缺损是临床常见病,若不能尽快修复缺损的神经,将造成靶器官长期失神经支配、失神经营养,导致肌肉萎缩、感觉功能丧失等,最终将严重影响患者的感觉运动功能。自体神经移植效果虽然可靠,但是其来源非常有限,并且切取自体神经会给患者带来新的创伤。
作者采取优化的化学萃取方法制备同种异体脱细胞神经,不仅有效地清除了异体神经的免疫原性成分,同时还保留了雪旺细胞、基底膜及其组织结构的完整。近年来,国内外学者[8-10]采用此方法在动物实验中处理同种异体神经作为桥接供体效果满意。该研究结果表明,与单纯同种异体神经移植比较,由人胎盘羊膜包裹的同种异体移植段神经无脱落及分离,与周围组织没有粘连,神经表面有新生毛细血管网,光镜下可见大量再生的神经纤维和雪旺细胞,提示人胎盘羊膜包裹的同种异体神经移植修复犬坐骨神经缺损,更有利于轴突、神经纤维细胞的再生及神经功能的恢复。
神经传导速度和肌电图是检测周围神经电生理功能最常用的观察指标,MNCV 和SNCV 分别反映了坐骨神经运动和感觉纤维的功能状态。该研究结果显示,术后16 周,B组犬的比目鱼肌诱发电位波幅和时限明显高于A组,而2组患侧坐骨神经传导速度差异无统计学意义,这是否是由于观察时间较短所致,尚需在以后的实验中进一步观察。
综上所述,异体神经经化学萃取后是抗原性极低的神经移植替代材料,人胎盘羊膜包裹脱细胞同种异体神经可以形成一个相对密闭长形的管道-神经间室,充分发挥接触诱导作用,能够引导再生神经轴突从断离神经的近端趋向远端,避免缝线对吻合口的干扰,结合应用医用胶,选择直径、长度相同的异体犬脱细胞神经,减少神经轴突的错向再生,同时又保证了足够的吻合强度,可避免术后神经断端分离、脱落现象的发生,对提高周围神经的修复效果具有积极的作用。作者的实验研究证明在神经再生过程中创造一个良好的微环境能够实现神经纤维的高选择性再生,同时也表明,胎盘羊膜包裹同种异体神经在周围神经修复中能减少吻合口部位疤痕,有利于神经再生,是一种简便、有效的周围神经缺损的修复方法,具有广阔的应用前景,值得进一步研究应用。
[1]Hudson TW,Zawko S,Deister C,et al.Optimized acellular nerve graft is immunologically tolerated and supports regeneration[J].Tissue Eng,2004,10(11/12):1641
[2]Dubovy P,Svizenska I,Klusakova I,et al.Laminin molecules in freeze-treated nerve segments are associated with migrating Schwann cells that display the corresponding alpha6beta1 integrin receptor[J].Glia,2001,33(1):36
[3]Matsumoto K,Ohnishi K,Kiyotani T,et al.Peripheral nerve regeneration across an 80-mm gap bridged by a polyglycolic acid (PGA)-collagen tube filled with laminincoated collagen fibers:a histological and electrophysiological evaluation of regenerated nerves[J].Brain Res,2000,868(2):315
[4]Sun MX,Tang JS,Xu WJ,et al.Influences of decellularization processes on immunogenicity of chemically acellular nerve allografts[J].Zhonghua Wai Ke Za Zhi,2006,44(4):275
[5]Hudson TW,Liu SY,Schmidt CE.Engineering an improved acellular nerve graft via optimized chemical processing[J].Tissue Eng,2004,10(9/10):1346
[6]陈有刚,朱家恺.人羊膜基底膜桥接神经缺损实验研究[J].中华显微外科杂志,1990,13(1):20
[7]Sondell M,Lundborg G,Kanje M.Regeneration of the rat sciatic nerve into allografts made acellular through chemical extraction[J].Brain Res,1998,795(1/2):44
[8]衷鸿宾,卢世璧,侯树勋,等.去细胞神经同种异体移植的运动功能恢复[J].中华创伤杂志,2002,18(9):533
[9]戴传昌,王炜,曹谊林,等.去细胞异体神经基膜管桥接神经缺损的实验研究[J].中华整形外科杂志,2001,17(6):366
[10]Tang F,Shang K,Wang X,et al.Differentiation of embryonic stem cell to astrocytes visualized by green fluorescent protein[J].Cell Mol Neurobiol,2002,22(1):95
