基于动力学的煤低温氧化机理研究*
2012-12-12邬剑明王文文
邬剑明 王文文
(太原理工大学矿业工程学院,山西省太原市,030024)
1 引言
煤的低温氧化问题是煤化学领域的重要研究课题,同时低温氧化也是煤自燃的首要步骤和必经过程。煤的低温氧化,涉及一系列的复杂的物理化学过程,包括氧的物理化学吸附,氧化物中间体的生成,稳定态氧化物的形成,以及氧化物的热分解。煤低温氧化的外在表现主要体现在煤体温度升高以及指标性气体(CO2和CO)的释放。活化能是研究煤低温氧化的一个重要的动力学参数。煤低温氧化动力学能把温度变化和气体释放结合起来研究,同时由实验所得到的活化能为煤低温氧化提供理论依据。人们利用热分析仪器对煤低温氧化动力学进行了大量研究,但由此得出的表观活化能很难深入研究和理解煤的低温氧化机理。基于指标性气体(CO2和CO)进行动力学研究,可以更深入地研究煤低温氧化过程。因此本文依据指标性气体CO2和CO气体解析过程特性,进行活化能计算,进而进行机理分析。
2 实验部分
2.1 煤种
选取易于自燃的神东长焰煤作为实验用煤。首先将采取的新鲜煤样粉碎,筛分出粒径为0.180~0.250μm的煤样,粉碎新鲜煤样一部分直接用于实验,剩余的煤样充氮气保存。其工业分析和元素分析见表1。

表1 神东煤样的工业分析和元素分析
2.2 实验系统
实验采用本实验室研制的煤低温氧化模拟实验系统,其流程图如图1所示。该系统由反应器,保温设备,气路通道以及相应的监测设备等组成。实验压力为常压,N2和O2分别由气瓶供给,其流量通过相应的质量流量计控制,按照4∶1比例通入气路,然后在气体混合器中混合均匀,气体总流量为50ml/m in。混合气体在进入反应器前,会被加热线圈预热到实验稳定状态,以免引起反应器内温度波动。在反应器内有一对多空石英烧结板,用来放置煤样。烧结板孔径结构为20μm,分别固定在反应器的上下两端。同时烧结板也可以用来分散气体,保证气体进入反应器的均匀性。煤体和反应器壁面温度由一对S型热电偶进行控制。反应生成的CO2和CO通过气相色谱(G C-950)进行检测。O2的浓度通过顺磁氧分析仪(A D C-7000)进行检测。在理想实验条件下,当N2-O2混合气刚好接触煤体颗粒时刻作为实验开始时间。氧气浓度的测定只能在反应器出口进行测量,因而把实验开始时间定为氧气被检测到的时刻。
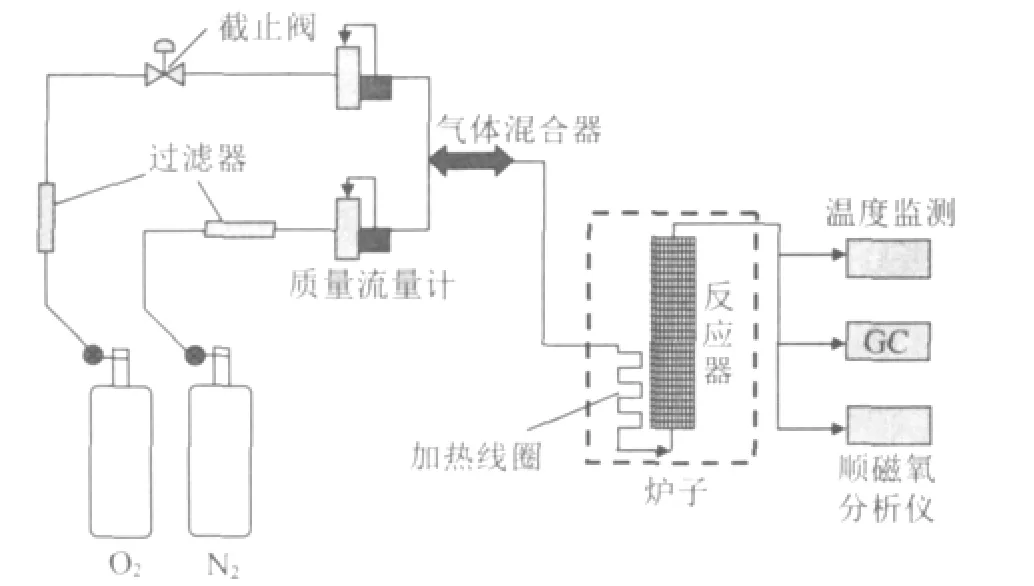
图1 实验装置示意图
实验为恒温实验,实验温度为40~100℃。在实验开始前,先把炉子升温到指定实验温度,然后把150g左右的煤样放入反应器内,用纯N2进行吹扫12h以除去煤颗粒中的水分。当开始进行实验时,打开O2气路,并调整N2和O2的流量,使气体总流量稳定在50ml/m in;实验结束后,关闭O2气路,用N2吹扫实验后的煤样,直至煤样冷却至室温,然后对煤样进行称重和保存。
CO2和CO生成速率由式(1)、式(2)进行计算:
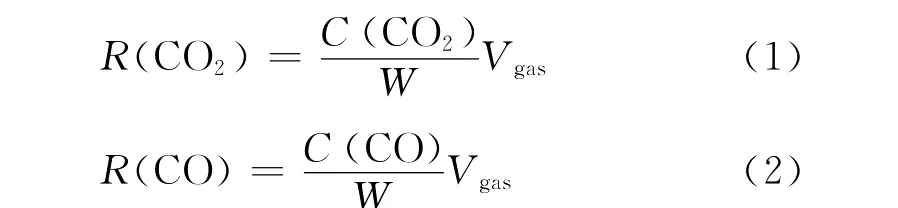
式中:R(CO2)——CO2生成速率,kmol/kg·s;
R(CO)——CO生成速率,kmol/kg·s;
C(CO2)——CO2的瞬间浓度,kmol/ml;
C(CO)——CO的瞬间浓度,kmol/ml;
W——煤样质量,kg;
Vgas——气体流量,ml/s。
3 煤低温氧化过程气态产物的生成特性研究
在不同实验温度条件下CO2和CO的释放量随氧化时间变化曲线见图2。由于在实验开始前,实验装置系统内有部分的N2没有被排出体系,这部分N2会稀释生成的气体产物,从而造成实验观察误差,因此实验前15m in的实验数据没有显示在图2中。从图2可以明显看出在刚开始的几个小时CO2的释放量迅速降低,然后缓慢降低,最终几乎处于稳定状态。CO的释放量随氧化时间增加而缓慢降低。据文献报道,在煤低温氧化过程中,煤颗粒表面以孔结构中的活性位点逐渐减少,生成的稳定化合物逐渐在煤表面聚集,从而使CO2和CO的生成量逐渐降低。CO的降低趋势明显低于CO2的降低趋势,这说明了CO和CO2分别经历不同的释放途径。
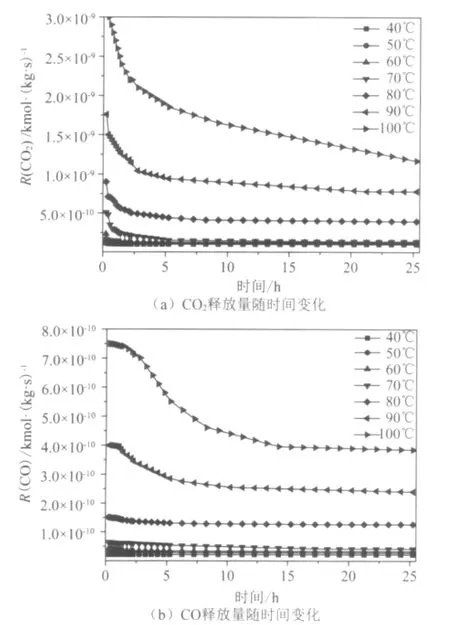
图2 不同温度下CO2和CO释放量随时间变化趋势
从图2可以看出,温度对CO2和CO的生成有明显的促进作用。尽管随着低温氧化时间增加,CO2和CO的生成量呈现降低趋势,但是CO2和CO的生成量随着温度上升明显增加,特别是温度高于70℃时。实验结果与他人的研究结果相一致。CO释放量随温度的增加趋势高于CO2的增加趋势,说明CO的生成对温度更加敏感。
CO2和CO的生成比率是指CO2和CO在稳定生成速率时,某一时刻CO2的生成速率与CO的生成速率比值,用R(CO2)/R(CO)表示。R(CO2)/R(CO)在不同温度下的变化情况如图3所示。在40~60℃实验条件下,在刚开始的几个小时内R(CO2)/R(CO)呈现出相当高的值;随着氧化时间增加,R(CO2)/R(CO)迅速降低,5h后R(CO2)/R(CO)逐渐稳定在一个固定值,不随时间变化。在70~100℃时,尽管在实验刚开始时R(CO2)/R(CO)值较低,但随着氧化时间增加,R(CO2)/R(CO)在很长一段时间内还没有达到平衡,例如在100℃实验条件下R(CO2)/R(CO)在25h仍未达到平衡。同时还可以看出,R(CO2)/R(CO)在70~100℃时,呈现出一个先增大后减小的趋势。R(CO2)/R(CO)的变化与分解不稳定中间体有很大的关系:一个大的R(CO2)/R(CO)值表明分解中间氧化物在煤的氧化过程中起到重要作用;一个小的或者稳定的R(CO2)/R(CO)值表明煤样已被氧化,或者说煤样表面用来吸附氧的活性位点明显降低。基于上面分析,R(CO2)/R(CO)可以用来分级煤的氧化程度,以及用来评价煤的低温氧化能力。
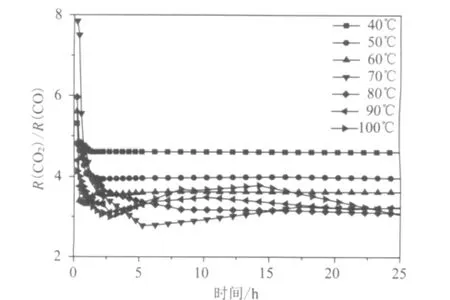
图3 不同温度下R(CO2)/R(CO)比率随时间变化趋势
CO2和CO的生成比率的对数与温度倒数的关系用l n(R(CO2)/R(CO))~1/T表示,见图4。尽管这些数据稍微有些分散,但是l n(R(CO2)/R(CO))与1/T之间有明显关系。随着低温氧化温度增加,l n(R(CO2)/R(CO))迅速降低,特别是氧化温度低于70℃(343K)。由图4还可以看出,l n(R(CO2)/R(CO))与1/T的关系可以拟合成两条直线,而不是一条直线,并且转折点温度为70℃。这充分说明煤的低温氧化含氧气体的生成至少存在两条途径,一个在温度低于70℃时,起主导作用;一个在温度高于70℃时,起主导作用。前者对温度更敏感,随着实验温度的增加,CO2和CO生成量迅速增加,并且CO的增加量明显高于CO2增加量,导致在第一途径的直线斜率明显大于第二途径的直线斜率。同时研究表明,70℃是煤低温氧化转折温度,当温度高于70℃时,煤氧化速率加快,在较低温度下生成的稳定的氧化物,例如酚羟基(-OH),羰基(-C=O)和羧基(-COOH)等开始分解,生成CO2和CO,同时这些稳定化合物的降解会产生新的活性位点,为进一步发生氧化反应提供载体,从而使煤氧化速率加快。
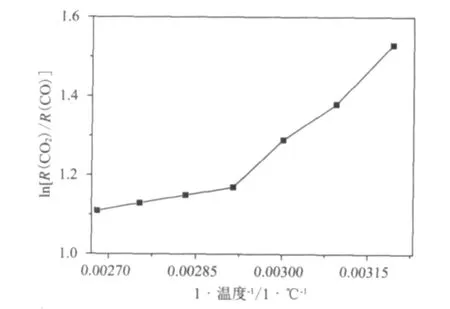
图4 不同温度下的平衡态时CO2和CO的生成比率的对数与温度倒数的关系
4 CO2和CO的生成机理
一般认为,在煤的低温氧化过程中存在两条平行的途径:吸附途径和燃烧途径。尽管燃烧途径已经被大多数研究人员所接受,但是没有直接的实验现象来证实这一机理。燃烧反应途径类似于煤直接燃烧反应,随着温度升高,反应加剧。燃烧反应机理类似于碳在573K时发生的氧化反应,也就是说这种反应只发生在特定的活性位点,并且这些活性位点能快速与O2分子反应,并且发生快速的气体解析过程。在吸附反应途径中煤低温氧化按以下顺序进行:(a)煤孔结构表面发生O2化学吸附,并形成不稳定的碳氧化合物(例如过氧化物和过氧化氢);(b)这些不太稳定的氧化物发生分解,生成含氧气体产物和稳定的含氧物种,包括酚羟基(-OH),羰基(-C=O)和羧基(-COOH);(c)温度升高,稳定含氧物种分解,产生新的活性位点。同时本文认为在第二种途径(b)中生成的稳定的含氧物种,在温度升高时,也会发生燃烧反应。这两条平行的途径如图5所示。从上面分析可以看出,燃烧反应途径是温度函数,随着温度增加,反应速率迅速增加。另外,当温度高于70℃时稳定氧化物的分解反应速率也会随着温度的增加而迅速增加。
煤的低温氧化是一个非常复杂的过程,在不同的温度阶段存在不同的反应过程,活化能是研究煤低温氧化的一个重要的动力学参数。为了能够深入研究这两种途径在煤低温氧化阶段所发挥的作用机理,本文从活化能的角度进行分析。
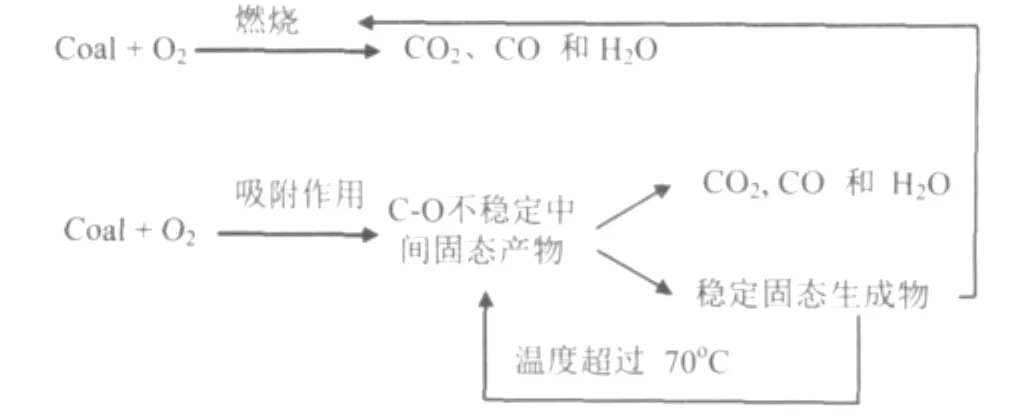
图5 煤低温氧化反应途径示意图
煤的氧化反应能够进行所需的最小能量叫作活化能,活化能的大小决定了氧化反应的速度,是反映煤自燃倾向性的重要指标。
本文假设在温度低于70℃条件下,煤的低温氧化以吸附途径为主;当温度高于70℃时,煤的低温氧化以燃烧途径为主。在各个实验温度点下,以稳定态的R(CO2)/R(CO)作为CO2/CO的释放速率,对1/T作图,做出的曲线如图6所示,求出的活化能列于表3中。从图6可以看出,拟合结果与阿伦尼乌斯(A r r h e n i u s)模型符合的很好。从表3可以看出,在吸附途径中求出的CO2和的活化能为很低,仅为8.97k J/m o l,这说明了煤低温氧化很容易发生。CO的活化能是CO2的二倍还多,这充分说明,在温度低于70℃条件下煤低温氧化容易生出CO2而不是CO。在燃烧途径中,求出的活化能明显高于吸附途径活化能。尽管在温度高于70℃时,难免有吸附反应发生,但是在求活化能过程中我们选取的是稳定态的R(CO2)/R(CO),这个阶段基本已经不存在吸附反应,另外吸附途径求得的活化能很低,也就是说通过计算求得活化能基本上就是燃烧途径的活化能。在燃烧途径中,计算得到的CO的活化能已基本与CO2的活化能相当,也就是说在温度高于70℃时,煤低温氧化会产生大量的CO。通过对比计算出的吸附途径和吸附途径的活化能,验证了前面假设的正确性。同时计算结果也为实验现象和煤矿现场有大量CO生成提供理论依据。
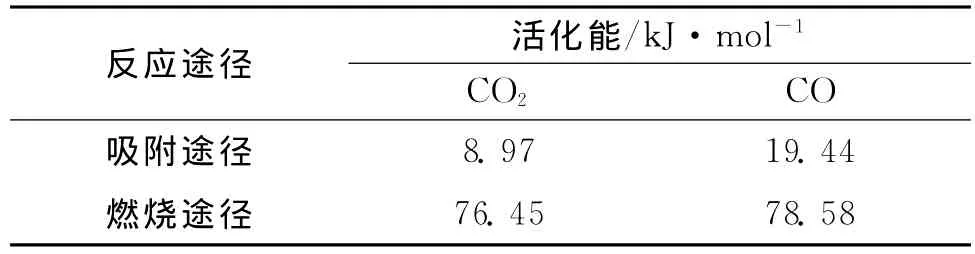
表3 煤低温氧化活化能

图6 CO2和CO在不同生成途径的活化能曲线
5 结论
本文在恒温反应装置基础上,研究煤低温氧化行为。根据CO2和CO指标气体释放规律,分析研究了煤低温氧化阶段气体解析过程特性,得出如下结论:
(1)在煤低温氧化过程中,煤颗粒表面以孔结构中的活性位点逐渐降低,同时稳定的化合物逐渐在煤表面聚集,引起在刚开始的那段时间CO2和CO的生成量迅速降低。
(2)R(CO2)/R(CO)可以用来分级煤的氧化程度,以及用来评价煤的低温氧化能力。
(3)在吸附途径中,生成CO2的活化能很低,表明煤低温氧化很容易进行。生成CO的活化能高于CO2活化能,说明在吸附过程中生成的不稳定的过氧化物中间体分解会生成CO2。在燃烧途径中,计算得到的CO2和CO活化能基本相等,低温氧化会产生大量的CO。
(4)在实验基础上,提出了煤低温氧化的两条途径,并通过计算得到这两条途径的活化能,验证了这两条途径的存在性。在温度低于70℃时,吸附途径在低温氧化过程中起主导作用;当温度高于70℃时,燃烧途径起主导作用。并且燃烧途径活化能远大于吸附途径活化能。
[1] Van Krevelen D W.Coal:Typology–chemistry–physics–COnstitution[M].London:Elsevier,1993
[2] Berkowitz N.The chemistry of coal[M].Amsterdam:Elsevier,1985
[3] 王俊峰,邬剑明,梁子荣等.煤升温氧化过程中R n的析出与CO、CO2、CH4相关性实验研究[J].中国煤炭,2009(3)
[4] 薛冰,李再峰,陈兴权等.低阶煤在干燥氧气下低温氧化过程的机理研究[J].煤炭转化,2006(2)
[5] 李永昕,薛冰,柳娜等.低阶煤在湿的氧气下低温氧化过程热力学规律[J].煤炭转化,2007(2)
[6] 郭小云,王德明,李金帅.煤低温氧化阶段气体吸附与解析过程特性研究[J].煤炭工程,2011(5)
[7] 刘剑,王继仁,孙宝铮.煤的活化能理论研究[J].煤炭学报,1999(3)
