大鼠子痫前期动物模型的建立
2012-12-09龚护民陈芳荣
卢 敏,龚护民,施 蕾,陈芳荣
(海南省人民医院秀英产科,海南 海口 570311)
·实验研究·
大鼠子痫前期动物模型的建立
卢 敏,龚护民*,施 蕾,陈芳荣
(海南省人民医院秀英产科,海南 海口 570311)
目的 研究子痫前期的病因、发病机理、治疗及预防方法,建立大鼠子痫前期动物模型。方法 将孕鼠随机分为两组,两组自妊娠第12天起皮下分别注射生理盐水和亚硝基左旋精氨酸甲酯(L-NAME),共7d。妊娠第10天起测量大鼠尾动脉收缩压,1次/d,直至分娩。同时,检测两组孕鼠的尿蛋白、肝、肾功能,观察仔鼠和胎盘的异常改变,并进行组织病理学检查。结果 对照组孕鼠尾动脉收缩压随着妊娠进展有逐渐下降趋势,而子痫前期组孕鼠尾动脉收缩压在妊娠第13天后显著升高。同时子痫前期组孕鼠出现蛋白尿、肝肾功能和组织结构改变、胎鼠发育迟缓等情况。结论 注射L-NAME可导致孕鼠产生类似人类子痫前期的表现,而且在病理生理方面也与人类子痫前期极其相似,是一个较为理想的子痫前期动物模型。
大鼠;亚硝基左旋精氨酸甲酯;子痫前期;收缩压
子痫前期是妊娠中、晚期常见的严重并发症[1],临床表现为妊娠后期出现高血压、水肿、蛋白尿,严重时可导致心、肝、肾功能衰竭及胎儿宫内发育迟缓,甚至母婴死亡,其病因及发病机理至今尚未完全阐明[2]。近年来,内源性一氧化氮(NO)在子痫前期发病机理中的作用越来越受到重视[3]。亚硝基左旋精氨酸甲酯[4](Nitro L arginine methyl ester,L-NAME)是一种一氧化氮合成酶抑制剂,竞争性抑制体内NO的合成。笔者选用L-NAME抑制孕鼠体内NO合成,为研究子痫前期建立一个理想的动物模型。
1 材料与方法
1.1 实验动物 清洁级成年Wistar大鼠(由中南大学湘雅医学院实验动物中心提供),雌性体重为190~230g,雄性体重为210~260g,在室温18~28℃、相对湿度40%~70%的环境中饲养,不控制饲料和饮水。在发情期,将雌性大鼠和雄性大鼠按2:1比例同笼饲养,每天早晨阴道分泌物镜检,发现精子为妊娠第1天。试验中意外死亡的孕鼠均予及时补充。
1.2 实验方法
1.2.1 试剂 亚硝基左旋精氨酸甲酯(L-NAME)购于Sigma公司。
1.2.2 分组与给药 将孕鼠随机分为两组,正常妊娠组和子痫前期组,每组15只。自妊娠第12天开始,两组孕鼠皮下分别注射生理盐水(与L-NAME同体积)和L-NAME(剂量为125mg·d-1·kg-1),共7d。
1.2.3 血压测定 两组孕鼠均于妊娠第10天开始测量尾动脉收缩压,每日清晨1次,直至分娩。测量方法为:先把孕鼠置于预热箱内预热至36℃~38℃,待其安静后以动物无创血压测试仪(成都泰盟科技有限公司,原理与测人体肱动脉血压相似)测量,测3次,取平均值。
1.2.4 尿蛋白测定 分别于妊娠第10天、第20天将大鼠置标准代谢笼内饲养,分别收集两组孕鼠24h尿量,以磺基水杨酸比浊定法测定尿蛋白浓度。
1.2.5 肝、肾功能测定 两组孕鼠分别于分娩前,乙醚吸入麻醉状态下开腹,抽取下腔静脉血2ml,在室温下凝结20min后离心,取血清在HITACHI 7170A全自动生化分析仪上测谷丙转氨酶(ALT)、总胆红素(TBIL)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CRE)和尿酸(UA)等指标。
1.2.6 仔鼠、胎盘测量 临分娩前,剖宫取仔,记录两组孕鼠的仔鼠数、畸形率、死胎率,测仔鼠体重、胎盘湿重和面积。
1.2.7 组织病理学检查 剖宫产后处死母鼠,取母鼠的子宫胎盘、肝、肾,置入10%甲醛溶液内固定24h以上,乙醇系列脱水,透明,石蜡包埋成块后,连续切片,HE染色,在光镜下观察其组织病理学改变。
1.3 统计学方法 采用SPSS16.0软件进行统计学分析,计量资料以均数±标准差(x-±s)表示,进行t检验和方差分析,部分数据资料方差不齐,采用近似t检验中的Cochran&Cox法。计数资料用χ2检验。检验水准:α=0.05。
2 结 果
2.1 血压测定 正常孕鼠(对照组)尾动脉收缩压随着妊娠进展有逐渐下降趋势,妊娠第10天为(100.8±3.7)mmHg(1mmHg=0.133kPa),妊娠第20天为(97.3±6.0)mmHg,但差异无统计学意义(P>0.05)。皮下注射L-NAME后24h后,孕鼠(子痫前期组)尾动脉收缩压显著升高(P<0.01),妊娠第13天为(129.8±3.7)mmHg,妊娠第20天为(134.3±6.0)mmHg(图1)。
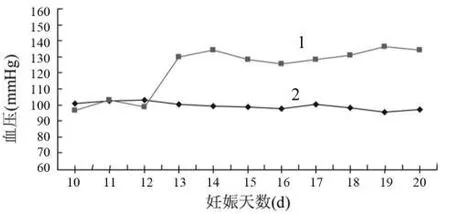
图1 对照组和子痫前期组孕鼠妊娠中后期血压变化
2.2 尿蛋白测定 皮下注射L-NAME后,子痫前期孕鼠尿蛋白浓度较正常孕鼠(对照组)显著增加(P<0.01)(表1)。
表1 对照组和子痫前期组孕鼠24h尿蛋白的变化(mg/L,±s)

表1 对照组和子痫前期组孕鼠24h尿蛋白的变化(mg/L,±s)
注:与正常对照组比较,*P<0.01。
组别 只数 第10天 第20天正常孕鼠子痫前期孕鼠1010410.57±40.50408.90±58.40412.35±62.45795.24±58.86*
2.3 肝、肾功能测定 剖宫产时抽取下腔静脉血检测孕鼠血清ALT、TBIL、ALB、BUN、CRE、UA,子痫前期孕鼠均较对照组有显著升高(P<0.01),说明L-NAME对肝、功能有一定影响(表2)。
表2 对照组和子痫前期组孕鼠肝肾功能比较(±s)

表2 对照组和子痫前期组孕鼠肝肾功能比较(±s)
注:与正常对照组比较,*P<0.01。
组别正常孕鼠子痫前期孕鼠只数1515ALT(U/L)24.5±6.773.3±7.1*TBIL(mmol/L)16.2±0.725.1±1.4*ALB(g/L)40.5±1.530.5±1.0*BUN(mmol/L)7.2±0.510.1±0.8*CRE(μmol/L)35.6±6.059.9±4.8*UA(μmol/L)110.3±20.4180.4±13.7*
2.4 仔鼠、胎盘测量 子痫前期孕鼠的仔鼠数目、仔鼠体重、胎盘面积等均逊于正常孕鼠,死胎数明显增加(P<0.01)(表3),且出现仔鼠后肢短缩畸形。
表3 两组胎鼠、胎盘、畸形率和死胎率的比较(±s)
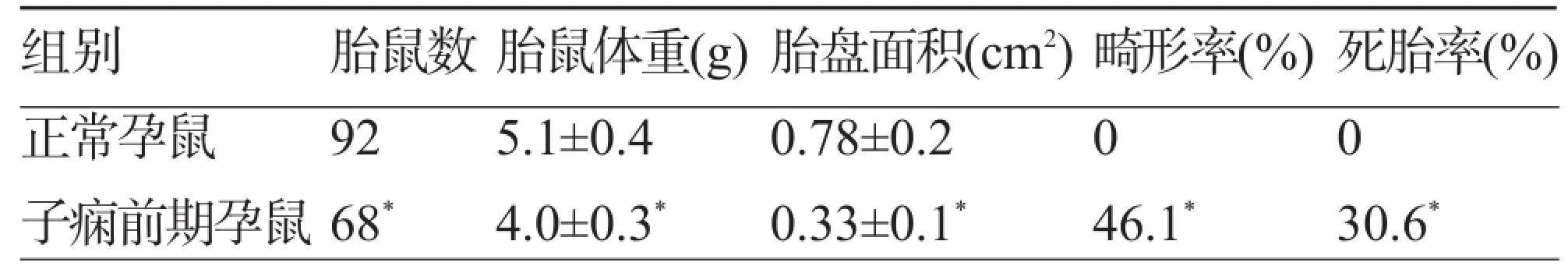
表3 两组胎鼠、胎盘、畸形率和死胎率的比较(±s)
注:与正常对照组比较,*P<0.01。
组别正常孕鼠子痫前期孕鼠胎鼠数9268*胎鼠体重(g)5.1±0.44.0±0.3*胎盘面积(cm2)0.78±0.20.33±0.1*畸形率(%)046.1*死胎率(%)030.6*
2.5 组织病理学检查 子痫前期孕鼠显示部分肾小球囊腔内有渗出,系膜细胞增生、系膜基质增多,肾小动脉壁玻璃样变性,血管壁增厚,管腔明显变小,肾小管充满蛋白管型(图2A);肝细胞水泡样变性及灶性坏死(图2B);胎盘蜕膜带肿胀增厚,炎性细胞浸润及纤维素样坏死,基带滋养叶巨细胞增生,基带增厚,迷路带滋养叶细胞增生,伴肿胀肥大、空泡样变,血间膜增厚伴纤维蛋白沉积(图2C)。正常对照组孕鼠上述改变较轻(图2D)。
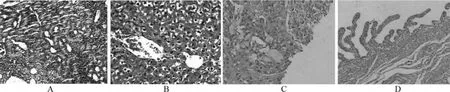
图2 两组孕鼠肾、肝、胎盘组织的病理切片照片(×50倍)
3 讨论
子痫前期是妊娠中晚期出现的一种妊娠特异性综合征。目前,普遍认为子痫前期的主要发病机理是血管痉挛和内皮活化所致器官灌注减少,其病因可能与母胎免疫失衡、遗传因素、凝血和纤溶失衡及氧化应激等有关[5]。随着内源性NO在高血压发病机理中研究的深入,其在子痫前期发病机理中的作用越来越受到学术界的认可。NO是调节血管张力的重要因子,由内皮细胞产生,其直接作用于平滑肌扩张血管,降低血管收缩反应性。正常妊娠时母体心输出量增加,血容量增多,心率增快,但血压却维持正常或稍低,认为NO在很大程度上参与了妊娠期心血管系统的调节。
L-NAME是一种一氧化氮合成酶抑制剂,竞争性抑制体内NO的合成。注射L-NAME抑制孕鼠体内NO合成可产生类似高血压症候群。Sonin等[6]认为,抑制血管内皮细胞NO合成使孕鼠血管系统对血管紧张素Ⅱ、去甲肾上腺素等的反应性增加而导致血压升高。蛋白尿是子痫前期的基本特征之一,严重患者常伴肾功能损害及肾脏结构的改变[7]。本实验结果显示:注射L-NAM E可导致孕鼠的尿蛋白增加、肾功能损伤、肾小球结构改变、肾小管充满蛋白管型,这些与人类子痫前期的肾脏病变特点类似[8]。注射L-NAME可使血清ALT和TBIL明显升高、ALB明显降低,并伴有肝小叶周边区域肝脏局灶性变性坏死,这些特征与人类子痫前期的肝脏病变相符[9]。应用L-NAME抑制孕鼠内源性NO合成,可使相应血管收缩,胎鼠胎盘血液灌注量减少[10]可导致死胎、胎鼠宫内发育迟缓,这是子痫前期的一个重要特征,本实验研究结果与Neerhof等[11]的观点一致。同时,应用L-NAME后胎鼠胎盘血液灌注量减少所导致胎盘面积变小、炎性细胞浸润及纤维素样坏死、滋养叶细胞增生、出血性梗死等胎盘病理变化,也与人类子痫前期胎盘的病理改变相符。此外,L-NAME还可导致胎鼠发育畸形,主要表现为后肢短缩畸形。Reyes等[12]认为NO在胎鼠发育过程中起着重要作用,胎鼠脉管系统NO分泌水平与胎鼠后肢发育相关,NO合成减少可导致后肢发育障碍。该子痫前期动物模型制作方法较国内外学者应用的寒冷刺激、双侧子宫动脉结扎术等方法明显更简单、重复性好、成功率高,且更可靠和准确。
综上所述,注射L-NAME可导致孕鼠产生类似人类子痫前期的表现,而且在病理生理方面也与人类子痫前期极其相似,是一个较为理想的研究子痫前期的动物模型。
[1]Ranjkesh F,Jaliseh HK,Abutorabi S.Monitoring the copper content of serum and urine in pregnancies complicated by preeclampsia[J].Biol Trace Elem Res,2011,144(1-3):58-62.
[2] Baumwell S,Karumanchi SA.Pre-eclampsia:clinical manifestations and molecular mechanisms[J].Nephron Clin Pract,2007,2:c72-81.
[3]Zdoukopoulos N,Doxani C,Messinis IE,et al.Polymorphisms of the endothelial nitric oxide synthase(NOS3)gene in preeclampsia:a candidate-gene association study[J].BMC Pregnancy Childbirth.2011,11:89.
[4]Tsukimori K,Komatsu H,Fukushima K,et al.Inhibition of nitric oxide synthetase at mid-gestation in rats is associated with increases in arterial pressure,serum tumor necrosis factor-alpha,and placental apoptosis[J].Am J Hypertens,2008,21(4):477-481.
[5]林其德.妊娠高血压综合征病因学研究进展与展望[J].中华妇产科杂志,2003,38(8):471-473.
[6]Sonin DL,Galagudza MM,Syrenskiĭ AV,et al.Contribution of nitric oxide in the mechanisms of flow-dependent vasodilation in normo-and hypertensive rats[J].Ross Fiziol Zh Im I M Sechenova,2011,97(8):814-823.
[7]段 涛,丰有吉,狄 文.威廉姆斯产科学[M].济南:山东科学技术出版社,2006,499-536.
[8]Grujić I,Milasinović L.Hypertension,pre-eclampsia and eclampsia--monitoring and outcome of pregnancy[J].Med Pregl,2006,59(11-12):556-559.
[9]Eastabrook G,Brown M,Sargent I.The origins and end-organ consequence of pre-eclampsia[J].Best Pract Res Clin Obstet Gynaecol.2011,25(4):435-447.
[10]Lorquet S,Pequeux C,Munaut C,et al.Aetiology and physiopathology of preeclampsia and related forms[J].Acta Clin Belg,2010,65(4):237-241.
[11]Neerhof MG,Synowiec S,Khan S,et al.Impact of endothelin A receptor antagonist selectivity in chronic nitric oxide synthase inhibition-induced fetal growth restriction in the rat[J].Hypertens Pregnancy,2010,29(3):284-293.
[12]Reyes CA,Hefler LA,O'Brien WE,et al.Perinatal development of endothelial nitric oxide synthase-deficient mice[J].Biol Reprod,2001,64(2):666-673.
Establishment of rats model of preeclampsia.
LU Min,GONG Hu-ming*,SHI Lei,CHEN Fang-rong.Department ofObstetrics,People's Hospital of Hainan Province,Haikou 570311,Hainan,CHINA
Objective To study the cause,pathogenesis,treatment and prevention of preeclampsia,and to establish an ideal animal model of preeclampsia.Methods The pregnant rats were randomly divided into two groups:the control group and preeclampsia group.The pregnant rats of two groups were respectively injected physiological saline and L-NAME after the 12thday of pregnancy,for seven days.Systolic pressure of caudal artery was measured since the tenth day of pregnancy,once per day.The urine protein,liver and kidney function,area of placenta,length and weight of fetus were measured in the two groups.The histological change of placenta and other organs were also observed.Results The systolic pressure of pregnant rats caudal artery slightly decreased along with the progress of pregnancy in the control group.The systolic pressure of caudal artery significantly increased after the thirteenth day of pregnancy in preeclampsia group.The urine protein,changes of liver and kidney function,pathological changes,growth retardation of fetus were observed in preeclampsia group,compared with that in control group.Conclusion L-NAME can induce the manifestation of preeclampsia in pregnant rats,which is extremely similar with preeclampsia of human in the aspects of pathophysiology,and thus provide an ideal method to establish an animal model of preeclampsia.
Rats;L-NAME;Preeclampsia;Systolic pressure
R-332
A
1003—6350(2012)16—021—03
10.3969/j.issn.1003-6350.2012.16.008
海南省自然科学基金(编号:琼科30636)
卢 敏(1978—),女,海南省琼海市人,副主任医师,硕士。*
龚护民(1972—)。E-mail:Gonghm2000@hotmail.com
2012-02-29)
